Urolithin A在肺癌细胞系A549中的抗增殖效应
2021-01-29窦晋涛吴志浩
程 峰,窦晋涛,2,张 庸,3,王 祥,4,吴志浩,5
(皖南医学院 1.肿瘤微环境研究室;2.麻醉学院;3.临床医学院;4.检验学院;5.基础医学院,安徽 芜湖 241002)
据统计,肺癌发病率居所有癌症之首,是预后极差的恶性肿瘤,5年生存率仅为19%[1]。尽管化疗以及近年来兴起的肿瘤免疫治疗对肺癌显示很好的作用[2],然而肺癌细胞仍然表现出耐药现象[3-4],给肺癌的诊疗带来了一定的困难。因此寻找其他的靶点以及开发新的药物变得尤为重要。
近年来大量研究发现肠道菌群生态与人体健康密切相关[5]。尿石素A(Urolithin A)是一种肠道代谢产物。石榴中含有大量的多酚类鞣酸,食用后经肠道微生物分解后形成活性产物Urolithin A[6]。Urolithin A具有抗氧化[7]、肌肉重塑[6]、抗炎症[8]的作用。本研究旨在探究Urolithin A对肺癌细胞的杀伤作用,为临床用药提供指导。
1 材料与方法
1.1 细胞株、主要试剂和仪器 人肺癌细胞系A549(中科院细胞库),Urolithin A(SIGMA),MTT(Beyotime),SA-β-gal试剂盒(Beyotime),膜和胞浆蛋白提取试剂盒(Beyotime),Laemmli 2×浓缩液(SIGMA),Annexin V-FITC/PI试剂盒(BD公司);p53抗体,p21抗体,Cleaved PARP抗体,PUMA抗体购自CST公司。p53 shRNA(addgene)。酶标仪(BioTek),垂直电泳仪(Biorad),凝胶成像仪(GE,AI600),硝化纤维素(NC)膜(GE Healthcare)。
1.2 方法
1.2.1 细胞培养 培养条件:10%FBS的DMEM培养基,37℃,5%的CO2的培养箱,细胞均用胰酶消化传代,实验处理期均为对数生长期。
1.2.2 MTT实验 待A549细胞生长至对数期,消化离心,将其接种到96孔板中,放在37℃,5%的CO2培养箱中培养。细胞长满后,实验设置对照组、不同剂量组,每组设4个复孔。对照组、不同剂量组的Urolithin A浓度分别为0、2.5、5、10、30、50 μmol/L。48 h后用稀释后的MTT溶液处理,放置于37℃,5%的CO2培养箱孵育4 h。将96孔板拿出,在超净台里每孔加入150 μL的DMSO溶液。常温下,避光,在摇床上孵育15 min。用酶标仪在490波长处测每个孔的OD值。
1.2.3 流式细胞术检测细胞凋亡 待六孔板中细胞长至90%时,用无血清的DMEM培养基饥饿A549细胞过夜。加入不同浓度(10、20 μmol/L)的Urolithin A处理细胞24 h。无EDTA的胰酶溶液消化,用PBS悬浮细胞离心,收集约1×105细胞。500 μL的Binding Buffer悬浮细胞后,加入5 μL的Annexin V-FITC,吹打后再加入5 μL的PI染料混匀。常温避光15 min。用流式细胞仪检测细胞凋亡情况。
1.2.4 SA-β-gal实验检测细胞衰老 加入不同浓度(5、20 μmol/L)的Urolithin A处理六孔板中的细胞。24 h后,用细胞衰老β-半乳糖苷酶染色试剂盒检测。用酶标仪检测细胞衰老程度。
1.2.5 Western blot实验 用样品缓冲液Laemmli 2×浓缩液对细胞进行刮除并收集,用膜和胞浆蛋白提取试剂盒分离总蛋白或膜蛋白浓度。用聚丙烯酰胺凝胶电泳分离每个样品的蛋白质,然后转移到硝化纤维素(NC)膜并用抗体孵育。这些信号被曝光机曝光成影,用PS软件截图分析。
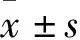
2 结果
2.1 Urolithin A对A549细胞增殖的影响 与对照组相比,2.5、5、10、30、50 μmol/L的Urolithin A处理A549细胞24 h后,细胞活力均下降(P<0.05)。见图1。
F=88.95,P=0.000;与对照组相比,*P<0.05,**P<0.01。
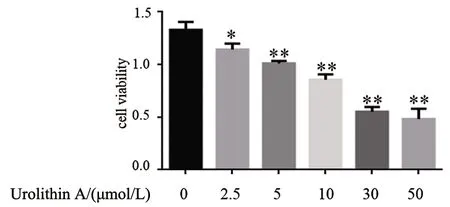
2.2 Urolithin A对A549细胞凋亡的影响 与对照组相比,10、20 μmol/L的Urolithin A处理24 h后,A549细胞凋亡数均增加(P<0.05)。见图2。
F=29.97,P=0.001;与对照组相比,*P<0.05,**P<0.01。
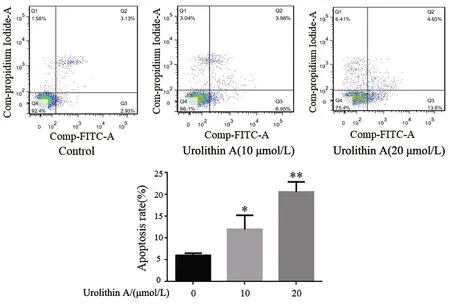
2.3 Urolithin A对A549细胞衰老的影响 10、20 μmol/L的Urolithin A处理24 h后,被SA-β-gal染色的衰老细胞数均增加(P<0.05)。见图3。
F=142.20,P=0.000;与对照组相比,**P<0.01。
2.4 Urolithin A处理A549细胞对细胞衰老和凋亡相关蛋白的影响 2.5、5、10、30、50 μmol/L的Urolithin A处理肺癌A549细胞12 h后,与对照组相比,Cleaved PARP、p21、PUMA、p53蛋白表达均升高(P<0.05),见图4A。用shRNA敲降p53,相同浓度Urolithin A处理后,Cleaved PARP、p21、PUMA的表达均下调(P<0.05),见图4B。
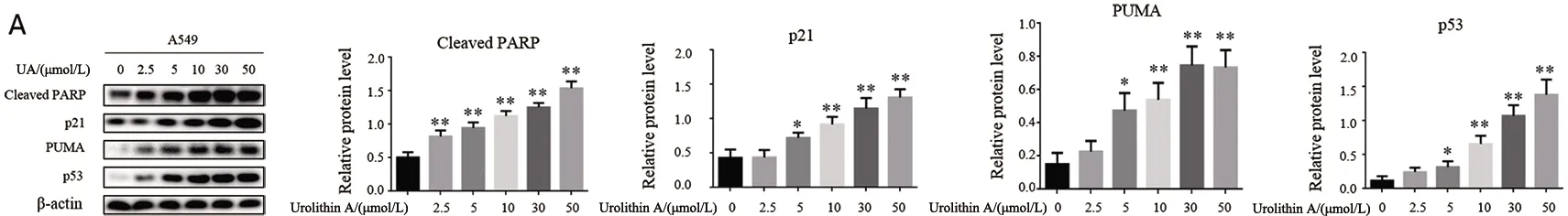
A.F=57.30,P=0.000;F=28.92,P=0.000;F=20.30,P=0.000;F=44.00,P=0.000;与Urolithin A(0 μmol/L)相比,*P<0.05,**P<0.01;B.t1=4.086,t2=5.824,t3=3.326,t4=11.910,P1=0.015,P2=0.028,P3=0.029,P4=0.000;t1=9.216,t2=7.140,t3=4.501,t4=11.800,P1=0.001,P2=0.019,P3=0.011,P4=0.000;t1=7.547,t2=3.391,t3=4.096,t4=14.460,P1=0.002,P2=0.028,P3=0.015,P4=0.000;相同浓度Urolithin A,敲降p53与未敲降相比,*P<0.05,**P<0.01。
2.5 Urolithin A通过p53抑制A549细胞的增殖 MTT实验结果显示,shRNA敲低p53能减弱Urolithin A对A549细胞引起的增殖抑制(P<0.05)(图5A)。同时,用不同浓度的Urolithin A处理肺癌细胞H1299(p53缺失型),低浓度组(2.5、5 μmol/L)对细胞增殖无影响(P>0.05),高浓度组(10、30、50 μmol/L)对H1299细胞有轻微抑制作用(P<0.05)(图5B)。

A.F=82.19,P=0.000;Urolithin A(10 μmol/L)+shp53组与单用Urolithin A(10 μmol/L)组相比,**P<0.01;B.F=48.33,P=0.000;与Urolithin A(0 μmol/L)相比,**P<0.01。
3 讨论
近年来,肺癌的治疗手段呈现多样化发展,尤其比较盛行的PD1/PD-L1疗法,对晚期肺癌的生存率有很大的延长效应,但是总体存活率低,预后不良依然严重。因此寻找新药和靶标显得尤为重要。
本研究发现,Urolithin A能够抑制A549细胞的增殖,进一步通过流式细胞术和SA-β-gal实验证明了Urolithin A能够促进A549细胞凋亡和衰老。然而Urolithin A究竟通过什么信号传导通路促进A549细胞凋亡和衰老,具体的分子机制还不是很清楚,值得我们深入探讨。
细胞凋亡是比较常见的细胞程序性死亡方式,受基因调控。PARP是一种DNA修复酶,参与DNA修复工作。一般来说,PARP蛋白被Caspase蛋白切割成Cleaved PARP是细胞发生凋亡的标志[9]。通过Western blot实验发现Urolithin A能够上调Cleaved PARP的水平,进一步证明Urolithin A处理A549细胞,促使其发生凋亡。在50%的癌症中,最常见的突变之一是肿瘤抑制基因TP53,包括其功能的丧失或获得[10]。由于其抑癌活性,转录因子p53被认为是基因组的守护者或看护者。p53可调控细胞周期阻滞[11]、凋亡[12]和DNA修复相关基因的表达[13]。PUMA是p53的直接转录靶标,它能诱导大部分癌症细胞的凋亡。PUMA是Bcl-2家族的成员之一,具有一个“BH3-only”结构域。PUMA位于线粒体中,并触发线粒体功能障碍介导的细胞凋亡。它通过Bax/Bak对抗BCL-XL和MCL-1的功能[14]。细胞衰老也是由基因控制的一种生物学现象,相应的,细胞衰老的分子机制有很多种。p53-p21是比较经典的细胞衰老调控通路[15],p53的主要靶基因是p21,将导细胞周期阻滞在G1/S期。因此我们猜想Urolithin A是否通过p53介导了A549细胞的凋亡和衰老?
肺癌细胞系A549遗传背景为野生型p53,而本研究发现Uroltihin A能够上调p53蛋白的表达,且有浓度依赖性。再次通过Western blot实验显示,Urolithin A也能使转录因子p53下游基因p21、PUMA的表达上调。原因可能为Urolithin A通过p53介导了下游p21、PUMA的表达。用p53的shRNA沉默抑癌基因p53,再用Urolithin A处理,下游基因p21、PUMA明显下调。MTT实验结果显示,shRNA敲低p53能减弱Urolithin A对A549细胞引起的增殖抑制,同时Urolithin A对p53缺失型肺癌细胞H1299不敏感,这更一步证明了,p53介导了p21和PUMA的上调,且p53是Urolithin A引起A549细胞发生凋亡和衰老的关键因子。
虽然本研究结果证明了Urolithin A能够抑制A549细胞增殖,并且从细胞凋亡和细胞衰老两方面进行了研究,但是仍有部分分子机制没有探究清楚。①Urolithin A如何上调p53蛋白的表达,直接还是间接?②还需要构建p53、p21、PUMA等基因表达载体,来使Urolithin A-p53-p21/PUMA通路的研究更加有说服力。同时,通过裸鼠成瘤实验在活体水平上来检测是否有意义也有待于进一步验证。
