PAF与肿瘤坏死因子-α及肺表面活性蛋白A在新生儿急性肺损伤中的表达及相关性*
2021-01-28王嘉兴袁二伟王瑞娟赵美林张艳君
王嘉兴 袁二伟 王瑞娟 赵美林 张艳君
(河北北方学院附属第一医院新生儿科,河北 张家口 075000)
新生儿急性肺损伤是指机体因为严重的疾病导致肺泡毛细血管膜损伤,引发肺水肿、肺不张,患儿的主要临床表现为起病急,呼吸窘迫,严重的低氧血症[1]。也有研究指出,各种危重病均会损伤新生儿肺组织,进而引发炎症反应,新生儿急性肺损伤发生[2]。新生儿急性肺损伤重点在于早期治疗,肺组织病理学检查虽然准确,但是难以在临床重视实现,因此寻找有效的诊断方式对新生儿来说具有重要意义。当炎性介质释放过度,也会引发新生儿急性肺损伤发生,肺瘤坏死因子-α(TNF-α)参与组织炎症损伤过程,对其他炎症因子有促进释放的作用[3-4]。血小板活化因子(PAF)也参与新生儿急性肺损伤过程。肺表面活性蛋白A(SP-A)主要存在与肺泡Ⅱ型上皮细胞、细支气管非纤毛上皮细胞中,表达较强,信号也较为丰富,常作为肺部疾病的监测指标[5]。本文探讨PAF、TNF-α、SP-A在新生儿急性肺损伤中的表达及相关性。
1 对象与方法
1.1 研究对象 选取2018年9月~2019年9月在我院就诊的急性肺损伤新生儿70例设为急性肺损伤组,选取同一时期在我院就诊的肺炎新生儿50例设为肺炎组,另外选取在我院健康体检的新生儿50例设为对照组。纳入标准:患儿均符合急性肺损伤的诊断标准[6]:①起病急,患儿表现为呼吸急促、窘迫。②伴有低氧血症、PaO2/FiO2值<300 mmHg。③经X线胸片检查发现患儿两肺有弥漫性浸润影。④患儿肺动脉楔压≤18 mmHg。所有患儿入院时间为24~48h。排除标准:①先天性肺功能不全患儿。②合并肝、肾、心等重要脏器功能损伤患儿。③病历资料不全患儿。本研究所有患儿家属均知情并签署知情通知书。
1.2 方法
1.2.1 标本采集 抽取所有研究对象入院当天的空腹静脉血液3 mL,以3000 r/min离心速度,离心处理10 min后,分离上层血清,在-80 ℃环境中保存,待检。
1.2.2 PAF、TNF-α检测 采用酶联免疫吸附试验(ELISA)检测PAF、TNF-α水平,具体操作:①将待检标本使用0.05 mol/L PH为9.6的NaCO3-NaHCO3缓冲液稀释,加入酶联板孔中,每孔加入100 μL稀释液,在4 ℃过夜保存。②使用PBST洗涤液清洗3次,每次3 min。③每孔中加入5%的小牛血清PBST 200 μL,在37 ℃封闭处理30 min。④使用PBS洗涤液清洗3次,每次3 min。⑤每孔中加入5%的小牛血清PBST稀释后的酶标单克隆抗体100 μL,37 ℃孵育1 h。⑥使用PBST洗涤液清洗3次,每次3 min。⑦每孔中加入100 μL由(20 mg的邻苯二胺,24.3 mL 0.1 mol/L的柠檬酸,25.7 mL 0.2 mol/L的Na2HPO4,75 μL 30%的H2O2)配制的底物溶液,37 ℃处理30 min。⑧每孔中滴加2 mol/L的H2SO4给予反应终止。观察结果。
1.2.3 SP-A检测 SP-A检测采用免疫斑点实验法进行,具体操作:将0.01 M PBS PH为7.4的稀释抗原液取2 μL,滴入硝酸纤维素膜中,在37 ℃的温箱中连续干燥20~30 min,之后滴加封闭液,继续在37 ℃的温箱中干燥10 min,使用洗涤液清洗1~2次,滤纸吸干,滴加待检的标本,在37 ℃的湿盒中干预30 min,使用洗涤液进行震荡冲洗3次,每次3 min,之后吸干水分,水洗终止反应,观察结果。
2 结果
2.1 3组研究对象一般资料比较 3组研究对象性别、平均胎龄、自然分娩/剖宫产、平均体重等一般资料比较,差异均无统计学意义(P>0.05),见表1。

表1 各组研究对象一般资料比较Table 1 Comparison of general data of each group
2.2 PAF、TNF-α、SP-A在新生儿急性肺损伤中的表达 肺炎组和急性肺损伤组PAF、TNF-α表达水平高于对照组,SP-A水平低于对照组,差异均有统计学意义(P<0.05)。急性肺损伤组PAF、TNF-α表达水平高于肺炎组,SP-A水平低于肺炎组,差异均有统计学意义(P<0.05),见表2。

表2 各组PAF、TNF-α、SP-A表达比较Table 2 Comparison of PAF,TNF -α and SP-A expression in each group
2.3 不同时期患儿PAF、TNF-α、SP-A表达比较 急性期PAF、TNF-α表达水平高于恢复期,SP-A水平低于恢复期,差异均有统计学意义(P<0.05),见表3。

表3 不同时期患儿PAF、TNF-α、SP-A表达比较Table 3 Comparison of PAF,TNF -α and SP-A expression in children of different periods
2.4 存活组和死亡组PAF、TNF-α、SP-A表达比较 死亡组PAF、TNF-α表达高于存活组,SP-A水平低于存活组,差异均有统计学意义(P<0.05),见表4。

表4 存活组和死亡组PAF、TNF-α、SP-A表达比较Table 4 Comparison of expression of PAF,TNF -α and SP-A in survival and death groups
2.5 PAF、TNF-α、SP-A相关性分析 经过Pearson相关性分析发现,PAF、TNF-α之间呈正相关(r=0.485,P=0.001);TNF-α、SP-A之间呈负相关(r=-0.358,P=0.002);PAF、SP-A之间呈负相关(r=-0.245,P=0.041),见图1。
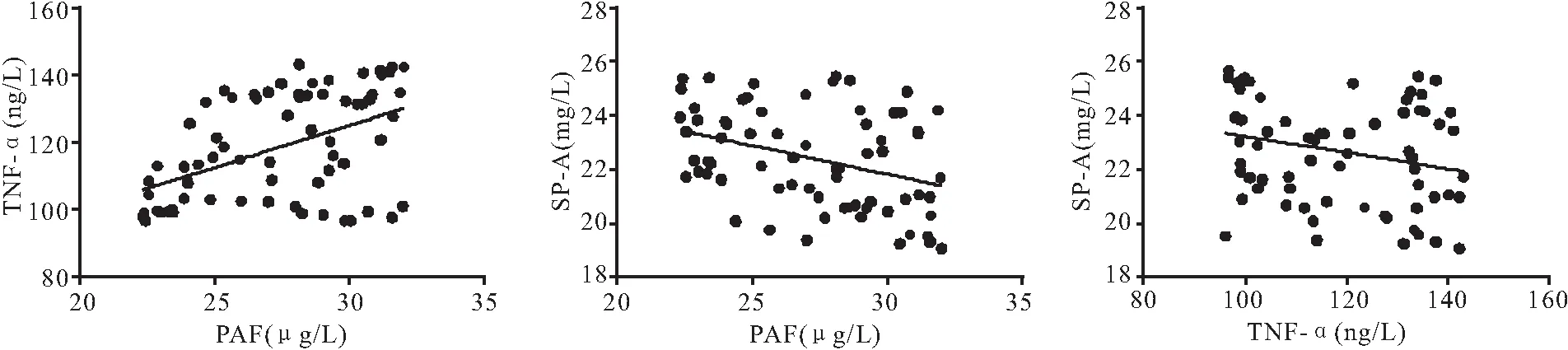
图1 PAF、TNF-α、SP-A相关性分析Figure 1 Correlation analysis of PAF,TNF -α and SP-A
3 讨论
新生儿急性肺损伤发生时,肺部炎症表现为瀑布反应,呼吸膜结构发生损伤,增加呼吸膜对液体、溶质的通透性,引发肺水肿[7]。新生儿急性肺损伤属于新生儿急重症,引起患儿肺功能出现障碍,导致新生儿死亡。引起新生儿急性肺损伤发病的因素有很多,主要有机体创伤、酸中毒、休克、感染等,严重的新生儿急性肺损伤会发展成急性呼吸窘迫综合征[8-9]。相关研究[10]显示,缺氧的严重程度、器官功能衰竭等均会导致新生儿急性肺损发病率上升。
PAF属于一种磷脂介质,具有内源性及广泛的生物活性,相关研究显示,PAF能促进核因子κB活化,中性粒细胞也因此在肺组织中集聚,造成肺组织损伤,在成人急性肺损伤疾病中,PAF显示高水平[11-12]。在动物研究中,PAF抑制剂通过调控PAF水平,抑制急性肺损伤发展,并且降低PAF活化,能起到抗炎性作用[13]。本研究肺炎组和急性肺损伤组PAF表达水平高于对照组,其中急性肺损伤组PAF表达水平最高。说明PAF在急性肺损伤中显示高水平,参与其疾病发展。TNF-α由多种单核吞噬细胞分泌、产生,在炎症反应中发挥着重要作用,并且对其他的炎性介质有诱导、调节功能。TNF-α水平升高对血管内皮损伤起到直接作用,通过对中性粒细胞进行刺激,释放脱颗粒以及溶酶体酶,促进细胞因子合成、释放,对血管活性物质的形成产生影响[14-15]。本研究结果显示在新生儿急性肺损伤中TNF-α水平较高,可能参与其疾病发生。分析原因是,TNF-α水平升高,刺激内皮细胞、中性粒细胞发生黏附,释放PAF、蛋白酶等大量的毒性介质;同时刺激单核巨噬细胞,促进IL-8、IL-1等因子释放,对肺组织带来损伤[16]。SP-A是一种表面活性物质的特异性蛋白,具有复杂的功能和生物学特性,在新生儿急性肺损伤以及急性呼吸窘迫综合征研究中,SP-A可以作为两种疾病早期诊断指标[17]。研究认为,新生儿急性肺损伤中SP-A通过被损伤的肺泡-毛细血管膜进入到血液中,导致血液中SP-A含量增加,与肺损伤病情严重程度有关,通过动态监测SP-A表达水平,对疾病的判断以及预后具有重要作用[18-19]。本文肺炎组和急性肺损伤组SP-A水平低于对照组,急性肺损伤组SP-A水平低于肺炎组,说明SP-A可以作为诊断新生儿急性肺损伤的有效指标。
急性期PAF、TNF-α表达水平高于恢复期,SP-A水平低于恢复期;死亡组PAF、TNF-α表达水平高于存活组,SP-A水平低于存活组。分析原因:SP-A蛋白为双向流动,在新生儿急性肺损伤中,流入到肺泡腔中的血浆蛋白会将白细胞激活,促进白细胞介素、TNF-α、蛋白酶等释放,对肺泡-毛细血管膜产生损伤,增加渗透性,从而引发疾病发生[20]。经Pearson相关性分析发现,PAF、TNF-α、SP-A之间呈相关性,其中一种水平发生变化均会对其他两者产生影响,PAF、TNF-α、SP-A参与新生儿急性肺损伤发病,可以作为新生儿急性肺损伤的诊断指标,反应患儿病情。
4 结论
PAF、TNF-α、SP-A在新生儿急性肺损伤中表达异常,三者水平与新生儿急性肺损伤不同患病程度、存活情况有关,三者之间有一定的相关性,参与新生儿急性肺损伤的发生,具有重要临床意义。
