益肺散结方对肺纤维化大鼠模型自噬及PI3K-AKT-mTOR通路的影响
2021-01-28韩欣丁晓玲余涛包蕊王馨
韩欣 丁晓玲 余涛 包蕊 王馨
(青海省妇幼保健院药剂科,青海 西宁 810007)
肺纤维化( PF) 是指因肺泡损伤、成纤维细胞增殖、肺泡细胞外基质破坏及过度沉积等多种原因导致的一种肺间质性疾病,可使患者产生呼吸困难、干咳、肺功能通气障碍、呼吸衰竭等症状[1-3]。PF发病率和死亡率逐年升高,严重威胁患者生命健康[4-5]。PF发病机制复杂,有研究[6]发现,细胞自噬及上皮细胞间质转化与PF的发生发展程密切相关。磷脂酰-3激酶(Phosphatidyl-3 kinase,PI3K)/ 蛋白激酶B ( Protein kinase B,Akt)/雷帕霉素靶分子(Rapamycin target molecule,mTOR)信号通路参与调控细胞自噬过程[7],故调控PI3K/Akt/mTOR信号通路表达,激活肺组织细胞自噬,可缓解PF进程。近来有研究[8-9]发现,益肺散结方对肺癌有较好的疗效,且方中黄芪对PF也有一定的治疗效果,故本研究推测益肺散结方可能对PF也有较好的疗效,并建立大鼠PF模型,探讨益肺散结方对大鼠PF过程中PI3K/Akt/mTOR通路和细胞自噬的影响,以期为中药方剂益肺散结方新疗效的开发和临床合理用药提供参考。
1 材料和方法
1.1 实验动物 选取清洁级同遗传背景的SD大鼠50 只,体重 200~220 g,由广东省医学实验动物中心提供,生产许可证号为SCXK(粤) 2018-0002,动物质量合格证号为省科委2000A027。所有大鼠于本院动物房中饲养,饲养条件:自然光照,自由饮食、饮水,温度25 ℃,相对湿度50%,鼠笼清洁、透气。本研究经本院动物伦理委员会批准同意,实验遵循3R原则。
1.2 主要试剂及仪器 益肺散结方组成(黄芪30 g、麦冬15 g、沙参15 g、薏苡仁30 g、杏仁10 g、浙贝母10 g、皂角10 g、莪术15 g、金荞麦 30 g、白花蛇舌草30 g)常规煎药,药液浓缩至生药含量为5.0 g/mL;博莱霉素(Bleomycin,BLM)购自美国英杰生命技术有限公司(货号:R250-01);组织蛋白酶D (cathepsin D,Cat-D)购自美国伯豪生物BD公司(货号:DXT-610800);泛素和LC3结合蛋白p62(ubiquitin-andLC3-binding protein p62,p62)抗体购自北京博奥森生物技术有限公司(货号:bs-2951R-2);自噬相关蛋白beclin-1抗体购自北京博奥森生物技术有限公司(货号:bs-1501P);ɑ-平滑肌动蛋白( ɑ-smooth actin,ɑ-SMA)购自北京百奥莱博科技有限公司(货号:YI634-LCE);微管相关蛋白轻链3(microtubule-associated protein 1 light chain3,LC3-Ⅱ)/LC3-I 购自北京索莱宝科技有限公司(货号:K000467P);羟脯氨酸elisa试剂盒购自上海联迈生物工程有限公司(货号:LM-13650-EB);HE染色试剂盒购自上海生物公司(货号:G1120);马松(Masson) 染色试剂盒购自爱必信(上海)生物科技有限公司(货号:abs9347);p-PI3K/PI3K抗体(货号:FNAB06243,购自武汉菲恩科技生物有限公司);Akt抗体(货号:ab8805,购自美国Abcam);p-mTOR/mTOR抗体(货号:ab2732,购自美国Abcam);蛋白提取试剂盒、BCA试剂盒(货号P0027上海碧云天公司)等。手动轮转式切片机(型号RM2125RTS,德国Leica公司);光学显微镜(型号SMZ745,日本尼康公司);酶标仪(型号XElx800,美国Perkin Elmer公司);蛋白电泳仪、半干转膜仪(型号1659001、Trans-Blot SD,美国Bio-Rad公司);凝胶成像仪(型号:GIS-500,Miulab公司)等。
1.3 方法
1.3.1 大鼠PF模型建立及分组给药 参照文献[9]构建PF模型,具体操作方法为:随机取40只大鼠,用3%戊巴比妥钠经腹腔注射麻醉大鼠后,固定大鼠,并用开口器固定口腔,拉出舌头后,用压舌板压住舌腹,行气管插管并缓慢注入博莱霉素(溶于0.9%的氯化钠注射液)5 mg/kg,0.3 mL,然后将大鼠直立,沿身体纵轴旋转3 min即可。将造模成功的大鼠分为PF组、益肺散结方低(7.5 g/kg)、中(15 g/kg)、高(30 g/kg)剂量组,每组10只;另取10只大鼠,除行插管后缓慢注入0.9%的氯化钠注射液0.3 mL外,其余操作同模型组,将其作为对照组。造模结束后2 h开始给药,益肺散结方参照文献[8]以生理盐水配置为含生药量0.75、1.50、3.00 g/mL的混悬液,各处理组大鼠均以10 mL/kg的剂量灌胃给药,对照组与PF组灌胃给予生理盐水,各组连续给药21 d,1次/d。
1.3.2 肺组织标本采集 给药期间观察大鼠呼吸、毛发、体态及行为活动。于末次给药24 h后,用3%戊巴比妥钠麻醉大鼠后并处死,解剖大鼠,分别摘取大鼠左右两肺,经磷酸缓冲盐冲洗后,左肺置于10%甲醛中固定以备作病理检查,右肺迅速置于-80 ℃冰箱中保存备用。
1.3.3 肺组织HE染色法检测病理组织形态及炎症水平 取1.2.2中的左肺,进行常规透明、浸蜡、包埋后、切成厚度为5 μm的切片。将切片进行二甲苯脱蜡,梯度酒精水化后,用苏木精-伊红染色 5 min,1%盐酸酒精分化 10 s,蒸馏水漂洗2 min,梯度酒精脱水2 min,二甲苯透明处理,中性光学树脂封片后,置于光镜下观察分析肺组织结构。随机选取5个视野,参照文献[10]用单盲法观察肺泡炎症并计分:0分,肺泡透亮、结构清晰、间隔正常;1~2分,肺泡结构稍紊乱、间隔增生增宽,且有少量炎性细胞浸润,病变范围占全肺20%;3~5分,肺泡结构紊乱、间隔明显增宽,炎性细胞浸润较多,病变范围占全肺20%~50%;6~8分,肺泡结构紊乱,肺泡融合、间隔显著增宽,炎性细胞大量浸润,成纤维细胞增生,胶原纤维大量沉积,病变范围占全肺20%~50%。每组5个样本分别评分,取平均值。
1.3.4 肺组织马松( Masson) 染色法检测胶原增殖程度 取1.2.3项下每组切片,用二甲苯脱蜡2次,15 min/次,用高浓度到低浓度酒精脱水,温水漂洗后按Masson试剂盒说明书操作。置于显微镜下观察,随机选取5个视野,参照文献[10]用单盲法观察肺纤维化程度并计分:0分,肺泡结构清晰、间隔正常,无肿胀;1~2分,肺泡轻微肿胀、有少量纤维化出现;3~4分,肺泡壁增大,出现小面积纤维灶;5~6分,纤维化区域增大,出现连续的纤维灶;7~8分:肺泡结构破坏显著,纤维灶融合,出现连续大片的纤维灶;9~10分:肺泡空隙消失,肺泡腔充斥大量纤维,肺完全纤维化,每组5个样本分别评分,取平均值。
1.3.5 羟脯氨酸试剂盒测定胶原蛋白含量 取1.2.2中的右肺,于4 ℃冰箱中解冻后,取100 g匀浆,参照文献[12]取按碱性水解法裂解组织,离心后取上层清液1 mL,按羟脯氨酸试剂盒说明书进行测定。
1.3.6 Western blot法检测肺组织通路蛋白p-PI3K/ PI3K、p-AKT/AKT、p-mTOR/mTOR及自噬相关蛋白 beclin-1、p62 、ɑ-SMA、LC3-Ⅱ/ LC3-I蛋白的表达 取1.2.2中-80 ℃保存的右肺组织,于4 ℃冰箱中解冻后,剪取0.5 g,用组织匀浆器匀浆、离心分离后,取上层清液,用蛋白裂解液裂解离心后提取蛋白,用BCA试剂盒检测蛋白总浓度,取50 μg蛋白上样,进行电泳和转膜反应,TBST溶液清洗后,加入5%脱脂牛奶室温下封闭1 h,TBST溶液清洗3次后,加入一抗(p-PI3K、PI3K、p-mTOR、mTOR、p-AKT、AKT、beclin-1、p62、LC3-Ⅱ、LC3-I,β-actin(内参)抗体,稀释倍数分别为1∶1000,1∶1000,1∶1000,1∶1000,1∶2000,1∶1000,1∶2000,1∶2000,1∶2000,1∶2000,1∶2000,4℃摇床室温孵育过夜,TBST振洗后加入HRP羊抗兔二抗(稀释倍数1∶2000),37 ℃摇床室温孵育1 h,TBST清洗3次后,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达。
2 结果
2.1 大鼠一般行为观察 对照组大鼠毛色光洁,呼吸、饮食正常,活动良好。PF组大鼠随时间延长,呼吸喘促、毛色粗糙、饮食减少、形体消瘦、精神萎靡,鼠爪和鼠尾出现紫绀。益肺散结方各剂量组呼吸喘促次数减少、饮食量均明显好于PF组。
2.2 大鼠肺组织病理损伤程度及炎性评分检测 对照组大鼠肺组织肺泡结构清晰正常。与对照组比较,PF组大鼠肺组织可见肺泡融合、间隔显著增宽,炎性细胞大量浸润,且有成纤维细胞增生堆积挤,炎性评分增高(P<0.05);与PF组大鼠比较,益肺散结方低、中、高剂量组大鼠炎性细胞浸润减少,肺泡结构稍紊乱,炎性评分降低(P<0.05);益肺散结方各剂量组随剂量增加,炎性浸润及评分降低(P<0.05),见图1、表1。

图1 HE染色检测大鼠肺组织病理损伤(200×)Figure 1 HE staining to detect the pathological damage of rat lung tissue
表1 各组大鼠炎性程度评分和纤维化程度评分比较Table 1 Comparison of inflammatory degree score and fibrosis degree score of rats in each group
2.3 大鼠肺组织纤维化程度评分检测 对照组大鼠肺组织肺泡结构正常。与对照组比较,PF组大鼠肺组织可见肺泡结构粘连、闭合,有大量胶原组织增殖,且纤维化程度评分增高(P<0.05)。与PF组大鼠比较,益肺散结方低、中、高剂量组大鼠,肺泡结构少量残存,胶原纤维增殖减少,纤维化程度评分降低(P<0.05)。益肺散结方各剂量组随剂量增加、胶原组织增殖减少及纤维化程度评分降低(P<0.05),见图2、表1。
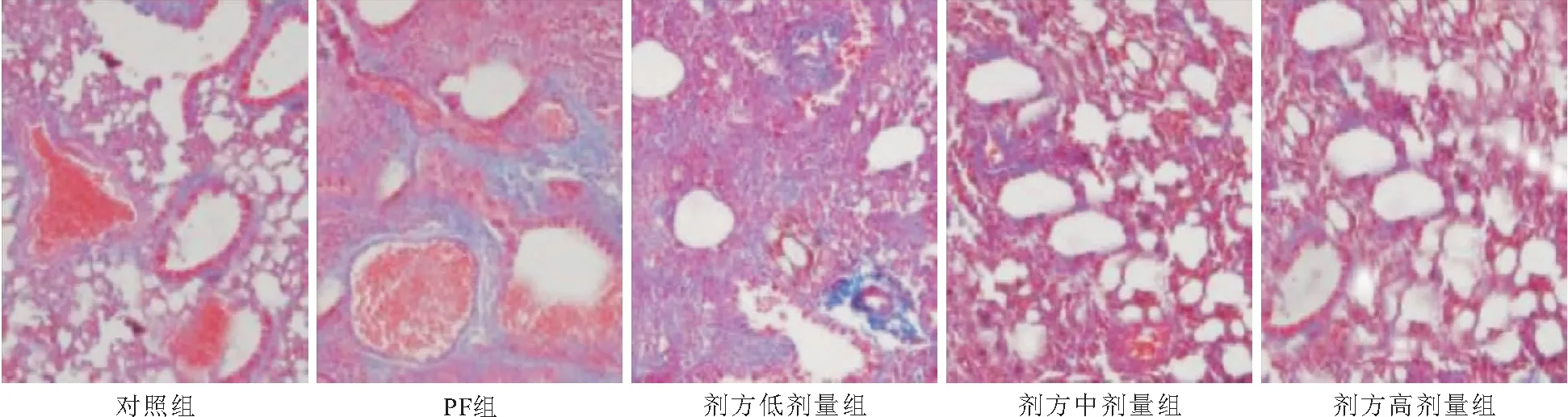
图2 Masson染色检测大鼠肺组织病理损伤(200×)Figure 2 Pathological damage of lung tissue detected by Masson staining
2.4 各组大鼠肺组织纤维蛋白含量的影响 与对照组相比,PF组大鼠肺组织纤维蛋白含量升高(P<0.05)。与PF组相比,益肺散结方低、中、高剂量组大鼠肺组织纤维蛋白含量降低(P<0.05),益肺散结方各剂量组纤维蛋白含量降低呈剂量依赖性(P<0.05),见表2。
表2 各组大鼠肺组织纤维蛋白含量结果表Table 2 Results of fibrin content in lung tissue of rats in each group
2.5 各组大鼠肺组织自噬相关蛋白 beclin-1、p62、ɑ-SMA、LC3-Ⅱ/ LC3-I表达的影响 与对照组相比,PF组大鼠p62 、ɑ-SMA蛋白表达升高(P<0.05),beclin-1和LC3-Ⅱ/ LC3-I蛋白表达下降(P<0.05);与PF组相比,益肺散结方低、中、高剂量组大鼠肺组织p62 、ɑ-SMA蛋白表达降低(P<0.05),beclin-1和LC3-Ⅱ/LC3-I蛋白表达升高(P<0.05);益肺散结方各剂量组p62 、ɑ-SMA蛋白表达降低、beclin-1和LC3-Ⅱ/LC3-I蛋白表达升高呈剂量依赖性(P<0.05),见图3、表3。
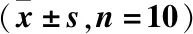
表3 各组大鼠beclin-1、p62、ɑ-SMA、LC3-Ⅱ/ LC3-I蛋白相对表达水平Table 3 Relative expression levels of beclin-1,p62,ɑ-SMA,LC3-Ⅱ / LC3-I protein of rats in each group
2.6 各大鼠肺组织通路蛋白p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR表达水平 与对照组相比,PF组大鼠p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白表达升高(P<0.05);与PF组相比,益肺散结方低、中、高剂量组大鼠肺组织p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白表达降低(P<0.05);益肺散结方各剂量组蛋白表达呈剂量依赖性降低(P<0.05),见图3、表4。
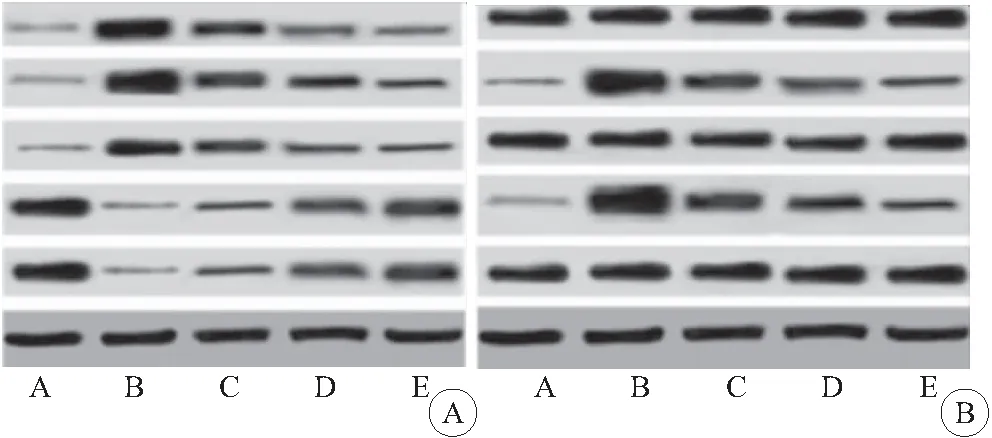
图3 各组大鼠肺组织蛋白表达免疫印迹图Figure 3 Western blot of protein expression in lung tissue of rats in each group注:A.对照组;B.PF组;C.剂方低剂量组;D.剂方中剂量组;E.剂方高剂量组。图A.大鼠肺组织自噬相关蛋白beclin-1、p62、ɑ-SMA、LC3-Ⅱ/LC3-I蛋白表达免疫印迹图;图B.大鼠肺组织通路蛋白p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白免疫印迹图

表4 各组大鼠肺组织通路蛋白p-PI3k/PI3k、p-AKT/AKT、p-mTOR/mTOR表达水平Table 4 The relative expression levels of p-PI3K/PI3K,p-AKT/AKT,p-mTOR/mTOR protein
3 讨论
PF确切发病机制不明,对于PF的治疗尚无特效药物[11]。西医研究发现,成纤细胞增殖及胞外基质在肺组织的过度沉积是PF的主要病理表现[10]。中医将PF归属为肺痹、肺痿、喘证等,且多以益气养阴、祛痰、止咳等方法治疗[12]。中医单方、验方、成药等在缓解PF患者症状、延缓患者生存方面具有其独特的优势[13]。文献报导,运用益气养阴、散结化瘀方法及中药黄芪提取物在治疗PF方面有较好效果[14],而中医验方益肺散结方具有益气养阴、化痰止咳功效,方中黄芪又为君药,故本研究推测益肺散结方也可能治疗PF,并建立大鼠PF模型对此进行验证,发现与对照组相比,PF组大鼠毛发稀疏,呼吸困难加重,HE及Masson 染色显示肺组织炎性及胶原增殖程度等病理损伤评分升高,且羟脯氨酸试剂盒检测胶原蛋白含量也明显升高,提示大鼠PF造模成功。而给予益肺散结方低、中、高剂量治疗后发现,大鼠呼吸困难现象缓解,肺组织炎性损伤、胶原增殖及含量也均比PF组降低,且益肺散结方各剂量组上述指标降低效果呈剂量依赖性增强,表明益肺散结方可降低PF大鼠肺组织胶原蛋白含量,缓解肺纤维化进程。
细胞自噬能够提高肺泡细胞生存能力,延缓PF进程[6]。Beclin1是自噬体形成过程中的重要分子[15]。LC3-II/LC3-I 比值大小可评估自噬水平的高低[16]。p62 参与泛素蛋白酶系统和自噬蛋白降解过程[17]。自噬缺陷可促进ɑ-SMA蛋白表达[18]。PI3K/Akt/mTOR参与肺纤维化进程中的自噬过程[7,10]。徐昌君等[10]发现黄芪甲苷可抑制PF模型小鼠肺组织中PI3K/Akt/mTOR信号通路,提高LC3-II/LC3-I、Beclin1自噬蛋白表达,降低ɑ-SMA和p62蛋白表达,增强肺组织细胞自噬活性,来抑制肺纤维化进程;He等[19]发现抑制PI3K/Akt/mTOR信号通路表达,可提高LC3-II/LC3-I、Beclin1自噬蛋白表达,降低p62蛋白表达,促进肝癌细胞的自噬与凋亡。本研究发现与对照组相比,PF组大鼠p-PI3K/ PI3K、p-AKT/AKT、p-mTOR/mTOR通路蛋白表达升高,而自噬蛋白LC3-II/LC3-I和Beclin1表达降低、ɑ-SMA和p62表达升高,提示PF模型大鼠肺组织PI3K/Akt/mTOR信号通路激活,自噬活性下降。而给予益肺散结方低、中、高剂量治疗后发现,大鼠肺组织p-PI3K/ PI3K、p-AKT/AKT、p-mTOR/mTOR通路蛋白表达降低,自噬蛋白LC3-II/LC3-I和Beclin1表达升高、ɑ-SMA和p62表达降低,且益肺散结方各剂量组呈剂量依赖性,表明益肺散结方可通过抑制PI3K/Akt/mTOR信号通路表达,提高肺组织细胞自噬活性,缓解肺纤维化进程。这与徐昌君等[10]研究结果一致,体现了益肺散结方治疗PF的优越性。
4 结论与启示
益肺散结方可通过抑制PI3K/Akt/mTOR信号通路表达,提高肺组织细胞自噬活性,缓解肺纤维化进程,这可能为其作用机制之一。益肺散结方还可能通过其他途径改善PF进程,本研究未设计通路抑制剂进行验证,有待后续深入研究。
