miR-218-5p通过靶向LIN28B调控COPD时气道上皮细胞凋亡和炎症反应*
2021-01-28任敏李琳梁向清
任敏 李琳 梁向清
(绵阳市中心医院呼吸与危重症医学科,四川 绵阳 621000)
慢性阻塞性肺疾病(COPD,简称慢阻肺)是一种以持续呼吸症状、气道和(或)肺泡异常所致的进行性气流受限为特征的常见疾病,通常由于肺部对有害颗粒和气体的异常炎症反应引起[1-2]。慢阻肺可增加罹患心血管疾病风险,已成为导致全球人类死亡的第四大原因[3-4]。目前,β2激动剂和长效抗胆碱能药物对慢阻肺具有一定治疗作用,但其效果并不理想。因此,探索慢阻肺发展的分子机制、寻找有效的治疗策略是临床亟待解决的重大课题。微小RNA(miRNA)是一种进化较保守的内源性非编码RNA,其通过调控靶基因表达在多种人类疾病中发挥重要作用。大量研究证实,miRNA表达失调与慢阻肺发生发展密不可分[5-6]。Conickx G等[7]证实miR-218-5p在慢阻肺患者支气管上皮细胞中表达降低,其表达水平与气道阻塞密切相关,高表达miR-218-5p对香烟烟雾所致炎症和慢阻肺具有保护作用。然而miR-218-5p的直接靶点及其在慢阻肺中的作用机制仍有待进一步研究。生物信息学分析预测miR-218-5p可直接与lin28b的3′非翻译区(Untranslated Regions,UTR)结合,该基因常在包括肺癌在内的多种癌症中过度表达,并与肿瘤的发生有关[8-9]。因此,本研究探讨miR-218-5p在香烟烟雾提取物(Cigarette smoke extract,CSE)诱导的气道上皮细胞凋亡和炎症反应的作用和分子机制,以期为慢阻肺的靶向分子治疗提供新的思路。
1 材料与方法
1.1 实验材料 人肺支气管上皮细胞BEAS-2B购于南京科佰生物公司;RPMI-1640培养液、胎牛血清购于美国Gibco公司;Lipofectamine 2000、TRIzol试剂、逆转录酶购于美国Life Technologies公司;芙蓉王香烟(烤烟型10 mg)购于湖南中烟工业有限责任公司;人白细胞介素6(IL-6)、转化生长因子-β1(TGF-β1)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购于上海晶抗生物工程有限公司;miR-218-5p模拟物(miR-218-5p mimics)及其阴性对照(miR-NC)、LIN28B小干扰RNA(si-LIN28B)及其阴性对照(si-NC)、LIN28B过表达质粒(pcDNA-LIN28B)及其阴性对照(pcDNA-NC)、实验引物由南京金斯瑞生物科技有限公司提供;放射免疫沉淀测定(RIPA)缓冲液、聚偏氟乙烯膜购于上海碧云天生物技术研究所;兔源LIN28B、裂解的半胱氨酸天冬氨酸蛋白酶(Cleaved-caspase-3)、β连环蛋白(β-actin)单抗以及山羊抗兔二抗购于美国Abcam公司。
1.2 香烟烟雾提取物(CSE)制备 采用30 mL的RPMI-1640培养液对10根卷烟进行冒烟实验。将得到的悬浮液经过滤灭菌,并确定为100%的CSE溶液。利用RPMI-1640培养液将CSE溶液稀释至2.5%,-80℃保存备用。
1.3 实验分组和处理 BEAS-2B细胞复苏后加入含10%胎牛血清的RPMI-1640培养液,制成细胞悬液后,置于37 ℃、含5% CO2、湿润的培养箱中贴壁培养,每隔2~3 d换培养液1次,当细胞生长达到80%~90%融合时进行实验干预。将BEAS-2B细胞分为正常对照组(NC组即正常培养的细胞)、CSE组(采用2.5% CSE溶液处理BEAS-2B细胞)、miR-NC+CSE组(转染miR-NC)、miR-218-5p+CSE组(转染miR-218-5p mimics)、si-NC+CSE组(转染si-NC)、si-LIN28B+CSE组(转染si-LIN28B)、miR-218-5p+pcDNA-NC+CSE组(转染miR-218-5p mimics+pcDNA-NC)和miR-218-5p+pcDNA-LIN28B+CSE组(转染miR-218-5p mimics+pcDNA-LIN28B),进行2.5%CSE溶液干预处理。细胞转染参照Lipofectamine 2000说明书进行。
1.4 RNA提取和实时荧光定量PCR(RT-qPCR) 采用TRIzol试剂从各组BEAS-2B细胞中提取总RNA,用逆转录酶将其转化为cDNA,在ABI StepOnePlus实时PCR系统上进行RT-qPCR。分别以U6和β-actin为内源性对照,2-ΔΔCT法计算miR-218-5p和LIN28B的相对表达水平。miR-218-5p上游引物:5′-CGAGTGCATTTGTGCTTGATCTA-3′,下游引物:5′-TAATGGTCGAACGCCTAACGTC-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′;下游引物:5′-TGGTGTCGTGGAGTCG-3′。
1.5 Western blot检测LIN28B和Cleaved-caspase-3的表达 用RIPA缓冲液制备总蛋白样品,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,随后转移到聚偏氟乙烯膜上。用5%脱脂牛奶在室温下封闭1 h;用抗LIN28B抗体、抗Cleaved-caspase-3抗体4 ℃条件下孵育过夜;在室温下与相应的二抗孵育1 h;用增强型化学发光试剂盒进行显影;以目标蛋白和β-actin蛋白灰度值比值表示目标蛋白表达水平。
1.6 流式细胞术检测细胞凋亡 采用0.25%的胰酶消化后,室温下离心收集各组BEAS-2B细胞。预冷1×PBS洗涤细胞。加入300 μL的1×结合缓冲液悬浮细胞。加入5 μL的Annexin V-FITC混匀后,避光室温孵育15 min;加入5 μL的PI染色5 min,补加200 μL的1×结合缓冲液,混匀后上机检测。
1.7 ELISA法检测IL-6和TGF-β1表达水平 BEAS-2B细胞按照上述分组进行处理后,收集细胞培养液,按照ELISA试剂盒说明书检测IL-6和TGF-β1的表达水平。
1.8 双荧光素酶报告实验 含有miR-218-5p相关结合位点的野生型荧光素酶报告质粒(WT-LIN28B)、含有miR-218-5p相关结合位点突变序列的突变型荧光素酶报告质粒(MUT-LIN28B)构建由上海吉玛制药有限公司提供。将MUT-LIN28B或WT-LIN28B分别与miR-218-5p mimics或miR-NC分别共转染BEAS-2B,采用双荧光素酶报告系统检测荧光素酶活性。
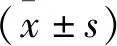
2 结果
2.1 CSE对气道上皮细胞BEAS-2B中miR-218-5p和LIN28B表达的影响 与NC组比较,CSE组气道上皮细胞BEAS-2B中miR-218-5p(0.40±0.04 vs 1.00±0.10)的表达显著降低,LIN28B在mRNA(2.76±0.28 vs 1.01±0.10)和蛋白(0.86±0.09 vs 0.34±0.03)水平的表达显著升高(P<0.05),见图1、图2。
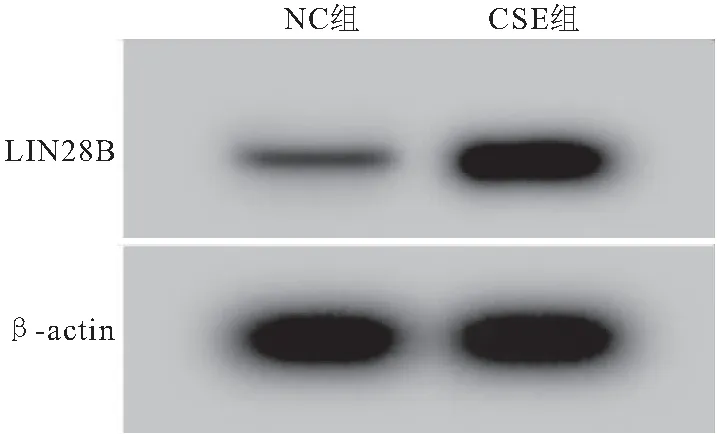
图1 Western blot检测LIN28B的蛋白表达量Figure 1 Western blot detects the expression of LIN28B protein

图2 RT-qPCR检测miR-218-5p和LIN28B mRNA表达水平Figure 2 RT-qPCR detects expression levels of miR-218-5p and LIN28B mRNA注:1.NC组;2.CSE组。miR-218-5p 140bp;LIN28B mRNA 180bp
2.2 过表达miR-218-5p对CSE诱导的气道上皮细胞BEAS-2B凋亡和炎症因子的影响 与NC组比较,CSE组BEAS-2B细胞凋亡率显著增加,Cleaved-caspase-3蛋白表达显著增加,IL-6和TGF-β1表达显著增加,miR-218-5p表达显著降低(P<0.05);与miR-NC+CSE组比较,miR-218-5p+CSE组BEAS-2B细胞miR-218-5p表达显著增加,细胞凋亡率显著降低,Cleaved-caspase-3蛋白表达显著降低,IL-6和TGF-β1表达显著降低(P<0.05),见表1、图3、图4。

图3 过表达miR-218-5p对CSE诱导的气道上皮细胞BEAS-2B凋亡和炎症因子的影响Figure 3 Effect of overexpressing miR-218-5p on CSE-induced apoptosis of airway epithelial cells BEAS-2B and inflammatory factors注:A.流式细胞仪检测细胞凋亡;B.Western Blot检测Cleaved-caspase-3蛋白的表达

图4 RT-qPCR检测miR-218-5p表达水平Figure 4 RT-qPCR detects the expression level of miR-218-5p注:1.NC组;2.CSE组;3.miR-NC+CSE组;4.miR-218-5p+CSE组

表1 过表达miR-218-5p对CSE诱导的气道上皮细胞BEAS-2B凋亡和炎症因子的影响Table 1 Effect of overexpressing miR-218-5p on CSE-induced apoptosis of airway epithelial cells BEAS-2B and inflammatory factors
2.3 低表达LIN28B对CSE诱导的气道上皮细胞BEAS-2B凋亡和炎症因子的影响 与si-NC+CSE组比较,si-LIN28B+CSE组BEAS-2B细胞LIN28B表达显著降低,细胞凋亡率显著降低,Cleaved-caspase-3蛋白表达显著降低,IL-6和TGF-β1表达显著降低(均P<0.05),见表2、图5。

表2 低表达LIN28B对CSE诱导的气道上皮细胞BEAS-2B凋亡和炎症因子的影响Table 2 Effect of low expression of LIN28B on CSE-induced apoptosis of airway epithelial cells BEAS-2B and inflammatory factors
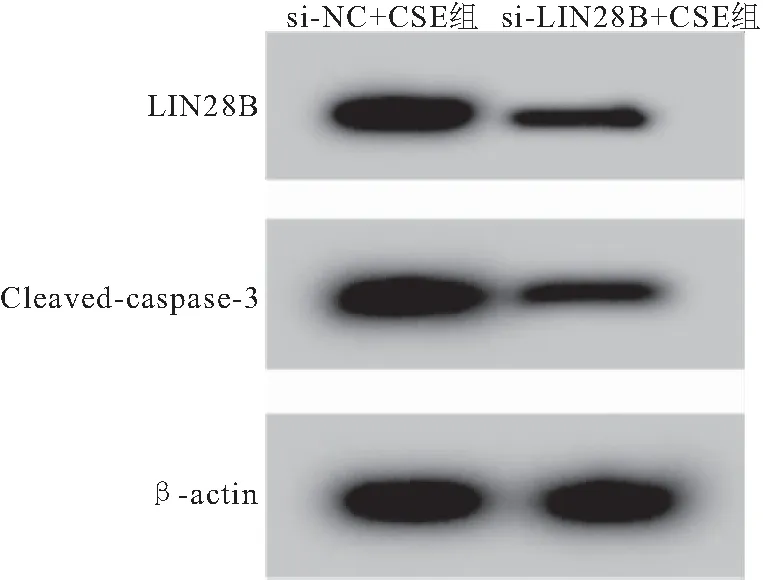
图5 Western Blot检测LIN28B、Cleaved-caspase-3表达Figure 5 Western Blot detects the expression of LIN28B,Cleaved-caspase-3
2.4 miR-218-5p靶向LIN28B starbase预测显示miR-218-5p与LIN28B之间存在部分连续互补结合位点(见图6A)。双荧光素酶报告基因实验显示,与miR-NC和WT-LIN28B共转染组比较,miR-218-5p mimics和WT-LIN28B共转染组BEAS-2B细胞的荧光素酶活性显著降低(P<0.05);与miR-NC和MUT-LIN28B共转染组比较,miR-218-5p mimics和MUTT-LIN28B共转染组BEAS-2B细胞的荧光素酶活性无显著变化(P>0.05)(见表3)。Western blot检测显示,与miR-NC比较,miR-218-5p BEAS-2B细胞LIN28B蛋白(0.18±0.02 vs 0.39±0.04)表达显著降低(P<0.05);与anti-miR-NC比较,anti-miR-218-5p BEAS-2B细胞LIN28B蛋白(0.68±0.07 vs 0.35±0.03)表达显著升高(P<0.05)(见图6B)。以上结果表明miR-218-5p靶向LIN28B并负调控其表达。

图6 miR-218-5p靶向调控LIN28B表达Figure 6 miR-218-5p targets to regulate LIN28B expression注:A.starbase对miR-218-5p和LIN28B结合进行预测示意图;B.Western Blot检测LIN28B蛋白表达量

表3 miR-NC或miR-218-5p与报告质粒共转染BEAS-2B细胞后双荧光素酶活性检测Table 3 Dual luciferase activity detection after co-transfection of BEAR-2B cells with miR-NC or miR-218-5p and reporter plasmid
2.5 高表达LIN28B可以逆转miR-218-5p对CSE诱导气道上皮细胞BEAS-2B凋亡和炎症因子的影响 与miR-218-5p+pcDNA-NC+CSE组比较,miR-218-5p+pcDNA-LIN28B+CSE组BEAS-2B细胞LIN28B蛋白表达显著增加,细胞凋亡率显著增加,Cleaved-caspase-3蛋白表达显著增加,IL-6和TGF-β1表达显著增加(均P<0.05),见表4、图7。

表4 高表达LIN28B可以逆转miR-218-5p对CSE诱导气道上皮细胞BEAS-2B凋亡和炎症因子的影响Table 4 High expression of LIN28B reverses the effect of miR-218-5p on CSE-induced apoptosis of airway epithelial cells BEAS-2B and inflammatory factors

图7 Western Blot检测LIN28B、Cleaved-caspase-3表达Figure 7 Western Blot detects the expression of LIN28B,Cleaned-caspase-3
3 讨论
目前,全球慢阻肺发病率呈上涨态势,尤其在发展中国家。有报道指出,我国40岁以上人群慢阻肺发病率高达13.7%,严重危害人民生命健康和生活质量[10]。因此,研究慢阻肺发展机制,优化治疗方案迫在眉睫。近年来,新的证据表明miRNA在慢阻肺中起着至关重要的作用[11-14]。Du等[15]研究显示miR-181c在慢阻肺患者肺组织中明显降低,高表达miR-181c表达可抑制中性粒细胞浸润、活性氧生成和炎性因子分泌,降低CSE诱导的炎症反应,而抑制miR-181c表达则产生相反作用。Gu等[16]报道miR-145-5p高表达可抑制慢阻肺患者气道重塑和炎症反应。本研究发现CSE诱导后BEAS-2B细胞中miR-218-5p表达显著降低,过表达miR-218-5p可减轻CSE诱导的BEAS-2B细胞凋亡。CSE干预后BEAS-2B细胞上清液中IL-6和TGF-β1水平升高,而过表达miR-218-5p可降低炎性因子IL-6和TGF-β1水平,与miR-218-5p对慢阻肺的保护作用一致[7,17]。此外,在纳米SiO2诱导的肺损伤中也发现miR-145-5p表达谱改变[18]。Cleaved-caspase-3是细胞凋亡发生的最终效应因子,CSE诱导后BEAS-2B细胞Cleaved-caspase-3表达显著增加,而过表达miR-218-5p可降低Cleaved-caspase-3表达水平,提示miR-218-5p可能通过调控Cleaved-caspase-3表达引起BEAS-2B细胞增殖和凋亡失衡进而参与慢阻肺进展。
Lin28b是一种进化高度保守的RNA结合蛋白,其与Lin28蛋白家族成员Lin28a具有相似的结构和功能。然而Lin28b主要存在于细胞核中,而Lin28a只存在于细胞质中。自从在肝癌中发现Lin28b过表达后,在结直肠癌、乳腺癌、肺癌等多种恶性肿瘤中发现Lin28b也存在过表达现象,且与神经母细胞瘤的诱导有关,通过let-7依赖性和非依赖性机制促进肿瘤进展[19-23]。此外,有研究报道通过下调Lin28b还可有效抑制肺部炎性损伤[24]。于是本研究推测Lin28b可能与慢阻肺相关。CSE诱导后BEAS-2B细胞中Lin28b的表达显著增加,与miR-218-5p表达趋势相反。抑制Lin28b可减轻CSE诱导的BEAS-2B细胞凋亡,并降低Cleaved-caspase-3、IL-6和TGF-β1水平。双荧光素酶报告基因实验证实miR-218-5p通过直接靶向Lin28b mRNA的3′-UTR来调控Lin28b的表达。miR-218-5p的下调促进Lin28b的表达,而miR-218-5p上调则抑制Lin28b表达。此外,恢复实验显示过表达Lin28b可逆转miR-218-5p过表达对CSE诱导的BEAS-2B细胞凋亡和炎性因子的影响。
4 结论
miR-218-5p通过靶向Lin28b可减轻CSE诱导的气道上皮细胞凋亡,降低炎性因子IL-6和TGF-β1的表达水平。因此,靶向miR-218-5p/Lin28b轴的调节有望为慢阻肺的治疗提供新的方向。
