LncRNA LINC00987通过靶向miR-375抑制肺癌细胞的增殖、侵袭和迁移
2021-01-28王剑文孙丹冯雁明
王剑文 孙丹 冯雁明
(1.武汉市金银潭医院呼吸结核科,湖北 武汉 430062;2.武汉市金银潭医院血管介入科,湖北 武汉 430062;3.中国人民解放军中部战区总医院,湖北 武汉 430070)
肺癌是世界上癌症死亡的首要原凶。肺癌的治疗主要根据癌症的亚型和分期来决定,近年来,针对癌症亚型的个性化靶向治疗也越来越多的应用于肺癌的治疗[1-3]。lncRNA(long non-coding RNA)可调控非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞的增殖、迁移、侵袭和凋亡,参与肿瘤的发生发展[4-5]。有研究表明,lncRNALINC00987在肺腺癌中明显低表达,与患者的总生存期降低有关[6-7],但其具体作用机制尚不清楚。本研究通过生物信息学预测,发现LINC00987与miR-375存在结合位点。miR-375在NSCLC细胞中高表达,其高表达可增强NSCLC细胞的侵袭、迁移能力[8]。LINC00987和miR-375在肺癌中是否存在调控关系还不清楚。本研究以肺癌细胞A549为主要研究对象,假设LINC00987通过靶向miR-375调控A549细胞增殖、侵袭和迁移,并对此假设进行验证,现将结果报告如下。
1 材料与方法
1.1 实验材料 人肺癌细胞株A549、HCC827、H1299细胞购自ATCC,正常肺泡上皮细胞HPAEPIC购自北纳生物;RPMI-1640培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,牛血清白蛋白(Bovine Serun Albumin,BSA)和胰蛋白酶购自美国Sigma-Aldrich公司;Cell Counting Kit-8(CCK-8)试剂盒购自上海碧云天生物技术有限公司;Transwell板购自美国Corning公司;引物、LINC00987过表达载体(pcDNA-LINC00987)、LINC00987小干扰RNA(si-LINC00987)、miR-375 mimics(miR-375)、miR-375 inhibitors(anti-miR-375)、阴性对照(pcDNA-control、si-control、miR-control和anti-miR-control)、LINC00987野生型(WT)和突变型(MUT)双荧光素酶报告系统载体购自上海吉玛制药有限公司;Lipofectamine 2000转染试剂、Total RNA提取试剂盒、real-time PCR 试剂盒、反转录试剂盒(RT-PCR)购自宝生物工程(大连)有限公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega公司;光学显微镜、全自动酶标仪、发光仪及Real-time PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 qRT-PCR检测LINC00987表达量 以正常肺泡上皮细胞HPAEPIC为对照,qRT-PCR检测肺癌细胞株A549、HCC827和H122P细胞中LINC00987表达量,选择表达量差异较大的A549细胞进行后续实验。
1.2.2 细胞培养 配制含10 % FBS、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640培养液,将人肺癌细胞株A549、HCC827、H1299和正常肺泡上皮细胞HPAEPIC均培养于RPMI-1640培养液中,在饱和湿度、37 ℃ 5% CO2培养箱中常规培养,消化传代。
1.2.3 细胞转染 将对数生长期的A549细胞稀释后以2×105个细胞/孔接种于6孔板中,培养至融合度达80%,根据Lipofectamine 2000试剂说明书进行转染。转染分组:pcDNA-control组、pcDNA-LINC00987组、LINC00987(WT)+miR-control组、LINC00987(WT)+miR-375组、LINC00987(MUT)+miR-control组、LINC00987(MUT)+miR-375组、si-control组、si-LINC00987组、miR-control组、miR-375组、anti-miR-375组、anti-miR-control组、pcDNA-LINC00987+miR-control组和pcDNA-LINC00987+miR-375组,转染48 h,收集细胞进行验证,验证无误进行后续实验。
1.2.4 Real-timePCR检测RNA的表达 收集肺癌细胞株A549、HCC827、H1299和正常肺泡上皮细胞HPAEPIC,使用Total RNA提取试剂盒提取细胞总RNA,然后按照反转录试剂盒说明书以RNA为模板反转录合成cDNA,以cDNA为模板,参照 real-time PCR试剂盒说明书进行反应合成miR-375和LINC00987,反应程序为:95 ℃ 1 min;94 ℃ 40 s、59 ℃ 40 s、72 ℃ 40 s,45个循环;72 ℃ 5 min。用2-ΔΔCt方法进行数据分析。
1.2.5 CCK8实验检测细胞增殖 收集转染后的A549细胞(pcDNA-LINC00987组和pcDNA-LINC00987+miR-375组及对照组),消化细胞并用培养液稀释,以2×103个细胞/孔(200 μL/孔)接种于96微孔板中,在细胞培养至24、48、72 h进行 CCK8实验,每孔加入10 μL CCK8溶液,然后37 ℃继续培养2 h,上酶标仪检测450 nm 处的吸光度(A)值。
1.2.6 Transwell实验测定细胞侵袭和迁移 迁移实验:将转染后的A549细胞培养至对数生长期,收集细胞,用无血清RPMI-1640培养基过夜饥饿培养,然后培养液稀释至1×106个细胞/mL,取100 μL稀释后的A549细胞加入Transwell上层小室,下层小室加入500 μL含10%FBS的RPMI-1640培养基作为迁移趋化物,培养24 h,取出后用棉签拭去上层小室未迁移的细胞,冰甲醛固定迁移细胞,结晶紫染色,拍照,显微镜计数,取10个视野,计算平均值。侵袭实验:将Matrigel置4 ℃冰箱过夜液化,用4 ℃无血清培养基1∶5比例稀释Matrigel,取100 μL加入Transwell上层小室,37 ℃ 3~5 h使其固态化,其余步骤同迁移实验。
1.2.7 双荧光素酶报告系统实验 根据1.2.3进行A549细胞培养和转染,将构建好的LINC00987野生型(WT)和突变型(MUT)双荧光素酶报告载体与miR-control或miR-375共转染A549细胞,转染后培养48 h,收集细胞,用RIPA裂解液重悬细胞,4 ℃裂解细胞过夜,离心收集上清,检测荧光素酶活性。以海肾荧光素酶活性为对照,分析萤火虫荧光素酶活性。
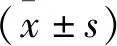
2 结果
2.1 LINC00987在肺癌细胞株中低表达 与正常肺泡上皮细胞HPAEPIC相比,在肺癌A549、HCC827和H1299细胞中LINC00987表达量均显著降低(P<0.05)(表1)。LINC00987在三种肺癌细胞株中表达情况一致,选择表达差异较大的A549细胞进行后续实验。

表1 qRT-PCR检测不同肺癌细胞株中LINC00987的表达Table 1 Expression levels of LINC00987 in different lung cancer cell lines were detected by qRT-PCR
2.2 过表达LINC00987抑制肺癌细胞A549的增殖、侵袭和迁移 与pcDNA-control组相比,pcDNA-LINC00987组A549细胞中LINC00987表达量显著升高(P<0.05),细胞OD值在24、48和72h均显著降低(P<0.05),侵袭细胞数和迁移细胞数均显著下降(P<0.05),说明过表达LINC00987可抑制A549细胞增殖、侵袭和迁移,见图1、表2。

图1 过表达LINC00987抑制A549细胞的侵袭和迁移Figure 1 Over-expression of LINC00987 inhibited the invasion and migration of A549 cells

表2 过表达LINC00987抑制A549细胞的增殖、侵袭和迁移Table 2 Effect of over-expression of LINC00987 on proliferation,invasion and migration of A549 cells cells
2.3 LINC00987靶向抑制miR-375的表达 通过LncBase网站预测到miR-375与LINC00987 可能存在结合位点(图2);双荧光素酶报告系统结果显示,与LINC00987(WT)+miR-control组相比,LINC00987(WT)+miR-375组荧光素酶活性显著下降(P<0.05),LINC00987(MUT)+miR-control组和LINC00987(MUT)+miR-375组荧光素酶活性无变化(P>0.05)(表3);与pcDNA-control组相比,pcDNA-LINC00987组A549细胞中miR-375表达显著下降(P<0.05);与si-control组相比,si-LINC00987组A549细胞中miR-375表达显著上升(P<0.05),见表4。

图2 LINC00987与miR-375的结合位点Figure 2 The binding site of LINC00987 to miR-375

表3 双荧光素酶活性检测A549细胞中LINC00987与miR-375的靶向关系Table 3 The targeting relationship between LINC00987 and miR-375 in A549 cells was validated by double luciferase activity

表4 qRT-PCR检测A549细胞中LINC00987的表达对miR-375表达的影响Table 4 The effect of LINC00987 expression on the expression of miR-375 in A549 cells was determined by qRT-PCR
2.4 miR-375对A549细胞的影响 与miR-control组相比,miR-375组A549细胞中miR-375表达量显著升高(P<0.05),细胞OD值在48、72h均显著升高(P<0.05),侵袭细胞数和迁移细胞数均显著增加(P<0.05);与anti-miR-control组比较,anti-miR-375组A549细胞中miR-375表达量显著减少(P<0.05),细胞OD值在48、72 h均显著降低(P<0.05),侵袭细胞数和迁移细胞数均显著下降(P<0.05)。说明过表达miR-375可促进A549细胞增殖、侵袭和迁移,敲减miR-375可抑制A549细胞增殖、侵袭和迁移,见表5。

表5 miR-375对A549细胞的增殖、侵袭和迁移的影响Table 5 Effect of miR-375 on proliferation,invasion and migration of A549 cells cells
2.5 miR-375阻断LINC00987对A549细胞的抑制 为确认LINC00987是否通过miR-375调控A549细胞的增殖、侵袭和迁移,在过表达LINC00987的同时过表达miR-375。结果发现,与pcDNA-LINC00987+miR-control组相比,pcDNA-LINC00987+miR-375组miR-375表达升高(P<0.05),细胞OD值、侵袭和迁移细胞数均显著升高(P<0.05)。说明过表达miR-375可阻断过表达LINC00987对A549细胞增殖、侵袭和迁移的抑制,见表6。

表6 过表达miR-375阻断过表达LINC00987对A549细胞的抑制作用Table 6 Over-expression of miR-375 blocked the inhibitory effects of LINC00987 over-expression on A549 cells
3 讨论
研究表明,多种lncRNA 和miRNA在肺癌中表达异常,通过多种机制调控癌细胞增殖和转移等过程,是肺癌的诊断、预后的潜在生物标志物,在靶向治疗中也有很大的价值[9-12]。Salavaty A等[6]研究表明,lncRNA LINC00987在肺腺癌中低表达,可能是抑瘤基因,其表达水平与肺腺癌患者的总生存期有关[7]。关于LINC00987的研究较少。有研究通过数据统计发现,在骨肉瘤样本中,LINC00987低表达的患者生存率显著提高,其在高危组样本中水平显著升高[13]。有研究构建了慢性阻塞性肺病(COPD)差异表达的miRNA-mRNA-lncRNA网络,通过qRT-PCR对其进行验证,发现与正常对照组相比,LINC00987在非吸烟COPD患者中表达下调,可能与miR-122-5p、A2M-as1和linc00612一起通过调控A2M(α2-巨球蛋白)参与COPD[14]。本研究结果表明,与对照相比,LINC00987在肺癌A549、HCC827和H1299细胞中表达均显著下调,与Salavaty A等[6]研究结论一致,过表达LINC00987可抑制A549细胞增殖、侵袭和迁移,说明LINC00987在肺癌的发展中起重要作用。
本研究通过LncBase网站预测发现,LINC00987和miR-375存在结合位点,因此假设LINC00987靶向miR-375调控肺癌细胞的增殖、侵袭和迁移。miR-375最初发现于胰岛β细胞内,参与胰岛发育、稳定葡萄糖水平、粘膜免疫和肺表面活性物质分泌,也参与多种癌症发生[15-16]。miR-375在胃癌[17]、肝癌细胞[18]中表达明显下调,靶向YAP1-TEAD4-CTGF轴参与Hippo通路抑制胃癌,靶向ErbB2(受体酪氨酸蛋白激酶erbB-2)抑制人肝癌细胞生长和调控细胞凋亡。miR-375在前列腺肿瘤和患者血浆中表达上调,可能通过ZEB1-miR-375-YAP1调控回路抑制EMT和癌细胞的侵袭迁移[19]。在肺癌中,有研究发现miR-375在肺腺癌和小细胞肺癌中表达显著上调,在鳞状细胞癌中表达下调,在小细胞肺癌中靶向ITPKB促进小细胞肺癌的生长[20]。Chen W J等[21]研究也表明,miR-375在肺鳞癌组织中表达显著降低,具有抑癌作用。本研究中,miR-375可促进A549细胞增殖、侵袭和迁移,而敲减其表达具有相反的结果。通过双荧光素酶报告系统及同时过表达miR-375和LINC00987发现,LINC00987靶向miR-375并可抑制miR-375的表达;过表达miR-375可阻断过表达LINC00987对A549细胞增殖、侵袭和迁移的抑制作用,证实了两者在肺癌中存在调控关系,与上述研究结果共同证实miR-375在肺癌发展中的重要作用。
4 结论
本研究结果提示,在肺癌A549细胞中,lncRNA LINC00987通过靶向miR-375调控A549细胞增殖、侵袭和迁移,过表达LINC00987可抑制miR-375表达进而抑制肺癌生长和转移。LINC00987是肺癌的潜在分子靶点。
