长链非编码RNA DLX6-AS1通过靶基因miR-103a-3p调控宫颈癌SiHa细胞的分子机制
2021-01-28周倩郝硕月张海燕
周倩 郝硕月 张海燕
(辽阳市中心医院妇产科,辽宁 辽阳 111000)
宫颈癌是对女性健康威胁极大的一种恶性肿瘤,目前常采用的治疗方式是手术、放化疗等,一定程度改善了患者生存质量,但对于晚期和复发型患者的治疗仍不理想,随着分子生物学和基因组学的发展,靶向治疗研究取得了重大进展,可提高疗效、减少毒副作用[1-2]。长链非编码RNA(long non-coding RNA,lncRNA)可作为癌基因或抑癌基因影响肿瘤的发生发展,研究发现部分lncRNA可参与调控宫颈癌的增殖、迁移与凋亡,可作为宫颈癌诊断与预后的重要指标和潜在治疗靶点[3]。DLX6反义RNA1(DLX6 antisense RNA1,DLX6-AS1)是一种lncRNA,定位于7q21.3,lncRNA DLX6-AS1的上调通过靶向miR-577促进食管鳞状细胞癌的细胞生长和转移[4]。敲低lncRNA DLX6-AS1抑制非小细胞肺癌细胞增殖、迁移和侵袭,同时促进细胞凋亡[5]。上调lncRNA DLX6-AS1促进大肠癌细胞增殖、侵袭和迁移[6]。研究发现微小RNA(miRNA)广泛参与宫颈癌的发生、侵袭、转移和复发等过程中[7]。有研究报道miR-103a在宫颈癌细胞系中低表达,上调miR-103a表达可减弱宫颈癌细胞增殖能力,并抑制细胞迁移及侵袭能力[8]。miR-103a-3p显著抑制前列腺癌细胞的增殖、迁移和侵袭[9]。但lncRNA DLX6-AS1对宫颈癌细胞增殖、迁移、侵袭和凋亡的影响及其机制是否与miR-103a-3p有关还尚不清楚,本实验探讨DLX6-AS1对宫颈癌SiHa细胞增殖、迁移、侵袭和凋亡的影响及其是否通过调控miR-103a-3p的表达影响宫颈癌的进展。
1 材料与方法
1.1 试验材料 正常宫颈细胞Ect1/E6E7和宫颈癌细胞株HeLa、SiHa、C33a、Caski购自北京北纳创联公司。RPMI-1640培养基购自美国Sigma公司;荧光定量试剂盒购自美国Invitrogen公司;二辛可宁酸(BCA)试剂盒、四甲基偶氮唑盐(MTT)试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒购自上海碧云天生物技术有限公司;Transwell小室、Matrigel胶购于美国Bio-Rad公司;抗体均购自美国Abcam公司;双荧光素酶报告基因检测试剂盒购自翊圣生物公司。载体质粒均购自上海伯易生物科技有限公司。
1.2 方法
1.2.1 细胞培养 正常宫颈细胞Ect1/E6E7和宫颈癌细胞株HeLa、SiHa、C33a、Caski用含10 %胎牛血清的RPMI-1640培养基于37 ℃、5% CO2细胞恒温培养箱中培养,每天换液一次,待细胞融和至80%左右时,加入胰蛋白酶进行消化传代。
1.2.2 细胞处理与分组 Ect1/E6E7和宫颈癌细胞HeLa、C33a、Caski正常培养,培养48 h后收集细胞备用。取对数生长期细胞SiHa,将si-con、si-DLX6-AS1、pcDNA、pcDNA-DLX6-AS1、miR-con、miR-103a-3p分别转染至SiHa细胞中,分别记为si-con组、si-DLX6-AS1组、pcDNA组、pcDNA-DLX6-AS1组、miR-con组、miR-103a-3p组;以正常培养的细胞作为对照(NC)组;将si-DLX6-AS1质粒分别与anti-miR-con、anti-miR-103a-3p共转染至SiHa细胞中,分别记为si-DLX6-AS1+anti-miR-con组、si-DLX6-AS1+anti-miR-103a-3p组。具体转染步骤按照LipofectamineTM2000试剂盒进行操作。
1.2.3 实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR)检测miR-103a-3p和DLX6-AS1表达水平 提取总RNA,反转录成cDNA,按照荧光定量试剂盒说明进行PCR,具体操作方法参考文献[5],miR-103a-3p和DLX6-AS1分别以U6和GAPDH为内参,miR-103a-3p上游引物序列:5′-GCAGCAGC ATTGTACAGGG-3′,下游引物序列:5′-GTGCAGG GTCCGAGGT-3′;U6上游引物序列为:5′-GCCAGC ACCATGCTCTTCTA-3′,下游引物序列为:5′-GGT TCCACAGATGCTCAGGTC-3′;DLX6-AS1上游引物序列:5′-CCACCCACTGAGAGAAGAGG-3′,下游引物序列:5′-CCTCCAAGCAATTGTCCAGT-3′;GAPDH上游引物序列:5′-CAGGAGGCATTGCTG ATGAT-3′,下游引物序列:5′-GAAGGCTGGGGCT CATTT-3′。
1.2.4 蛋白质印迹(Western Blot)检测CyclinD1、Bcl-2、Bax、Cleaved caspase-3、MMP-2、MMP-9表达水平 细胞培养48 h后提取总蛋白,BCA试剂盒检测蛋白浓度。具体操作方法参考文献[5],蛋白相对表达水平=目的条带吸光度值/β-actin条带吸光度值。
1.2.5 MTT检测细胞活性 收集各组培养48 h的细胞,然后按照参考文献[8]中的方法检测,490 nm波长的吸光度(OD)值。细胞活性(%)=实验组OD值/空白对照组OD值×100%。实验重复3次,每次设3个复孔。
1.2.6 流式细胞术检测细胞凋亡 收集各组培养48 h的细胞,然后按照参考文献[5]中的方法检测细胞凋亡情况,每组设3个复孔,实验重复3次。
1.2.7 Transwell检测细胞迁移和侵袭 侵袭实验具体操作方法参考文献[8]。迁移实验除不用基质胶包被Transwell小室上室,其余与侵袭实验操作相同。
1.2.8 荧光素酶报告实验检测DLX6-AS1对miR-103a-3p的靶向调控 构建DLX6-AS1的3′UTR野生型和突变型荧光素酶表达载体WT-DLX6-AS1和MUT-DLX6-AS1,用LipofectamineTM2000将WT-DLX6-AS1和MUT-DLX6-AS1分别与miR-con和miR-103a-3p共转染至SiHa细胞中。按照说明书进行检测。实验结果以荧光素酶活性和Renilla活性的比值进行统计学分析,实验重复3次。
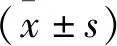
2 结果
2.1 宫颈癌细胞株中DLX6-AS1和miR-103a-3p的表达 与正常宫颈细胞Ect1/E6E7相比,宫颈癌细胞HeLa、SiHa、Caski、C33a中DLX6-AS1表达水平升高,miR-103a-3p表达水平降低(均P<0.05),见表1。

表1 宫颈癌细胞中DLX6-AS1和miR-103a-3p的表达Table 1 Expression of DLX6-AS1 and miR-103a-3p in cervical cancer cells
2.2 干扰DLX6-AS1表达对宫颈癌细胞SiHa增殖、凋亡、迁移和侵袭的影响 与si-con组相比,si-DLX6-AS1组SiHa细胞中DLX6-AS1表达水平降低,CyclinD1、Bcl-2、MMP-2和MMP-9表达水平降低,Bax、Cleaved caspase-3表达水平升高,细胞活性降低,细胞凋亡率升高,细胞迁移和侵袭数量降低(均P<0.05),见图1、表2、表3。

图1 干扰DLX6-AS1表达对宫颈癌细胞SiHa凋亡、迁移和侵袭的影响Figure 1 The effect of interfering with the expression of DLX6-AS1 on the apoptosis,migration and invasion of cervical cancer cell SiHa注:A.流式细胞术检测宫颈癌细胞SiHa凋亡率;B.Western blot检测CyclinD1、Bcl-2、Bax、Cleaved caspase-3、MMP-2和MMP-9的表达;C.Transwell检测宫颈癌细胞SiHa中迁移和侵袭

表2 干扰DLX6-AS1表达对宫颈癌细胞SiHa增殖和凋亡的影响Table 2 Effect of interfering with DLX6-AS1 expression on proliferation and apoptosis of cervical carcinoma cell SiHa

表3 干扰DLX6-AS1表达对宫颈癌细胞SiHa迁移和侵袭的影响Table 3 Effect of interfering with DLX6-AS1 expression on migration and invasion in cervical carcinoma cell SiHa
2.3 DLX6-AS1靶向调控miR-103a-3p的表达 Targetscan预测显示DLX6-AS1与miR-103a-3p存在结合位点(见图2A)。相较于miR-con组(1.00±0.13),miR-103a-3p组(0.65±0.08)转染WT-DLX6-AS1的SiHa细胞的荧光素酶活性显著降低(t=6.879,P<0.05);而转染MUT-DLX6-AS1的SiHa细胞miR-con组(1.23±0.12)与miR-103a-3p组(1.31±0.15)的荧光素酶活性差异无统计学意义(t=1.249,P=0.230)。RT-qPCR检测结果显示,相较于si-con组(1.00±0.08),si-DLX6-AS1组(3.68±0.28)miR-103a-3p表达水平显著升高(t=27.609,P<0.05);相较于pcDNA组(1.06±0.13),pcDNA-DLX6-AS1组(0.63±0.07)miR-103a-3p表达水平显著降低(t=8.737,P<0.05)。
2.4 转染miR-103a-3p对宫颈癌细胞SiHa的抑制作用 与miR-con组相比,miR-103a-3p组SiHa细胞中miR-103a-3p表达水平升高,MMP-2、MMP-9、CyclinD1、Bcl-2表达水平降低,Bax、Cleaved caspase-3表达水平升高,细胞活性降低,细胞凋亡率升高(P<0.05),见图2B、表4。

表4 转染miR-103a-3p抑制宫颈癌细胞SiHa增殖、迁移、侵袭和诱导凋亡Table 4 Transfection of miR-103a-3p inhibits proliferation,migration,invasion and induces apoptosis in cervical cancer cells SiHa
2.5 沉默DLX6-AS1表达和干扰miR-103a-3p表达对宫颈癌SiHa细胞生物学特性的影响 与si-DLX6-AS1+anti-miR-con组相比,si-DLX6-AS1+anti-miR-103a-3p组SiHa细胞中miR-103a-3p表达水平降低,MMP-2、MMP-9、CyclinD1、Bcl-2表达水平升高,Bax、Cleaved caspase-3表达水平降低,细胞活性升高,细胞凋亡率降低(均P<0.05),见图2C、表5。

图2 DLX6-AS1与miR-103a-3p靶向关系和转染miR-103a-3p或共转染si-DLX6-AS1与miR-103a-3p对细胞增殖迁移和凋亡蛋白表达的影响Figure 2 DLX6-AS1 and miR-103a-3p targeting relationship and the effects of transfection of miR-103a-3p or co-transfection of si-DLX6-AS1 and miR-103a-3p on cell proliferation,migration and expression of apoptosis proteins注:A.DLX6-AS1与miR-103a-3p存在的互补核苷酸序列;B、C.Western blot检测MMP-2、MMP-9、CyclinD1和Cleaved caspase-3的表达

表5 沉默DLX6-AS1表达和干扰miR-103a-3p表达对宫颈癌SiHa细胞增殖、迁移、侵袭和诱导凋亡的影响Table 5 Effect of silencing DLX6-AS1 expression and interfering with miR-103a-3p expression on proliferation,migration,invasion and induction of apoptosis in cervical cancer SiHa cells
3 讨论
宫颈癌是常见妇科恶性肿瘤,癌细胞的异常增殖、迁移和侵袭等影响癌症的进展,寻找研究影响宫颈癌细胞增殖、迁移和侵袭的相关lncRNA和miRNA,探讨其可能调控的分子机制,通过调控其表达从而影响调控癌细胞增殖、迁移和侵袭,可为癌症的治疗提供新的思路,且lncRNA和miRNA或可作为肿瘤分子靶向治疗的靶点和诊断及预后的生物标志物[10-13]。lncRNA DLX6-AS1通过靶向miR-613增强卵巢癌细胞的迁移和侵袭,在卵巢癌中发挥致癌基因的作用[14]。lncRNA DLX6-AS1在结直肠癌中也显著高表达,通过海绵状miR-577促进结直肠癌的增殖、迁移和侵袭[15]。lncRNA DLX6-AS1在胰腺癌组织中高表达,与较大的肿瘤大小,晚期TNM分期和淋巴结转移呈正相关,敲除DLX6-AS1通过上调miR-181b抑制癌细胞增殖、迁移和侵袭[16]。为研究lncRNA DLX6-AS1在宫颈癌中的作用,本实验首先检测了宫颈癌SiHa细胞中DLX6-AS1的表达,结果显示DLX6-AS1在宫颈癌SiHa细胞中也显著高表达,进一步干扰DLX6-AS1表达后发现,干扰DLX6-AS1表达降低了细胞活性,提高了细胞凋亡率,降低迁移、侵袭数量,降低了细胞周期素D1(CyclinD1)、B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)、基质金属蛋白酶2(Matrix metalloproteinase 2,MMP-2)、基质金属蛋白酶9(Matrix metalloproteinase 9,MMP-9)表达水平,提高了Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、裂解半胱氨酸天冬氨酸蛋白酶-3(cleaved cysteine-containing aspartate-specific proteases-3,Cleaved caspase-3)表达水平。
为研究DLX6-AS1是否通过调控miRNA影响宫颈癌SiHa细胞的生物学行为,本实验通过生物信息在线软件对DLX6-AS1靶向的miRNA进行预测,结果显示,DLX6-AS1与miR-103a-3p存在结合位点,又通过荧光素酶实验证实了DLX6-AS1可靶向调控miR-103a-3p。有研究报道miR-103a-3p过表达能够抑制肝癌细胞的增殖,引起细胞周期G0/G1期阻滞,促进其凋亡[17]。miR-103a-3p通过靶向抑制ATF7促进胃癌细胞的增殖[18]。而本实验结果显示,miR-103a-3p在宫颈癌SiHa细胞中低表达,miR-103a-3p过表达可降低SiHa细胞活性,提高细胞凋亡率,降低迁移、侵袭数量,降低CyclinD1、Bcl-2、MMP-2、MMP-9表达水平,提高Bax、Cleaved caspase-3表达水平。此外,研究还发现Linc00152通过调节miR-103a-3p/FEZF1/CDC25A途径促进神经胶质瘤干细胞的恶性进展[19]。circTCF25可通过miR-103a-3p/miR-107调控CDK6的表达促进膀胱癌的增殖和迁移[20]。说明lncRNA可通过靶向调控miR-103a-3p影响肿瘤的进展,本实验结果表明DLX6-AS1可靶向调控miR-103a-3p的表达,且抑制miR-103a-3p表达逆转了干扰DLX6-AS1表达对宫颈癌SiHa细胞增殖、迁移、侵袭的抑制和凋亡促进作用。
4 结论
干扰 DLX6-AS1表达可抑制宫颈癌SiHa细胞增殖、迁移、侵袭,促进细胞凋亡,其机制可能与miR-103a-3p表达有关,可能为宫颈癌的治疗提供新思路和新靶点。
