microRNA-22-3p低表达上调幼年哮喘气道重塑大鼠的NK1R表达*
2021-01-28宋建刚高永伟刘庆贾鲲鹏庞随军李元霞
宋建刚 高永伟 刘庆 贾鲲鹏 庞随军 李元霞
(延安大学附属医院儿科,陕西 延安 716000)
哮喘是一种慢性炎症性气道疾病,其特征在于可逆性气流阻塞和气道高反应性[1]。炎症细胞释放的炎症介质引起持续的气道慢性炎症,从而在哮喘过程中触发支气管收缩和气道结构变化[2],后者最初是作为响应炎症引起的气道壁损伤而启动的修复过程,然而,这种修复过程的失调导致气道重塑[3]。近年来我国小儿哮喘的患病率显著增加,为个人、家庭、社会均带来了巨大的负担[4-5]。因此,研究新的哮喘诊断和预后靶点以及开发新的治疗策略以逆转气道重塑至关重要。
MicroRNA(微小RNA,miRNA)是转录后基因表达调节剂的一大家族,其长度约为21个核苷酸,可控制真核生物中的许多细胞和发育过程[6]。新的研究表明,多种miRNA的表达水平与哮喘和气道炎症有关,包括miR-21、miR-223和miR-142-3p[7]。miR-22是多种细胞增殖和炎症反应的抑制因子。研究[8]表明,miR-22可以抑制RASF滑膜成纤维细胞增殖和促炎细胞因子的产生。大量研究发现,miR-22前提的3p臂成熟体miR-22-3p可抑制肝癌[9]、结肠癌[10]、胃癌细胞的增殖[11]。研究表明miR-22-3p能够调节乳腺癌细胞的增殖、侵袭和转移,该过程是通过负调节神经激肽受体1(neurokinin receptor 1,NK1R)发挥作用[12]。研究表明,感觉神经肽NK1R与小儿哮喘的发作及缓解关系极为密切[13],例如豚鼠哮喘模型急性期的支气管中NK1R的表达增多,而且在药物作用下可以抑制哮喘大鼠模型中的NK1R表达[14-15]。但其在哮喘气道重塑中是否受到miRNA调节仍不明确。因此,本研究探讨miR-22-3p在幼年哮喘大鼠气道重塑过程中是否靶向调节NK1R,为确定新的幼小儿哮喘预后和治疗靶标提供前期基础。
1 材料和方法
1.1 实验试剂 OVA购买于上海生工生物技术有限公司(货号:A003056-0100);氢氧化铝购买于北京Solarbio科学技术公司(货号:A7130);TRIzol试剂盒购买于美国的英杰公司(货号:15596018);大鼠气道平滑肌细胞(Rat airway smooth muscle cells,RASMCs)购买于美国培养物保藏中心(货号:#AC340472);TIANamp基因组DNA试剂盒购于北京天根生物技术公司(货号:DP348);荧光素酶报告基因测定试剂盒购买于美国普洛麦格公司(货号:E1310);NK1R,β-actin的抗体和第二抗体均购于美国Abcam公司(货号:ab183713,ab115777)。
1.2 动物分组 48只体重62 ~79 g的5周龄的无特定病原体(SPF)等级幼年雌性Wistar大鼠(延安大学医学院动物研究中心提供),饲养、饮水、光照和温度均保持在恒定水平,所有动物均在SPF条件下饲养。设施中的环境条件符合“实验动物对环境和住房设施的要求(GB14925-2001)”中有关实验动物隔离设施的相关准则。随机分为对照组、模型组、模型+mimic组、模型+mimic-NC组、模型+inhibitor组、模型+inhibitor-NC组,每组各8只。
1.3 动物模型构建和治疗 大鼠接受适应性喂养1周。适应后第1 d开始,给大鼠1 mL诱导剂(包含100 mg卵白蛋白和200 mg 氢氧化铝,腹腔注射)。15 d开始暴露。将大鼠置于一个特殊的密闭玻璃容器中(20 cm×20 cm×20 cm),将含有1%中的OVA的50 mL 生理盐水注入进行雾化激发,将大鼠每周3次暴露于这种治疗30 min,连续8周。对照组仅接受生理盐水注射。在暴露期后24 h内处死大鼠[16]。另外,模型+mimic组、模型+mimic-NC组、模型+inhibitor组、模型+inhibitor-NC组对大鼠的处理为大鼠每次激发前1 h内分别尾静脉注射1 mL的mimic、mimic-NC、inhibitor、inhibitor-NC,浓度均为(10 μg/mL)[17-18]。分离气管、支气管和肺组织,结扎后取出右中肺。将肺标本保存在4%多聚甲醛中,随后进行常规石蜡包埋,切片和苏木精-伊红(H&E)染色。在显微镜下评估气道病理。
1.4 病理图像分析 用显微镜对完整的肺横截面成像,并使用Leica Application Suite V4.3图像分析软件测量肺壁的内周(Pi)、面积(WA)和外周(Pe),支气管平滑肌面积(S)和支气管平滑肌细胞核数(N)。使用Pi和S对这三个测量值进行归一化,并表示为WA/Pi2、S/Pi2和N/S。
1.5 定量逆转录聚合酶链反应(RT-qPCR) 使用TRIzol一步法从RASMCs细胞和气道组织中提取总RNA。用少量液氮将组织研磨成均匀的粉末,随后加入Trizol试剂提取RNA。将焦碳酸二乙酯(DEPC)处理的超纯水加到混合物中以溶解RNA。使用ND-1000紫外可见分光光度计测量260 nm和280 nm的光密度(OD)。测定总RNA的质量,并相调节RNA浓度。采用两步法对提取的RNA进行反转录。使用以下反应条件:70 ℃ 10 min,冰浴2 min,42 ℃ 60 min和70 ℃10 min。将反转录的cDNA暂时置于-80 ℃。RT-qPCR使用TaqMan探针法进行。反应条件如下:在95 ℃下预变性30 s的一个循环,随后在95 ℃下进行40个循环的10 s变性,在60 ℃下退火10 s。并在70 ℃下延伸10 s。U6用于miR-22-3p的内参基因,β-actin用于NK1R基因的内参基因。使用相对定量方法,将每个靶基因的相对表达倍数表示为2-ΔΔCt。每个实验重复3次。
1.6 Western blot 从RASMCs细胞和气道组织中获得总蛋白样品,使用12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)将不同大小的蛋白分离开。将蛋白转移到硝酸纤维素膜上,在室温下使用含有5%牛血清白蛋白(BSA)的Tris缓冲盐水-Tween(TBS-T)封闭1 h。将膜与抗NK1R和β-actin的一抗进行孵育,过夜。然后将膜在TBS-T中冲洗(每次3次×10 min)。然后,膜与二抗进行孵育。6 h后,将膜用TBS-T洗涤(每次3次×15 min)。化学发光试剂A溶液和B溶液以1∶1的比例混合,最后将混合物均匀滴在膜上,使膜显影,并对所有免疫印迹带进行相对密度分析。
1.7 RASMCs培养 RASMCs在DMEM培养基中培养(37 ℃,5%CO2)。每2 d换液一次,细胞铺满培养皿时,用0.25%的胰蛋白酶消化并传代细胞。用含有10%FBS的DMEM代替培养基。
1.8 双荧光素酶基因报告实验 利用生物信息学预测网站microRNA.org预测miR-22-3p靶基因,并精确预测miRNA可识别得潜在靶位点。使用TIANamp基因组DNA试剂盒提取RASMCs的DNA。利用含有miR-22-3p结合位点的NK1R 3′UTR野生型序列(NK1R-3′-UTR-wt)和突变的NK1R的3′-UTR序列(NK1R-3′-UTR-mut)构建荧光素酶报告载体,并将其转染到RASMCs中。使用荧光素酶报告基因测定试剂盒检测荧光素酶活性。
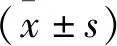
2 结果
2.1 模型组与对照组幼年大鼠气道壁结构的病理变化 每次OVA暴露后,模型组中的所有幼年大鼠均表现出烦躁、咳嗽、频繁抓挠、呼吸急促等症状。大鼠连续暴露几天后,模型组幼年大鼠的反应较对照组慢。老鼠皮毛的颜色变暗。在大鼠肺组织切片中,HE染色显示蓝黑色核和淡红色细胞质(见图1)。模型组表现出更多气道壁和气道平滑肌增厚和不均匀的细胞排列。对照组气道壁结构未见病理变化。模型组支气管壁厚度(WA/Pi2)、支气管壁平滑肌厚度(S/Pi2)及支气管壁中平滑肌细胞的数量(N/S)高于对照组,差异均有统计学意义(P<0.05),见表1。

表1 对照组与模型组WA/Pi2、S/Pi2、N/S比较Table 1 Comparison of WA/Pi2,S/Pi2,N/S between control group and model group
2.2 哮喘大鼠中miR-22-3p表达变化 与对照组比较,模型组的miR-22-3p的表达水平明显降低,差异具有统计学意义(P<0.01),见图2。
图2 对照组和模型组大鼠气道组织中miR-22-3p的表达水平Figure 2 The expression level of miR-22-3p in the airway tissues of control group and model group注:A.miR-22-3p的表达水平变化点状图;B.miR-22-3p的表达水平变化热图。与对照组相比,①P<0.01
2.3 NK1R是miR-22-3p的靶基因 NK1R mRNA 3′-UTR区域和miR-22-3p的序列具有结合位点(见图3A)。mimic对Mut-NK1R的荧光素酶活性的影响差异无统计学意义(P>0.05),mimic降低了wt-NK1R的荧光素酶活性强度,差异有统计学意义(P<0.01),见图3B。

图3 使用荧光素酶报告基因实验验证NK1R mRNA的3′UTR和miR-22-3p的直接结合关系Figure 3 The luciferase reporter gene experiment was used to verify the direct binding relationship between 3′UTR of NK1R mRNA and miR-22-3p注:A.NK1R mRNA的3′UTR和miR-22-3p预测的结合位点;B.荧光素酶报告基因实验观察荧光素酶活性变化。与对照组比较,①P<0.01
2.4 NK1R在幼年哮喘大鼠气道组织中的表达变化 通过RT-qPCR、Western blot分析每组大鼠气道组织中NK1R的表达变化。与对照组相比,模型组的NK1R的mRNA和蛋白表达水平明显上调,差异均有统计学意义(P<0.01,P<0.05),见图4A~D。

图4 对照组和模型组大鼠气道组织中NK1R的表达水平Figure 4 The expression level of NK1R in the airway tissue of control group and model group注:A.NK1R mRNA表达水平变化的点状图;B.NK1R mRNA表达水平变化的热图;C.NK1R的蛋白条带;D.NK1R蛋白表达水平变化的柱形图。与对照组相比,①P<0.01;与对照组相比,②P<0.05
2.5 miR-22-3p体内调节NK1R的蛋白表达水平 明确miR-22-3p对NK1R表达的调节作用,mimc下调模型组中NK1R的mRNA水平,各组差异均有统计学意义(P<0.05);inhibitor上调模型组中NK1RmRNA水平,各组差异均有统计学意义(P<0.05)(见图5A)。mimc下调模型组中NK1R的蛋白水平,各组差异均有统计学意义(P<0.05);inhibitor上调模型组中NK1R的蛋白水平,差异有统计学意义(P<0.05),见图5B、图5C。
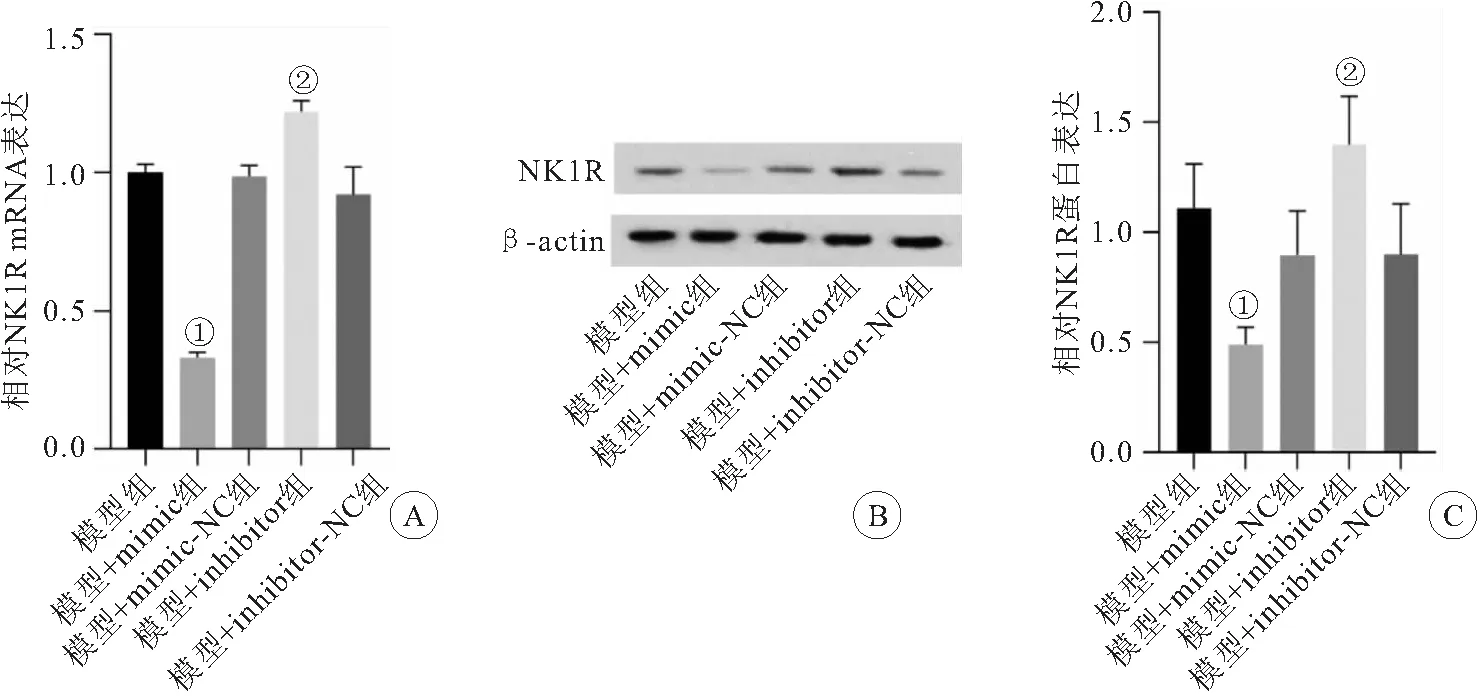
图5 体内验证miR-22-3p沉默对NK1R表达的调节作用Figure 5 In vivo verification of the regulatory effect of miR-22-3p silencing on NK1R expression注:A.NK1R mRNA表达水平变化的柱形图;B.NK1R的蛋白条带;C.NK1R蛋白表达水平变化的柱形图。与模型+mimic-NC组相比,①P<0.05;与模型+inhibitor-NC组相比,②P<0.05
3 讨论
小儿哮喘给家庭和社会造成了巨大精神和经济负担,因此需要深入探究小儿哮喘的发生机制[19]。最近研究表明,感觉神经肽例如SP、NKA、NKB及降钙素基因相关肽与肺部疾病和癌症有关[20-21]。因此,探索感觉神经肽在气道重塑中的分子调节机制对于研究潜在的小儿哮喘治疗靶点至关重要。
通过利用幼年大鼠实验性慢性哮喘,结果显示miR-22-3p的表达与哮喘之间可能具有关联。目前研究[7]表明,多种miRNA的表达水平与哮喘和气道炎症有关。包括miR-21、miR-223、miR-22-3p。研究[22]表明,miR-26a在ASMC肥大中起调节作用,这是气道重塑发展中的关键过程。此外miR-221抑制哮喘患者的ASMC过度增殖[23]。miR-22-3p在维持心肌肥厚和组织重构中扮演重要作用[24]。本研究中miR-22-3p的表达在幼年大鼠哮喘发生过程中降低,因此可能与哮喘的发展具有密切关系。miR-22-3p可调节多种细胞增殖,包括视网膜母细胞瘤细胞[25]、肺腺癌[26]、动脉平滑肌细胞[27]。但很少有研究调查miR-22-3p在幼年哮喘模型中的表达和下游调节靶点。
本研究中通过生物信息学预测出miR-22-3p和NK1R mRNA的3′-UTR区存在潜在的靶向调节位点。以往研究表明,NK1R表达于呼吸道中的不同部位,包括气道平滑肌、粘膜下腺、血管内皮、炎性细胞[15,28]。新的研究表明,在哮喘气道重建过程中,NK1R可通过增加微管蛋白的表达促进大鼠气道平滑肌细胞的迁移,表明NK1R可能是预防和控制哮喘气道重塑的新靶标[28]。本研究进一步探究miR-22-3p与神经肽NK1R表达之间的关系,结果表明在哮喘大鼠中,miR-22-3p和NK1R的表达趋势相反,而且表明miR-22-3p可直接抑制气道组织中神经肽NK1R的表达。首先在体外的荧光素酶报告基因研究结果表明,在RASMCs细胞中,miR-22-3p能直接与NK1R mRNA的3′-UTR结合,通过靶向抑制降低NK1R的蛋白表达。另外,在幼年哮喘大鼠体内实验中,我们通过注射mimics在气道组织中过表达miR-22-3p,结果发现NK1R的表达受到明显抑制,而通过inhibitor可以明显抑制miR-22-3p及可以明显上调NK1R的表达。一项研究同样表明,miR-22能够靶向抑制NK1R,并且因此负调节乳腺癌细胞的增殖、侵袭、迁移[12]。因此,在幼年哮喘大鼠的气道组织中miR-22-3p可以靶向抑制NK1R,从而可能通过调节平滑肌细胞和炎性细胞的增殖,以及平滑肌细胞迁移。
4 结论
本研究结果表明,在幼年哮喘大鼠的气道组织中,miR-22-3p可以靶向抑制NIK1R的表达,此调节机制在哮喘大鼠气道重塑过程中可能扮演重要作用。miR-22-3p以及NK1R在肺组织中的表达特征对哮喘的早期诊断有潜在的应用价值。但仍需扩大样本量深入研究,以确定miR-22-3p/NK1R信号发挥作用的具体机制。
