丙泊酚通过调控miR-574-5p/SOX2表达抑制胃癌AGS细胞增殖、侵袭和迁移
2021-01-28汪琪云尹利陈英
汪琪云 尹利 陈英
(重庆市江津区中心医院麻醉科,重庆 402260)
胃癌5年总生存率低于30%,是一个相当大的健康负担[1-2]。目前,外科手术仍然是临床治疗胃癌的重要手段,而围术期过程中所用到的麻醉药与术后肿瘤复发和转移存在着复杂关联[3]。丙泊酚是一种常用的静脉注射麻醉药,不仅具有诱导或维持全身麻醉的作用,还有着潜在的抗肿瘤作用[4-5]。有研究[6-7]指出,丙泊酚可通过抑制细胞增殖、侵袭和迁移抑制胃癌恶性进展,但具体的机制并不完全明确。越来越多的研究[8-9]显示,丙泊酚的抗肿瘤作用与其调控的微小RNA(microRNA,miRNAs)有着密切关系。miR-547-5p是miRNAs家族成员,被证实在胃癌组织中异常高表达,与肿瘤大小、分期和远处转移密切相关[10]。同时,有研究[11]指出,丙泊酚可通过下调神经元中miR-547-5p的表达发挥治疗作用。然而丙泊酚能否通过调控miR-547-5p表达影响胃癌细胞的生物学行为尚未可知。为此,本研究通过体外细胞实验探讨丙泊酚抑制胃癌细胞增殖、侵袭和迁移的分子机制。
1 材料与方法
1.1 主要试剂与仪器 人胃癌细胞株AGS(中科院上海细胞库);胎牛血清、洛斯维公园纪念研究所(Roswell Park Memorial Institute,RPMI)-1640培养基和胰蛋白酶(美国Gibco);青霉素、链霉素和引物(上海生工生物工程);LipofectamineTM2000和cDNA逆转录试剂盒(美国Invitrogen);性别决定区Y框蛋白2(Sex-determining region of Y chromosome-related high-mobility-group box 2,SOX2)抗体和β肌动蛋白(β-actin)抗体(美国Abcam);辣根过氧化酶标记的二抗(北京中杉金桥);miR-574-5p模拟物和阴性对照、SOX2小干扰RNA及其对照、SOX2过表达质粒及空载体质粒(广州锐博生物);细胞计数(Cell Counting Kit-8,CCK-8)试剂盒(北京索莱宝);双荧光素酶活性检测试剂盒(美国Promega);Trizol试剂、二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒、全功能多波长酶标仪和二氧化碳细胞培养箱(美国Thermo Fisher);实时荧光定量聚合酶链反应(Polymerase Chain Reaction,PCR)仪(美国ABI);Transwell小室(美国Corning);倒置显微镜和紫外可见分光光度计(上海谱元仪器);凝胶成像系统(美国Bio-Rad)。
1.2 方法
1.2.1 AGS细胞培养 采用含10 mg/mL链霉素、10 kU/mL青霉素和100 mL/L胎牛血清的RPMI-1640培养基在条件为温度37 ℃、湿度饱和、50 mL/L二氧化碳的细胞培养箱中常规AGS细胞。待细胞密度达80%左右时,加入2.5 g/L胰蛋白酶消化,并以1:2比例传代。实验所用细胞为生长良好的第3~5代对数生长期细胞。
1.2.2 AGS细胞转染 将对数生长期的AGS细胞按照每孔106个接种至6孔细胞板上,分别加入不同浓度(0、5、10、20 μg/mL)的丙泊酚处理48 h,依次记为0 μg/mL组、5 μg/mL组、10 μg/mL组、20 μg/mL组,按照下述实验步骤检测细胞存活率、克隆形成率、迁移和侵袭细胞数、miR-574-5p和SOX2表达水平,确定丙泊酚使用浓度。将AGS细胞接种6孔细胞板,待细胞汇合度达70%以上时,参照LipofectamineTM2000说明书步骤将miR-NC、miR-574-5p模拟物、si-con、si-SOX2、miR-574-5p模拟物+pcDNA、miR-574-5p模拟物和pcDNA-SOX2分别转染AGS细胞,转染48 h后给予20 μg/mL丙泊酚处理24 h,依次标记为丙泊酚+miR-NC组、丙泊酚+miR-574-5p组、丙泊酚+si-con组、丙泊酚+si-SOX2组、丙泊酚+miR-574-5p+pcDNA组和丙泊酚+miR-574-5p+pcDNA-SOX2组,同时设置对照组(未处理)、丙泊酚组(加入20 μg/mL丙泊酚处理48 h)。其中每组设置3个复孔。给药结束后,收集各组细胞,按照下述实验步骤检测miR-574-5p和SOX2蛋白表达、细胞存活率、克隆形成率、迁移和侵袭细胞数。
1.2.3 CCK-8法检测AGS细胞增殖 将各组AGS细胞以每孔1×104个接种至96孔板上后,置于细胞培养箱中常规培养。其中每个处理设置3个复孔。同时以无细胞的培养液作为空白调零组。每孔加入CCK-8溶液10 μL,孵育4 h后,上酶标仪检测细胞在490 nm波长处的吸光度值,并按照(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%公式计算各组细胞的存活率。实验重复3次。
1.2.4 平板克隆形成实验检测AGS细胞克隆形成能力 收集各组AGS细胞,吹打制成单细胞悬液;以含血清培养基进行梯度稀释,分别以50、100和200个细胞梯度接种至10 mL的培养皿中,置于细胞培养箱中培养14~21 d;待出现肉眼可见集落时,终止培养。弃培养液,以磷酸缓冲液洗涤细胞2次。以4%多聚甲醛固定20 min后,0.1%结晶紫染色15 min。洗去染色液,空气干燥后,采用显微镜观察各组细胞的克隆形成情况,其中以大于10个细胞的集落作为一个有效克隆,以克隆数与接种细胞数的百分比表示各组细胞的克隆形成率。实验重复3次。
1.2.5 Transwell小室检测AGS细胞侵袭与迁移 ①侵袭实验:在实验前,将基质胶按照1∶3比例以无血清培养基稀释后,取50 μL平铺于Transwell小室聚碳酸酯膜表面上,室温下充分融合。收集各组AGS细胞,制备浓度为105个/mL的细胞悬液。将基质胶包被后的Transwell小室放入24孔细胞板上,其中小室下室中加有600 μL含血清培养基,在小室上室内加入200 μL细胞悬液。放入细胞培养箱中常规培养24 h后,将小室小心取出,以棉签轻轻拭去未穿膜的细胞后,分别以4%多聚甲醛和0.1%结晶紫对细胞进行固定与染色。洗去染色液后,采用显微镜观察统计随机选取的3个视野内的穿膜细胞数目,结果取均值。实验重复3次。②迁移实验:实验步骤与侵袭实验基本相同,只是不需要对Transwell小室聚碳酸酯膜进行包被。
1.2.6 实时荧光定量PCR检测AGS细胞中miR-574-5p的表达 采用Trizol法提取AGS细胞总RNA后,采用紫外分光光度计检测RNA的浓度。将高质量的RNA参照cDNA逆转录试剂盒说明书合成cDNA后,以cDNA作为模板上PCR仪进行扩增。以U6为内参,采用2-△△Ct法计算AGS细胞中miR-574-5p的表达水平。实验重复3次。其中,PCR引物序列如下:miR-574-5p上游:5′-GGGGTGAGTGTGTGT GTG-3′,下游:5′-TGCGTGTCGTGGAGTC-3′;U6 上游:5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AA CGCTTCACGAATTTGCGT-3′。PCR反应参数:95 ℃预变性5 min;95 ℃变性10 s、60 ℃退火30 s、72 ℃延伸10 s,循环40次;72 ℃总延伸5 min。
1.2.7 免疫印迹法检测AGS细胞中SOX2蛋白的表达 采用放射免疫沉淀法提取AGS细胞总蛋白后,参照BCA检测试剂盒说明书检测总蛋白的浓度与纯度。将热变性后的蛋白样品按照每孔80 μg上样至10%十二烷基硫酸钠聚丙烯酰胺凝胶孔中行电泳分离。电泳结束后,电转至聚偏二氟乙烯上。5%脱脂奶粉封膜2 h后,加入按照1∶1 000比例稀释的SOX2和β-actin抗体室温孵育2 h;再以按照1∶2 000比例稀释的辣根过氧化酶标记的二抗室温孵育1.5 h。经化学发光剂显影曝光后,以β-actin为内参,采用凝胶成像系统扫描分析AGS细胞中SOX2蛋白的表达水平。实验重复3次。
1.2.8 双荧光素酶报告基因实验检测miR-574-5p与SOX2的靶向关系 采用TargetScan生物信息学软件预测到miR-574-5p与SOX2 3′非翻译区(Untranslated Region,UTR)存在互补的结合位点。将SOX2 3′UTR片段克隆扩增至荧光素酶载体上,构建SOX2野生型(SOX2-WT)载体;另外,将miR-574-5p与SOX2 3′UTR结合位点定点突变后克隆重组到荧光素酶载体上,作为SOX2突变型(SOX2-MUT)载体。将SOX2-WT、SOX2-MUT载体参照脂质体2000说明书步骤分别与miR-574-5p模拟物及其阴性对照(miR-NC)共转染至AGS细胞中。转染48 h后,参照荧光素酶活性检测试剂盒说明书检测AGS细胞的荧光酶活性。实验重复3次。
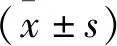
2 结果
2.1 丙泊酚抑制胃癌AGS细胞增殖、侵袭和迁移 与0 μg/mL组比较,5、10和20 μg/mL丙泊酚处理组细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数均明显降低(P<0.05),且呈浓度依赖性,见表1。

表1 各组细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数的比较Table 1 Comparison of cell survival rate,clone formation rate,invasive cell number and migrating cell number in each group
2.2 丙泊酚下调胃癌AGS细胞中miR-574-5p表达且上调SOX2蛋白表达 与0 μg/mL组比较,5、10和20 μg/mL丙泊酚处理组细胞中miR-574-5p表达水平呈浓度依赖性降低,而SOX2蛋白的表达水平呈浓度依赖性升高(P<0.05),见图1、表2。

图1 免疫印迹法检测各组细胞中SOX2蛋白表达Figure 1 Detection of Sox2 protein expression in cells of each group by Western blot

表2 各组细胞中miR-574-5p和SOX2蛋白表达水平的比较Table 2 Comparison of mir-574-5p and Sox2 protein expression levels in cells of each group
2.3 SOX2是miR-574-5p的潜在靶基因 miR-574-5p与SOX2 3′UTR存在互补的结合位点;miR-574-5p模拟物与SOX2-WT共转染后细胞的荧光素酶活性较相应对照miR-NC组明显降低(P<0.05);但miR-574-5p模拟物与SOX2-MUT共转染后细胞的荧光素酶活性与miR-NC组比较差异无统计学意义(P>0.05),见图2、表3。

图2 miR-574-5p和SOX2 3′UTR存在互补的结合位点Figure 2 Complementary binding sites of mir-574-5p and Sox2 3′UTR

表3 各组细胞荧光素酶活性的比较Table 3 Comparison of luciferase activity in each group
2.4 上调miR-574-5p表达或下调SOX2表达逆转丙泊酚对胃癌AGS细胞细胞增殖、迁移和侵袭的影响 与对照组比较,丙泊酚组AGS细胞中miR-574-5p的表达水平明显降低,而SOX2蛋白的表达水平明显升高,细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数均明显降低(均P<0.05);丙泊酚+miR-NC组AGS中miR-574-5p和SOX2蛋白表达水平、细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数与丙泊酚组比较差异均无统计学意义(均P>0.05);与丙泊酚组或丙泊酚+miR-NC组比较,丙泊酚+miR-574-5p组AGS细胞中miR-574-5p表达水平明显升高,SOX2蛋白的表达水平明显降低,细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数均明显升高(均P<0.05)。与丙泊酚+si-con组比较,丙泊酚+si-SOX2组AGS细胞中miR-574-5p表达水平明显升高,SOX2蛋白的表达水平明显降低,细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数均明显升高(均P<0.05),图3、表4。

表4 各组细胞中miR-574-5p和SOX2蛋白表达水平的比较Table 4 Comparison of mir-574-5p and Sox2 protein expression levels in cells of each group

图3 免疫印迹法检测各组细胞中SOX2蛋白的表达Figure 3 Detection of Sox2 protein expression in cells of each group by Western blot
2.5 上调SOX2表达逆转miR-574-5p对丙泊酚处理的胃癌AGS细胞增殖、侵袭和迁移的影响 与丙泊酚+ miR-574-5p+pcDNA组比较,丙泊酚+miR-574-5p+pcDNA-SOX2组AGS细胞SOX2蛋白表达、细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数均明显升高(均P<0.05),见图4、表5。

表5 各组细胞存活率、克隆形成率、侵袭细胞数和迁移细胞数的比较Table 5 Comparison of cell survival rate,clone formation rate,invasive cell number and migrating cell number in each group
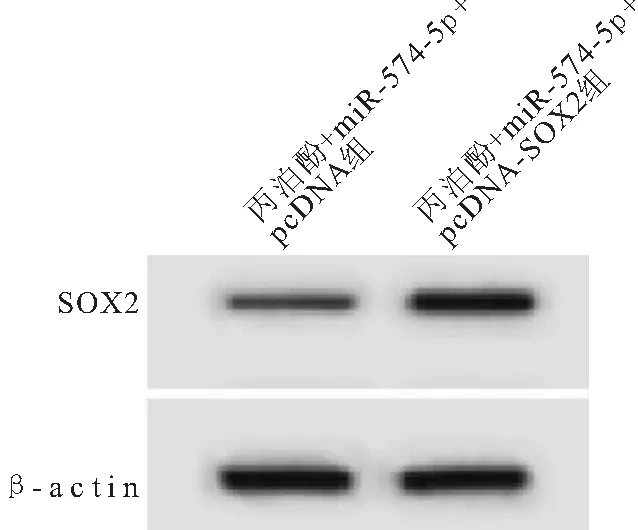
图4 免疫印迹法检测各组细胞中SOX2蛋白的表达Figure 4 Detection of Sox2 protein expression in cells of each group by Western blot
3 讨论
麻醉是手术过程中不可或缺的一部分,作为常用的静脉注射麻醉药,丙泊酚在肿瘤手术过程中的作用逐渐引起关注。异丙酚通过抑制解整合素样金属蛋白酶8(a disintegrin and metalloprotease domain 8,ADAM8)表达可抑制胰腺癌细胞增殖、迁移,且皮下注射异丙酚可抑制异种移植瘤形成[12]。丙泊酚通过调控miR-133a/性别决定区Y框蛋白4(sex-determining region Y-box 4,SOX4)的表达还可抑制结直肠癌HCT116细胞增殖并促进其凋亡[13]。在乳腺癌中,丙泊酚可通过下调miR-24表达诱导MDA-MB-435细胞凋亡[14];此外,丙泊酚还在改善乳腺癌改良根治术后复发方面起到了积极作用[15]。目前,已有研究[16]指出丙泊酚具有抑制胃癌细胞增殖、侵袭和迁移的作用,但具体的作用机制并不完全清楚。
miRNAs是一类内源性非编码微小RNA,长度在22个核苷酸左右,可通过在转录后水平调节靶基因的表达,影响细胞生物学功能,参与包括胃癌在内的多种肿瘤的发生发展[17-18]。miR-574-5p是miRNAs中的重要一员,在甲状腺乳头状癌和宫颈癌等肿瘤中异常高表达,且发挥着重要的促癌作用[19-20]。本研究除发现丙泊酚可抑制胃癌AGS细胞的存活、克隆形成、迁移和侵袭外,还发现丙泊酚可呈浓度依赖性下调AGS细胞中miR-574-5p的表达。这提示miR-574-5p可能在丙泊酚抗胃癌过程中扮演着重要角色。SOX2是性别决定区Y框蛋白基因家族成员,除了参与胚胎发育和性别决定外,其异常表达还与喉癌、大肠癌等肿瘤的发生发展密切相关[21-22]。有研究[23]指出,SOX2在胃癌组织中异常低表达,且在细胞增殖和转移过程中发挥着重要的抑制作用。本研究发现,丙泊酚作用后胃癌AGS细胞中SOX2蛋白的表达水平呈浓度依赖性升高。这提示,SOX2可能在丙泊酚抗胃癌过程中发挥着重要作用。本研究采用生物信息学软件预测到miR-574-5p与SOX2 3′UTR区域存在互补的结合位点;同时,双荧光素酶报告基因实验证实SOX2是miR-574-5p的潜在靶基因。上调miR-574-5p表达可明显逆转丙泊酚对AGS细胞SOX2蛋白表达的促进作用。此外,上调miR-574-5p表达或下调SOX2表达均可逆转丙泊酚对AGS细胞增殖、侵袭和迁移的抑制作用,且过表达SOX2还可逆转上调miR-574-5p表达对丙泊酚处理的AGS细胞增殖、侵袭和迁移的影响。这提示,丙泊酚可通过下调miR-574-5p表达进而引起其靶基因SOX2表达升高发挥抗胃癌的作用。
4 结论
本研究结果提示,丙泊酚可通过调控miR-574-5p/SOX2表达抑制胃癌AGS细胞增殖、侵袭和迁移,该结果有望为丙泊酚成为胃癌手术治疗中的理想麻醉药提供新的实验依据。
