棉花内生解淀粉芽孢杆菌489-2-2对棉花黄萎病的防效研究
2021-01-28ZabihullahSherzad唐灿明
Zabihullah Sherzad 杨 娜 张 静 张 芸 周 恒 唐灿明
(南京农业大学农学院,江苏 南京 210095)
黄萎病是危害棉花产量和品质的主要真菌病害,由土壤传播的大丽轮枝菌(Verticilliumdahliae)引起[1],该病菌能形成休眠的微菌核在土壤中存活多年,很难得到有效的防治[2]。抗性品种的选择是控制黄萎病最有效、最经济、最直接的方式,但在实际研究中缺乏高抗性陆地棉品种[3]。轮作的种植方式对防治黄萎病较为有效,但因劳动力需求大,在实际栽培中无法进行大规模推广,且在棉花中鲜有适合防治黄萎病的选择性杀菌剂[4]。目前生物防治已经成为重要的防治方法之一。内生细菌天然存在于植物体内,对环境友好[5]。因此,内生菌生物制剂的使用可能是控制大丽轮枝菌的有效途径之一[6]。棉花植株内部存在内生菌中,部分菌株对黄萎病菌具有抑菌活性,从中筛选逆境耐受性强、防效稳定的生防菌是控制棉花黄萎病的重要途径之一[7-8]。
前期在南京市六合区农业研究农场获取冀棉11根系,从中分离得到一株对大丽轮枝菌抗性明显的内生细菌菌株489-2-2。为鉴定棉花内生细菌489-2-2对棉花黄萎病的防效及研究该菌株抗性机理,本研究以489-2-2及冀棉11为研究对象,通过平板扩散法、分子鉴定、浸种法、灌根法及防御酶活性检测,旨在为该菌株的利用提供依据。
1 材料与方法
1.1 材料
大丽轮枝菌菌株Vd080由作物遗传与种质创新国家重点实验室提供,并保存在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上;489-2-2菌株(冀棉11根系中分离得到),棉花种子(品种:冀棉11)由作物遗传与种质创新国家重点实验室提供。
1.2 试验方法
1.2.1 489-2-2菌株体外抑制黄萎病菌Vd080的效应检测 参考Han等[9]的平板扩散法。用无菌打孔器在培养基对立侧等距离打两个孔,处理孔加入10 μL 489-2-2菌株在37℃培养箱中的过夜培养物,对照孔加入10μL无菌LB(Luria-Bertani)溶液,每处理设3次重复,平板置于28℃培养箱培养7 d。挑取抑菌圈边缘大丽轮枝菌Vd080菌丝,在BX53 Olympus显微镜(日本Olympus公司)下观察形态变化。培养皿上Vd080无489-2-2菌株互作区挑取菌丝作对照。鉴定489-2-2菌株发酵液的拮抗活性,将489-2-2菌株的发酵液涂布在PDA培养基上,在培养基中央放置直径0.6 cm的Vd080分生孢子菌块,加LB溶液作为对照,7 d后测量Vd080的菌落直径。
1.2.2 489-2-2菌株分子鉴定和生理功能分析 将489-2-2菌株置于37℃培养箱培养12 h,取2 mL菌液8 000 r·min-1离心2min,收集菌体,参考Long等[10]的方法提取该菌株基因组DNA。用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′和1492R(5′-GGTTAC CTTGTTACGACTT-3′)通过PCR扩增16S rDNA基因区域[11]。提取的DNA送北京华大基因技术有限公司进行测序。将序列与NCBI中的其他序列进行比较[12],使用ClastalX 2.0对多个序列进行比对,并使用MAGE 7.2软件构建系统发育树,确定菌株的分类地位。
1.2.3 体内定殖检测 将表面灭菌的棉花种子浸入用0.5%羧甲基纤维素溶液(carboxymethyl cellulose,CMC)重悬的489-2-2菌悬液(OD600=0.2)中3 h,再将种子浸入2.5%戊二醛溶液中固定,以仅浸泡在0.2%CMC中的种子作对照,播种在含有灭菌蛭石培养基的500 mL三角瓶中(所有操作均在无菌工作台进行)。25℃培养7 d后,收获棉花幼苗,保存在2.5%戊二醛溶液中,用透射电子显微镜观察棉花主根系3~4 cm处,确定489-2-2在棉花幼苗根系中的定殖[13]。1.2.4 489-2-2菌株对棉花黄萎病菌Vd080的防效测定 按照Han等[9]的方法制备细菌悬浮液。将489-2-2菌株接种到LB培养液中,170 r·min-1、37℃振荡培养12 h,然后10 000 r·min-1离心5 min,保留沉淀,并将沉淀重悬于0.5%CMC溶液中用作浸种处理剂(将沉淀重新悬浮在无菌蒸馏水中用作灌根处理剂)。
植株采用种子浸泡法和灌根法进行处理[14]。种子浸泡法:将灭菌的种子置于无菌蒸馏水浸泡12 h,再用0.5%CMC重悬的489-2-2菌悬液(OD600=0.2)浸泡3 h,将无菌蒸馏水浸泡的种子再浸入与重悬菌液相同体积的灭菌的0.5%CMC溶液中作为对照,将处理后的种子播种在装有无菌蛭石培养基的塑料杯中,在25℃、相对湿度80%、光照强度10 000 Lx的温室中培养两周后观察植株生长状况。灌根法:在塑料杯中播种棉花种子,25℃条件下培养14 d(光周期为14 h光照/10 h黑暗)后,在每株幼苗的根部(以无菌蒸馏水为对照)接种20 mL 489-2-2细菌悬浮液(OD600=0.2)。在棉花6片真叶期,用大丽轮枝菌Vd080孢子液接种浸泡法和灌根法处理的棉花植物。接种后10 d,按病害严重程度分级调查。
根据黄化、叶坏死或落叶的比例将病害分为四级,用0~4表示病害严重程度,其中0级为无症状,1级为轻度边缘黄化,2级为中度边缘黄化,3级为中度枯萎和可见坏死,4级为严重枯萎和落叶。病情指数(leaf wilt index,LWI)和生物防治效力计算公式如下:
1.2.5 棉花植株H2O2检测和胼胝质沉积测定 参照吴颖静等[16]的3,3-二氨基联苯胺(3,3-diaminobenzine,DAB)组织染色法,检测内生菌诱导棉花叶片细胞中H2O2的产生和积累。分别取Vd080分生孢子悬浮液(OD600=0.2)和489-2-2细菌悬浮液(OD600=0.2)与Vd080相互作用区的分生孢子发酵液(OD600=0.2)涂抹处理棉花叶片24 h,放入1mg·mL-1DAB染色液中染色8 h(25℃),加入无水乙醇脱色至无绿色,用蒸馏水重新悬浮后进行镜检。以无菌蒸馏水处理的叶片为对照。
取长势一致、有3~4片真叶的棉花幼苗,用灌根法分别接种Vd080孢子悬浮液(OD600=0.2)和489-2-2孢子悬液(OD600=0.2)与Vd080相互作用区的分生孢子发酵液10 mL,接种48 h后取真叶,参照陆燕等[17]的方法进行叶片胼胝质含量测定。在乙醇∶乙酸为3∶1的固定液中固定2~3 h,脱去叶绿素,然后取出叶片放入70%乙醇中脱水2 h,再于50%乙醇中复水2 h后,蒸馏水中过夜;用水漂洗叶片2~3次后,放在10%NaOH溶液中,37℃恒温处理1~2 h直至透明,然后用蒸馏水漂洗叶片3~4次,于0.01%苯胺蓝中黑暗培养3~4 h,待染色结束后,将叶片放在载玻片上,在荧光体视显微镜下用紫外激发光观察胼胝质的含量。对照组接种10 mL无菌水。
1.2.6 棉花植株防御酶的测定 采用灌根法对2周龄棉花幼苗进行处理,分别于处理0、24、72、96、168 h时采集根系样本,在液氮中研磨后保存于-70℃。
多酚氧化酶(polyphenol oxidase,PPO)活性的测定参考楚博等[18]的方法。取0.2 g液氮研磨均匀的根系样本,加入1 mL 0.05 mol·L-1磷酸缓冲液(pH值5.5),震荡混匀后于4℃、12 000 r·min-1条件下离心15 min,保留上清液;取0.5 mL上清液,加入1.0 mL 0.1mol·L-1邻苯二酚溶液和1.5mL 0.05mol·L-1磷酸缓冲液(pH值5.5),立即计时,于420 nm波长处每隔1 min测定其吸光度值,测定3次。以0.5 mL 0.05 mol·L-1pH值5.5的磷酸缓冲液为对照。按照公式计算PPO活性:
式中,W表示样品重量;Δt表示反应时间;Vt表示提取酶溶液的总体积;Vs表示光密度测量时取的酶液体积。
过氧化物酶(peroxidase,POD)活性的测定参照李安优等[19]的方法。取0.2 g液氮研磨均匀的根系样本,加入1mL 0.1mol·L-1磷酸缓冲液(pH值5.5),震荡混匀后于4℃、12 000 r·min-1条件下离心15 min,保留上清液;取0.1 mL上清液,加入2.9 mL 0.05 mol·L-1磷酸缓冲液、1 mL 0.05 mol·L-1愈创木酚和1 mL 2%H2O2,混合后立即在470 nm波长下测定其吸光度值,每隔1 min读数一次,共测3次。按照公式计算POD活性:
式中,Vt表示提取酶溶液的总体积;W表示样品重量;t表示反应时间;Vs表示测量时取的酶液体积。
苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL)活性的测定参照冯建雄等[20]的方法并略作修改。取1 g根系样本,加入5 mL 0.1 mol·L-1磷酸缓冲液[含1%聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)]和少量石英砂在含有液氮的研钵内充分研磨,研磨液于4℃、12 000 r·min-1条件下离心15 min,收集的上清液即为酶粗提液。取1 mL酶粗提液,加入1 mL 0.02 mol·L-1苯丙氨酸测定液和2 mL ddH2O,于30℃水浴30 min后立即加入0.1 mL 5 mol·L-1HCl终止反应。用infinite M2000酶标仪(瑞士TECAN公司)测量其在290 nm波长处的吸光度值。对照组以ddH2O代替0.02 mol·L-1苯丙氨酸。按照公式计算PAL活性:
式中,Vt表示酶液总体积;FW表示样品鲜重;Vs表示测定时取酶液的量;t表示反应时间。
1.3 数据分析
采用MicrosoftOffice Excel2007整理试验数据,应用IBM SPSSStatystic 22软件对试验数据进行分析。各试验均设3次重复。
2 结果与分析
2.1 489-2-2菌株发酵液对黄萎病菌Vd080的抑菌效应
平板扩散试验中,在489-2-2发酵液周围观察到明显的抑菌圈,而对照LB溶液周围无抑菌圈(图1-A)。用显微镜观察内生菌株附近的Vd080菌丝,菌丝表现出形态的变化,包括卷曲、膨大、变黑和肿胀等,细胞质浓缩,在肿胀的菌丝体中观察到隔膜(图1-C),而对照LB溶液周围的大丽轮枝菌Vd080菌丝形态正常(图1-B)。由于发酵液的作用,培养皿中心Vd080菌圈的平均直径为0.65 cm,几乎所有的分生孢子都未萌发(图1-D),而对照LB溶液培养皿中Vd080菌圈平均直径可达2.81 cm,大部分分生孢子萌发形成萌发管(图1-E)。以上结果表明,489-2-2菌株对大丽轮枝菌Vd080菌丝体的生长具有抑制作用。
2.2 489-2-2菌株主要特征特性
根据16S rDNA基因序列分析,分离的棉花内生菌489-2-2与芽孢杆菌属密切相关,与NCBI中的序列进行比对,与解淀粉芽孢杆菌的基因序列有97%相似。经鉴定,此内生菌呈棒状,为革兰氏阳性菌。根据构建系统发育树分析,该内生菌株为解淀粉芽孢杆菌489-2-2(图2)。对489-2-2菌种生理生化特性进行测定,发现其在不同的pH值、NaCl浓度和温度下活性不同,其中,pH值为5.0~8.0时促进其生长,pH值低于5.0抑制生长;该菌株能够在3.5%NaCl下生长,NaCl浓度高于3.5%时其生长受到抑制;20~40℃能促进其生长,低于20℃抑制期生长(表1)。此外,简单碳源生长试验、各种化合物的利用试验大部分表现为阳性,少数为阴性反应(表2)。

表1 489-2-2菌株的生理特性Table1 Physiological characterization of 489-2-2 strain
2.3 棉花根中489-2-2菌株的定殖
根据透射电镜结果,活细胞可以通过棉花根系进入植株,主要定殖在细胞间隙,特别是皮层组织(图3-A)、靠近根表皮部位(图3-B)。对照植株(种子仅浸泡在0.2%CMC中)和仅戊二醛固定细胞处理的植株(图3-C)的超薄切片未观察到内生菌的定殖,表明解淀粉芽孢杆菌489-2-2能穿透棉花根系,定殖于棉花根系内部。
2.4 489-2-2菌株在温室条件下的生物防治效果
由表3可知,用解淀粉芽孢杆菌489-2-2发酵液浸泡冀棉11种子,对照组病情指数(LWI)为62.03%,而种子浸泡法处理组中的LWI降低至27.92%;灌根法处理的棉花植株LWI为24.81%,对照组LWI为62.51%。用489-2-2发酵液浸泡棉花种子,其生物防效为54.99%;灌根法处理的棉花植株生防效果为60.31%。灌根法接种489-2-2能够明显提高植株对Vd080的抗性。上述结果表明,489-2-2菌株可显著减少棉花植株的黄化、坏死和落叶,对棉花黄萎病有明显防效。
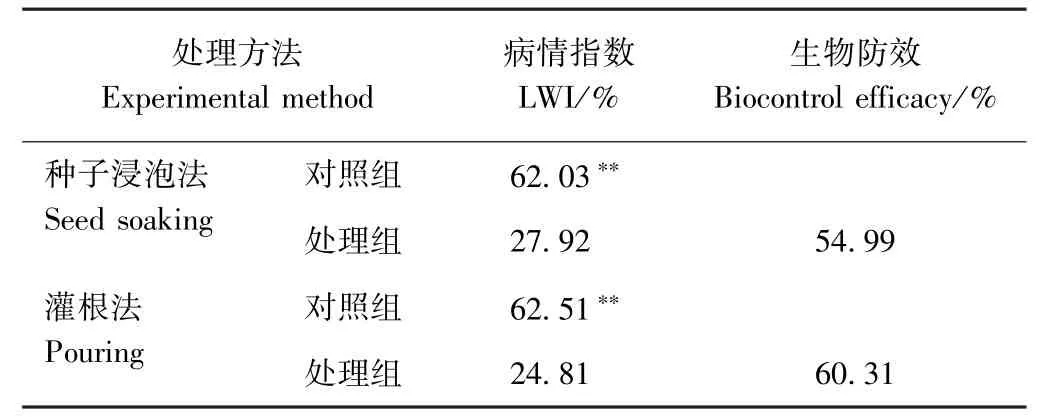
表3 489-2-2菌株在温室条件下的生物防治效果Table3 Biological control effect of 489-2-2 strain in greenhouse
用Vd080分生孢子液涂抹棉花叶片,能够使叶片产生斑点,且3 d后受损叶片斑点区域变黑,新的菌丝形成并进入叶片组织内,引起组织内部大量过氧化氢和胼胝质的沉积(图4-A)。489-2-2与Vd080相互作用区的分生孢子毒性较小,几乎不扩散繁殖,不能形成新的菌丝,过氧化氢浓度和胼胝质的沉积也不高(图4-B)。综上表明,489-2-2菌株能够降低Vd080的毒性,降低其致病力。
2.5 489-2-2菌株对棉花根系中防御酶活性的影响
由图5可知,经过489-2-2灌根处理的棉花根系中的PAL、PPO活性皆显著高于未经细菌处理的棉花根系,POD活性在48 h后高于未经细菌处理的棉花根系。灌根处理后,棉花根系PAL活性在0~24 h时逐渐升高并在24 h时达到峰值,显著高于对照,24~48 h逐渐降低,48~168 h呈升高、降低又升高的趋势,在96 h时诱导的PAL活性最低。灌根处理后,随着时间的延长,处理组棉花根系的POD活性呈先升高后降低的趋势,在接种489-2-2菌株后72 h时,处理组根系POD活性达到最大值;灌根处理后,处理组棉花根系的PPO活性整体呈升高趋势,且各时间点PPO活性均高于对照,在168 h时处理组根系PPO活性达到最大值。上述结果表明,用解淀粉芽孢杆菌489-2-2(OD600=0.2)对两周龄棉花植株进行灌根处理,能够引起植株防御酶的活化,72 h时能够诱导最强的防御酶活性,增强植株对黄萎病的系统防御反应。
3 讨论
李红信[21]研究发现,用蚀敌(山东胶南市绿洲生物有限公司生产)灌根和浸泡小麦种子对小麦全蚀病生物防治效果皆较为明显,灌根和浸种的生物防治效果分别为45.9%和43.5%。本研究结果表明,解淀粉芽孢杆菌489-2-2菌液浸泡棉花种子或用其发酵液灌根处理棉花植株均可提高棉花植株对黄萎病的抗性,这可能与该菌株诱导植株产生的免疫反应有关。防御酶活性的提高能够显著增强植物对病虫害的抗性[22]。Han等[9]研究发现,芽孢杆菌处理棉花植株能诱导防御酶活性升高,增强棉花抗黄萎病能力。本研究中,用解淀粉芽孢杆菌489-2-2菌液灌根处理棉花植株,能够促进棉花根系PAL、POD、PPO活性的升高,但诱导的酶活性趋势差异较大。PAL活性升高迅速,整个测定期出现两个峰值和两个谷值,可能是由于在24~48 h时POD、PPO活性开始升高,使PAL活性受到影响而下降。在48~96 h PAL、POD、PPO活性升高及降低趋势一致,说明489-2-2菌株诱导了棉花根系防御酶活性的提高,在48~96 h时诱导效果明显,能使棉花产生最大且稳定的免疫反应,提高了对大丽轮枝菌菌株Vd080的抗性。
内生菌进入植株体内,主要定殖于根茎表皮与细胞间隙[23-24]。本研究结果表明,解淀粉芽孢杆菌489-2-2能够在不伤根的情况下在棉花植株内主动定殖和转运,主要定殖在根系细胞间隙,特别是通气组织,靠近根表皮,这与范玉刚等[25]和李春宏[26]的研究结果相类似。当内生菌进入到植株体内后,细菌会产生相应的防御机制[27]。本研究中,当解淀粉芽孢杆菌489-2-2定殖到植株体内后,出现类似树脂状的物质包裹在细菌周围,这可能是489-2-2菌株对自身产生的一种保护机制。489-2-2菌株定殖到棉花根系及其他器官后,可能会阻止Vd080在植株内部的繁殖。解淀粉芽孢杆菌489-2-2与棉花的互作机制有待进一步研究。芽孢杆菌能够有效防治植物病害,环境友好,对人畜安全,并且不易引起病原菌的进化与变异[28]。因此,解淀粉芽孢杆菌489-2-2可以作为生防菌控制棉花黄萎病。
4 结论
本研究结果表明,解淀粉芽孢杆菌489-2-2对大丽轮枝菌Vd080具有较高的抑制作用,导致棉花黄萎病菌Vd080的菌丝体失去致病力,同时解淀粉芽孢杆菌489-2-2通过激活大量防御相关酶活性来增强植物的系统抗性,诱导棉花植株产生较长时间的免疫反应。此外,解淀粉芽孢杆菌489-2-2能够主动地定殖于棉花根系内,使用这种环保型拮抗细菌抵抗黄萎病,将在防治土传病害方面发挥重要作用。
