基于不同颜色山楂花MYB家族的挖掘与比较分析
2021-01-28李戌彦杨忠义杨明霞
李戌彦 杨忠义 纪 薇 杨明霞
(1山西农业大学园艺学院,山西 太谷 030801;2山西农业大学果树研究所,山西 太谷 030801;3农业部黄土高原作物基因资源与种质创制重点实验室,山西太原 030031;4果树种质创制和利用山西省重点实验室,山西太原 030031)
山楂(Crataegusspp.)属于蔷薇科山楂属落叶果树,其果实含有大量的有机酸、黄酮类、甾体、有机胺及低聚黄烷类物质,营养价值极高[1]。山楂主要分布于东亚、欧洲、北美洲等北温带地区[2],由于我国地形气候变化多样,山楂种质资源也较为丰富,现存的主要欧亚种山楂均与我国山楂有着直接或间接的联系。花色是植物花器官分类最重要的性状之一[3],也是植物花器官发育阶段界定的主要性状之一。山楂的花色主要为纯白色或红色,差异极明显[4]。经前期调查和研究,在开放白色花朵的山楂树上发现了芽变产生的粉红色花朵,该花在完全开放后颜色会转为粉色,通过转录组测序、基因注释、花青素含量测定等研究,发现一些基因的表达可能对花青苷的含量产生影响,其中包括一个MYB转录家族基因[5]。
MYB类转录因子,作为绿色植物中影响最大的转录因子家族之一,可以响应外界环境变化、调节细胞周期、影响物质代谢,参与多种生理生化过程,是目前基因家族研究的重点之一[6]。MYB类转录因子家族均含一个或多个保守度较高的MYB结构域,即MYB DNA-binding结构域,每个结构域包含1~3个串联且不重复的、由51~53个氨基酸组成的R基序[7]。在R基序中,每间隔18个氨基酸存在一个起疏水核心作用的色氨酸残基,每个R基序中含有3个色氨酸残基,其对维持螺旋-转角-螺旋结构具有重要意义[8],可以使得形成的高级结构特异性结合DNA大沟[9]。MYB转录因子蛋白参与多种生理生化反应。目前,MYB转录因子已在芒果[10]、白桦[11]、黑果枸杞[12]、青蒿[13]等植物中进行了克隆表达。杨捷等[14]研究发现Lhsor MYB12转录因子可能对花器官的分化具有调节作用。赵佳等[15]研究发现R2R3-MYB的表达影响了月季花青苷的合成;Shang等[16]研究发现MYB转录因子与bHLH转录因子的表达影响了金鱼草花色苷的含量,从而导致金鱼草脉序和花色的不同。陈哲等[6]发现菠萝中的MYB基因可能受到外界乙烯利的调控,并影响菠萝的生长发育。
植物中调控花青素生物合成的转录因子主要有MYB、bHLH和WD40基因家族成员[17]。本研究以前期获得的不同时期和颜色的山楂花转录组数据为基础,利用生物信息学手段,基于山楂转录组数据进行筛选、鉴定,从而对MYB转录因子进行深入挖掘,以期为研究山楂MYB转录因子对植物花青苷含量的影响及后期相关基因功能的研究奠定基础。
1 材料与方法
1.1 山楂转录组数据的获取
试验材料采自山西省太谷县山西农业科学院果树研究所(112.58°E,37.43°N,833 m±4 m),品种为大金星山楂。根据前期研究,选择花色苷含量具有显著差异的时期进行采样,常规大金星品种花朵开放初始阶段(BB-1)和花朵完全开放后(BB-2)均为白色;大金星芽变品种花朵开放初始阶段(BF-1)为白色,花朵完全开放后(BF-2)为粉色[5]。采集后的样品在液氮环境中运回实验室进行RNA提取,并送至北京百迈客生物科技有限公司进行转录组测序和组装。
1.2 山楂MYB蛋白序列的获取
从Pfam(http://pfam.xfam.org/)数据库中下载MYB保守结构域的隐马尔科夫模型文件PF00249,并利用Hmmer软件在转录组蛋白质数据中进行检索。利用本地BLAST软件(ncbi-blast-2.10.0+-win64)将检索结果构建成本地山楂转录组MYB蛋白二级数据库,并从Plant Transcription Factor Database(http://planttfdb.cbi.pku.edu.cn/)下载拟南芥168条MYB转录因子序列进行本地BLAST搜索,将BLAST结果建成山楂转录组MYB蛋白三级数据库。利用NCBI(https://www.ncbi.nlm.nih.gov/)网站的Conserved Domain Search功能依次对结构域种类及数量进行预测,排除假阳性。
1.3 山楂MYB蛋白理化信息分析及motif结构预测
利用ExPASy-ProtParam tool(https://web.expasy.org/protparam/)对山楂MYB蛋白序列的氨基酸数、理论等电点(protein isoelectric,pI)、分子量、亲水性、不稳定性进行预测。利用WoLF PSORT(https://wolfpsort.hgc.jp/)对MYB基因编码的蛋白进行亚细胞定位预测。利用MEME(http://meme.nbcr.net/meme/cgi-bin/meme.cgi)分别对筛选出的不同种类的山楂MYB蛋白序列进行motif结构预测。
1.4 山楂MYB蛋白序统进化树分析
利用MEGA X对筛选出的2R-MYB序列及125个已有研究基础的拟南芥2R-MYB序列进行多序列比对,并采用邻接法(neighbor-joining)进行系统进化树的构建。1R-MYB系统进化树仅利用筛选出的山楂1R-MYB进行构建。
1.5 山楂MYB转录家族基因表达量分析
根据转录组测序结果,将各个基因片段的表达量利用RPKM(reads per kilobasc per million mapped reads)法进行计算,得到表达量的RPKM值,利用R对不同品种、时期MYB蛋白序列的表达量绘制热图进行分析。
2 结果与分析
2.1 山楂MYB基因家族蛋白筛选结果
转录组测序后共得到34.28 Gb有效数据,经过计算、处理后共得到18 313条蛋白质序列。利用隐马尔科夫模型文件PF00249进行搜索,并将所得序列建立本地BLAST数据库,进一步利用拟南芥MYB蛋白序列作为查询文件进行本地BLAST,共得到80条序列。利用NCBI进行结构域预测后手动筛选,共得到73条山楂MYB家族蛋白序列,其中共含有MYB结构域113个。根据Dubos等[7]和Stracke等[18]的分类规则对其进行分类,最终获得35条1R-MYB蛋白、36条2R-MYB蛋白、2条3R-MYB蛋白(图1)。由于3RMYB蛋白数量较少,因此本试验主要研究1R-MYB蛋白和2R-MYB蛋白。
2.2 山楂MYB基因家族蛋白理化性质分析
由表1可知,1R-MYB蛋白序列平均长度为303.03个氨基酸,且主要分布在50~350个氨基酸之间,长度大于700个氨基酸的仅2个,最大为786个氨基酸(CpMYB61),最小为50个氨基酸(CpMYB53)。而2R-MYB蛋白序列平均长度为328.14个氨基酸,长度主要分布在188~388个氨基酸之间,长度小于200个氨基酸的仅有3条,最大为979个氨基酸(CpMYB36),最小为88个氨基酸(CpMYB12)。相较长度而言,山楂2R-MYB蛋白长度较1R-MYB蛋白长。相对分子质量的变化情况与氨基酸长度变化情况相似。山楂1R-MYB蛋白中有16个蛋白pI值大于7.5,15个蛋白pI值小于6.5,4个蛋白pI值介于6.5~7.5之间;而2R-MYB蛋白中有16个蛋白pI值大于7.5,16个蛋白p I值小于6.5,4个蛋白p I值介于6.5~7.5之间。2R-MYB蛋白中仅CpMYB21(不稳定性指数为38.91)不稳定性指数小于40,属于稳定蛋白,1R-MYB蛋白中只有CpMYB40(28.59)、CpMYB62(34.51)2个为稳定蛋白,其余蛋白均为不稳定蛋白。
根据亚细胞定位预测的结果,筛选出的所有2RMYB蛋白都分布于细胞核中,1R-MYB蛋白除CpMYB41、CpMYB55、CpMYB62、CpMYB70、CpMYB71主要分布于叶绿体中,CpMYB66主要分布在线粒体中,其余都分布在细胞核中(表1)。
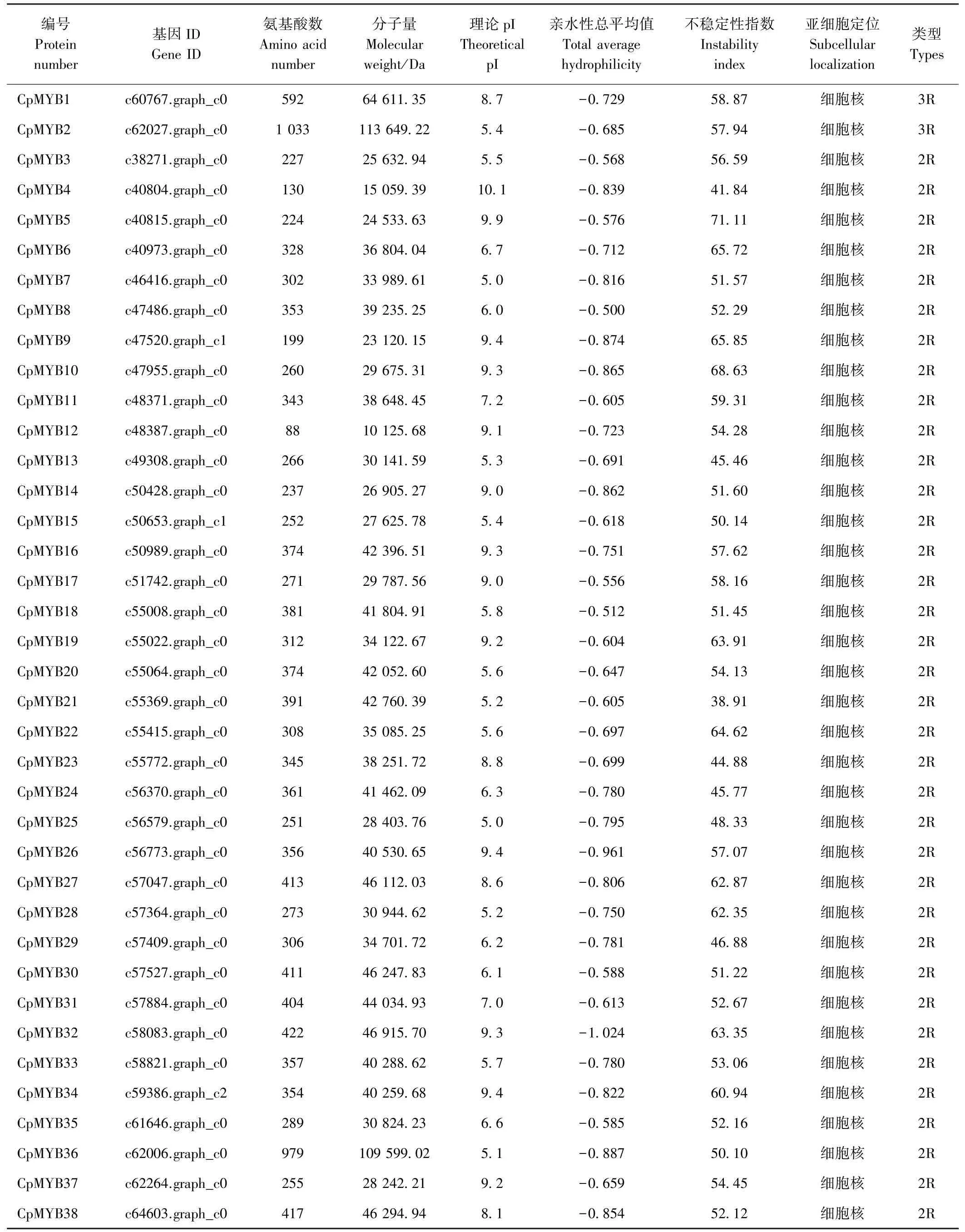
表1 山楂MYB蛋白理化性质及类型Table1 Physicochemical properties and types of MYB protein in haw thorn

表1(续)
3R-MYB蛋白仅筛选出2个,氨基酸数量分别为592(CpMYB1)和1 033(CpMYB2),3R-MYB蛋白数量较少,无法与1R-MYB、2R-MYB进行比较,1 033个氨基酸长度是本研究中最长的蛋白。3R-MYB蛋白不稳定性指数均大于40,为不稳定蛋白。
2.3 山楂MYB基因家族蛋白motif结构分析
图2分别为1R-MYB与2R-MYB的motif结构,且2R-MYB得到的序列长度相对较长。SMATR进一步分析表明,2R motif 4为AT hook结构,2R motif 1、2R motif 2、2R motif 3、2R motif 4、2R motif 5、1R motif 1、1R motif 2、1R motif 3均含有SANT结构,其中2R motif 5和1R motif 3同时具有MYB DNA-binding结构。
2.4 山楂MYB基因家族蛋白系统进化树分析
利用125个拟南芥2R-MYB转录因子蛋白与筛选的36个2R-MYB转录因子共同构建系统进化树(图3)。根据Dubos等[7]针对拟南芥2R-MYB转录因子家族的系统进化树分析结果对研究已相对明确的亚组进行编号,共找到23组,其中,共有19个山楂2RMYB转录因子匹配到了14个亚组中。同时,根据系统进化树,发现7个山楂2R-MYB转录因子系统进化关系较远,且具有一定的聚集性,根据距离远近,将其分为3个新的亚组,分别为NS1(CpMYB16、CpMYB34、AtMYB91)、NS2(CpMYB29、CpMYB32、CpMYB35、CpMYB36)和NS3(CpMYB5),其中NS1包含一个拟南芥MYB转录因子蛋白AtMYB91。
由图4可知,山楂1R-MYB转录因子可分为6个亚组,其中R1S5亚组包含的蛋白数量最少,仅有2条;R1S6亚组包含的转录因子数量最多,包含13条。
2.5 山楂MYB基因家族表达分析
根据山楂转录组数据分析(图5),发现CpMYB73只在BF-1中表达,其余转录因子在2种花完全开放前后均有表达。在白色花分组BB-1 vs BB-2中,有42个转录因子在BB-2时期的表达量高于BB-1时期,30个转录因子表达量低于BB-1时期。在花色芽变分组BF-1 vs BF-2中,共有34个转录因子在BF-2时期表达量高于BF-1时期,39个转录因子表达量低于BF-1时期。在山楂花完全开放前的分组BB-1 vs BF-1中,有36个转录因子在BF-1时期的表达量高于BB-1时期,37个转录因子表达量低于BB-1时期。在山楂花完全开放后的BB-2 vs BF-2中,有28个转录因子在BF-2时期的表达量高于BB-2时期,45个转录因子表达量低于BB-2时期。
将山楂转录组数据按不同分组进行差异表达分析,共找到16个具有表达差异的MYB转录因子(图6)。4个分组中,BB-1 vs BB-2中具有10个差异表达的转录因子,在4个分组中最多;BF-1 vs BF-2中只有4个具有差异表达的转录因子。仅CpMYB5在4个分组中都具有差异表达,且在BB-1 vs BB-2和BB-1 vs BF-1两组中均上调表达,在BF-1 vs BF-2和BB-2 vs BF-2两组中均下调表达。只在BB-2 vs BF-2中出现的差异表达基因数为3个,分别为CpMYB6、CpMYB41、CpMYB45,且 均 上 调 表 达。CpMYB42和CpMYB58只在BB-2 vs BF-2和BF-1 vs BF-2中出现,且这2个基因均在BF-2中上调表达。
3 讨论
研究表明,MYB转录因子可以调控植物花青苷的生物合成,影响植物花、果、叶等多种器官的颜色[19]。曹雨薇等[20]研究发现LhMYB12和LhMYB6基因可以调控百合花被片花青素苷的含量,从而使百合花被片呈现不同的颜色。Liu等[21]发现在光诱导基因的调节下,苹果MdMYB16和MdMYB308启动子活性被抑制,调节了苹果中的花色苷积累。本研究前期也发现,MYB家族的表达可以调控花青苷的积累[5],但未对MYB家族成员进行深度挖掘。本研究通过对转录组数据的深度挖掘,共发掘出73个MYB基因家族成员,其中35个1R-MYB,占比47.95%;36个2R-MYB,占比49.32%;2个3R-MYB,占比2.74%。其中1R-MYB占比明显高于前人对亚洲百合[22]、小兰屿蝴蝶兰[23]的研究结果,且在具有差异表达的MYB转录因子中也以1R-MYB为主,因此推测这些1R-MYB转录因子可能在花青苷的生物合成中具有一定的调控作用。
目前,拟南芥MYB转录因子功能的研究较为明晰。为了探究山楂2R-MYB转录因子的生物学功能,以拟南芥2R-MYB转录因子蛋白为参考进行研究,系统进化树分析发现,36个2R-MYB蛋白中仅有19个进入了拟南芥中已被确定功能的14个亚组。一些亚组的主要作用是利于植物响应外界生物与非生物胁迫,如CpMYB23所在的S1可以响应脱落酸信号调控,并激活细胞程序化死亡[24];CpMYB24、CpMYB30所在的S11可以应对昆虫咬伤,在伤后防止脱水[25];CpMYB22所在的S20可以调节细胞的电解质平衡;CpMYB19、CpMYB15所在的S22可在脱落酸的调节下影响气孔的关闭[26]。还有一些亚组主要用于调控细胞的生长和发育,如CpMYB37所在的S9和CpMYB17所属的S14,可以控制花瓣、花序以及种子的发育[27];CpMYB12所属的S4,CpMYB20、CpMYB27所属的S13,以及CpMYB26、CpMYB31、CpMYB38所在的S21,都具有调节木质素或纤维素生物合成的功能,影响植物细胞壁的发育[28-30]。还有诸如CpMYB13所属的S2、CpMYB3所属的S5以及CpMYB4所属的S7具有影响植物原花青素、多酚及类黄酮物质生物合成的功能,协助调控植物的次生代谢[31-33]。同时,本研究还发现了3个与其他亚组关系较远,且进化相对保守的新亚组。新亚组NS1中包含一个拟南芥MYB转录因子AtMYB91与两个山楂MYB转录因子,根据Liu等[34]的研究,AtMYB91对细胞中KNOX表达具有负调节作用,因此NS1亚组的功能可能与其相关。关于MYB转录因子的研究目前主要集中于2R-MYB转录因子上,对1R-MYB的研究相对较少。本研究发现山楂花朵内1R-MYB转录因子蛋白占所有MYB转录因子蛋白的比例较高,且在菠萝[6]、马缨杜鹃[35]等物种中也存在类似现象,因此将1R-MYB转录因子蛋白单独进行系统进化分析。本研究发现,35个山楂1RMYB转录因子蛋白可分为6个亚组,其中数量最少的亚组(R1S5)与数量最多的亚组(R1S6)可能具有相同的来源,但R1S6内进化程度更为复杂,因而推测R1S6内的MYB转录因子具有更丰富的生物功能。
本研究中,山楂转录组数据的差异表达分析表明,达到差异表达水平的转录因子共有16个,其中有1个3R-MYB转录因子,7个2R-MYB转录因子,8个1RMYB转录因子。CpMYB2和CpMYB4仅在BB-1 vs BB-2组中差异表达,BB-1与BB-2为白色花的不同时期,且均在第二时期上调表达,因而考虑其主要功能可能是调控白色花的表达或控制花的发育。进一步研究发现,CpMYB4属于2R-MYB转录因子,而与其系统进化关系较近的AtMYB11[36]、AtMYB12[37]均可以调控拟南芥类黄酮生物合成,影响黄酮醇积累的作用,因此推测CpMYB4转录因子具有相同的生物学功能,促进了白色花的表达。CpMYB6、CpMYB41、CpMYB45三个转录因子只单独出现在BB-2 vs BF-2组中,且上调表达,由于该分组为芽变品种花朵完全开放前后两个时期的对比,且在完全开放前后花朵颜色发生了变化,因此这三个转录因子极有可能在山楂花色表达过程中起到调控作用。通过前人研究,AtMYB26、AtMYB103在花药发育、细胞壁合成和分解、木质素生物合成等方面具有调控作用[38-39],而CpMYB6在系统进化关系上与其相近,因而推测CpMYB6与其具有类似的生物功能。研究发现,CpMYB56仅在BB-1 vs BF-1组中具有表达差异,该组为正常山楂和芽变山楂花朵开放初始阶段,虽然并无明显颜色变化,但其可能参与花朵颜色变化前期的生理过程,调控机制还需要进一步研究确认。本研究未发现单独在BF-1 vs BF-2组中差异表达的转录因子,但是发现了2个只在BB-2 vs BF-2组和BF-1 vs BF-2组的交集中差异表达的转录因子,分别是CpMYB42、CpMYB58,且均在BF-2中上调表达,因此CpMYB42和CpMYB58也极有可能调控山楂花色的形成。CpMYB29仅在BB-1 vs BB-2组和BF-1 vs BF-2组中差异表达,由于这两组均能体现山楂花开放的过程,因而猜测该转录因子可能与花的生长发育相关。CpMYB22、CpMYB48、CpMYB64均在BB-1 vs BB-2组中下调表达,在BB-2 vs BF-2组中上调表达,与CpMYB22系统进化关系交近的AtMYB2主要可以增强植物细胞的分裂与分化[40],因此推测CpMYB22可能也具有相同的生物学功能。CpMYB11、CpMYB12和CpMYB65均在BB-1 vs BB-2组与BB-1 vs BF-1组中下调表达,由于CpMYB12与AtMYB4系统进化关系较近,而AtMYB4可能参与抑制木质素合成,调控黄酮类化合物合成的功能[41],因而CpMYB12可能也具有相同的生物学功能,而CpMYB11的功能还有待进一步深入研究。
4 结论
本研究利用生物信息学方法深度挖掘了山楂转录组数据中的MYB基因家族成员,共筛选出73个MYB转录因子,其中35个为1R-MYB成员,36个为2RMYB成员,2个为3R-MYB成员。通过进一步分析,将筛选出的2R-MYB转录因子按照拟南芥已有的研究基础进行分类,其中有19个山楂2R-MYB蛋白被匹配到14个在拟南芥已具有一定研究基础的亚组中,同时还利用系统进化树分析的手段,将筛选出的1R-MYB转录因子分为了6个亚组。根据转录组数据进行差异表达分析,发现CpMYB4、CpMYB6、CpMYB12、CpMYB41、CpMYB42、CpMYB45、CpMYB56、CpMYB58等8个转录因子可能具有调控山楂花色的功能。本研究为进一步研究影响山楂花色的MYB转录因子提供了参考。
