酉州乌羊MC1R基因的克隆鉴定、生物信息学及多态性分析
2021-01-28任航行王高富董贤文
付 琳 任航行 王高富 周 鹏 张 丽 李 杰 董贤文 蒋 婧
(重庆市畜牧科学院/重庆市山羊工程技术研究中心,重庆 402460)
黑素皮质素1受体(melanocortin 1 receptor,MC1R)属于有7个跨膜功能域的G蛋白偶联受体超家族成员,在哺乳动物中由extension位点编码,其天然配体为促黑素激素(melanin stimulating hormone,MSH),当MCIR被a-MSH激活后,通过活化腺营酸环化酶,胞内的环腺苷酸 (cyclic adenosine monophosphate,cAMP)水平增加,导致酪氨酸酶的水平增加,最终导致真黑素的产生。Agouti蛋白是其拮抗剂,通过一系列的级联反应,Agouti信号蛋白(Agouti Sigroling protein,ASIP)完全阻断或是抑制a-MSH与MCIR的结合,最终产生伪黑素,导致相应表型的出现。近年来,MC1R基因的研究多集中于毛色和肤色方面,小鼠[1-2]、猪[3]、牛[4]、马[5-6]、羊[7]、骆驼[8]、鸡[9]、狐狸[10]等物种的毛色变异都与MC1R的多态性有关。有关在皮肤色素沉积的研究主要集中于人上。研究表明,MC1R是人类皮肤最具特征性的变异决定基因,也是与人类皮肤癌相关的低显性易感基因,MC1R基因的多态性与人的皮肤颜色、雀斑情况等还具有显著的相关性[11-14]。目前,关于山羊皮肤黑色素基因的研究较少,且主要集中在不同肤色山羊的皮肤组织形态学[15],黑色素生成相关的miRNA[16]、lncRNA[17]、mRNA[18]的筛选及鉴定方面。
酉州乌羊是我国珍贵的地方特色遗传资源,是一种全身具乌皮表型的哺乳动物。这种乌皮表型是一类罕见的纤维色素增生现象,此前仅在家禽中出现。酉州乌羊不但具有良好的食、药兼用性,还可以作为研究人类多种黑变病的自然突变模型。因此,酉州乌羊的乌皮表型是目前研究皮肤黑色素沉积的良好素材,亟需进行深入开发。本研究对酉州乌羊皮肤MC1R基因进行克隆、生物信息学及多态性分析,旨在初步揭示酉州乌羊MC1R的序列特征和蛋白结构,为后期酉州乌羊MC1R影响皮肤色素沉积的分子机制研究奠定基础。
1 材料与方法
1.1 试验材料
在重庆市酉阳县酉州乌羊国家级保种场,挑选8只成年酉州乌羊,采集其皮肤组织,液氮保存带回实验室后,-80℃冰箱保存。
1.2 MC1R基因克隆试验方法
使用宝生物工程(大连)有限公司的RNAiso Plus总RNA提取试剂(D9108A)提取组织样品的总RNA,利用NANODROP 2000超微量分光光度计(Thermo,美国)测定其浓度,凝胶结果中28 s和18 s条带的亮度和宽度比例为2∶1的RNA进行反转录,具体步骤参照cDNA Amplification Kit试剂盒(TaKaRa,大连)说明书操作步骤进行,将合成的cDNA置于-20℃保存备用。扩增目的基因的PCR体系为25μL,包括50μg·μL-1cDNA 2.5μL、10×Taq DNA polymerase buffer(Mg2+Plus)2.5 μL、2.5 mmol·L-1dNTPs mixed(TaKaRa,大连)2.0 μL、10μmol·L-1上下游引物各0.75μL、5 U·μL-1Ex Taq DNA polymerase(TaKaRa,大连)0.25μL,加水补足。以NCBI的山羊序列KT247426为参考,采用Prime 5.0软件设计引物,其中克隆引物序列为F:5′-CCTGAG AGCAAGCACCCTTTCC-3′;R:5′-GAGCGGGACTTCCCA CAGCT-3′。目的基因PCR反应程序:94℃预变性5 min;94℃变性30 s,65℃退火30 s,72℃延伸1min,35个循环;72℃延伸5min终止反应。目的产物经琼脂糖凝胶检测后,将扩增效果良好的特异性PCR产物原液送至上海生工生物技术公司测序。
1.3 多态性检测
1.3.1 试验材料 采集196只山羊血样,包括合川白山羊43只,巫溪白山羊19只,重庆市酉阳县本地白山羊66只、酉州乌羊68只,每只山羊静脉采血2 mL,-80℃冰箱保存。
1.3.2 基因组DNA的制备 采用TIANamp Genomic DNA Kit试剂盒[天根生化科技(北京)有限公司]从山羊全血中提取基因组DNA,利用核酸定量仪(NANODROP 2000,美国Thermo)和琼脂糖凝胶电泳方法对已提取DNA进行浓度检测,用TE缓冲液(Tris-EDTA bufler solution)稀释至50 ng·μL-1浓度,4℃冰箱保存。
1.3.3 引物设计及酶切反应 以NCBI上山羊MC1R基因组序列NC_022310为参考,采用Prime 5.0软件设计引物,酶切引物序列为F:5′-AGTGCCTGGAGGTG TCCATCC-3′;R:5′-CTGACGCTCACCAGCAGGT-3′。PCR扩增体系为25μL,包含2×Master Mix Taq酶12.5μL、上下游引物各0.4μL(10μmol·L-1)、DNA模板1.0μL(50 ng·μL-1),加入ddH2O补足。PCR反应程序:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸90 s,35个循环;72℃后延伸5 min,4℃终止反应。
MC1R基因酶切体系为10μL,包含Hpy188III限制性外切酶2μL、DNA扩增产物5μL、10×NEBuffer 1 μL,加入ddH2O补足至10μL。37℃水浴1 h。PCR产物先用1.0%琼脂糖凝胶电泳检测,将特异性的只有目的条带的产物进行酶切,酶切产物用5.0%琼脂糖凝胶电泳检测,记录带型与相应的个体。
1.4 生物信息学分析
克隆结果分析:以NCBI数据库中已发表的山羊序列为基础,用DNAStar软件包对酉州乌羊MC1R基因序列进行校正和编辑。运用开放阅读框(open reading frame,ORF)软件对本研究山羊序列的ORF进行查找,确定目的基因编码序列(coding sequence,CDS)的范围。在NCBI数据库中同源搜索,根据酉州乌羊MC1R基因与其他物种的CDS序列的一致性,确定所获序列是否为目的基因序列;利用Clustal X(1.83)进行序列比对,Mega 5.0进行变异位点输出、分析酉州乌羊与各物种MC1R的进化关系。酉州乌羊MC1R蛋白的理化性质分析采用ExPASy服务器软件(http://web.expasy.org/protparam/),保守结构域采用BLAST程序(http://www.ncbi.nlm.nih.gov)分析,疏水性分析和跨膜结构分析分别采用ExPASy服务器软件(http://web.expasy.org/protparam/)和TMHMM server v.2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0)。蛋白质功能位点采用ExPASy服务器软件(http://expasy.org/prosite/)进行分析。二级结构用在线软件 SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa)。三级结构利用同源建模预测(http://www.expasy.org/swissmod/SWISSMODEL.html)。
多态性检测结果分析:利用凝胶成像系统结合人工判读,进行基因分型。在此基础上,利用PopGen32软件(version 4.2)估算等位基因频率、等位基因数和期望杂合度。运用SPSS 18.0软件对数据进行χ2独立性检验,并进行关联分析。
2 结果与分析
2.1 目的基因的鉴定
扩增酉州乌羊的MC1R基因,得到长度为1 273 bp的特异性清晰条带(图1),其包含酉州乌羊MC1R基因954 bp的CDS序列,共编码317个氨基酸(图2),酉州乌羊MC1R基因编码区还存在唯一的异义替换c.676A>G,其编码的氨基酸在226位由赖氨酸转变为谷氨酸,氨基酸由碱性转变为酸性。
在NCBI数据库中对酉州乌羊的MC1R基因进行BLAST搜索比对,结果显示,酉州乌羊的MC1R基因与黑山羊(KT247426.1)、绵羊(NM_001282528.1)、藏羚羊(XM_005956360.1)、普通牛(KP182074.1)、瘤牛(XM_019979538.1)、牦牛(XM_005892429.1)、美洲野牛(XM_010843928.1)等物种MC1R基因的同源性分别高达99%、99%、98%、96%、96%、96%和96%,揭示该基因确为酉州乌羊MC1R基因。
2.2 物种间氨基酸序列比对
将酉州乌羊MC1R基因编码的氨基酸序列与GenBank数据库中序列进行比对,由图3可知,牛科物种MC1R氨基酸序列分为一枝,其与其他哺乳动物同源性较低,这一结果与动物进化规律较为一致。此外,酉州乌羊与其他物种MC1R氨基酸序列的第226位氨基酸上,酉州乌羊表现为谷氨酸,其他物种全部为赖氨酸,氨基酸由碱性转变为酸性,位于MC1R蛋白结构第3个细胞内环上。
2.3 MC1R蛋白质分析
对蛋白理化性质进行分析,结果显示,酉州乌羊MC1R蛋白质的分子式为C1603H2565N411O410S22,原子总数为5 011,蛋白分子质量为34 860.83,理论等电点为8.78。MC1R的氨基酸组成中,亮氨酸(Leu,L)数量最多,总数为55个,占17.4%;丙氨酸(Ala,A)数量其次,总数为31个,占9.8%;赖氨酸(Lys,K)和色氨酸(Trp,W)数量最少,各有4个,占1.3%。总的带负电残基(Asp+Glu)为13,总的带正电残基(Arg+Lys)为20。其消光系数在280 nm波长时为36 285,不稳定系数为38.03,说明该蛋白是稳定蛋白。MC1R的整个肽链中,共有241个亲水性氨基酸残基,68个疏水性氨基酸残基,且在第191位氨基酸处具有疏水最大值3.211,在第229位氨基酸处具有疏水最小值-2.589,总平均亲水性为0.894,是一个疏水蛋白,推断MC1R是一种不可溶性蛋白(图5)。TMHMM在线预测显示,MC1R有7个跨膜结构区域,其N端在细胞外伸展,C端在细胞内伸展,在两者之间有许多环结构,跨膜结构域的氨基酸组成分别是44-63AA、76-98AA、118-140AA、161-183AA、187-209AA、245-267AA、282-300AA(图6)。用NCBIConserved Domain Search预测酉州乌羊MC1R蛋白功能域,结果显示(图7):MC1R蛋白有3个保守结构域,7tm_4结构域由45-174AA组成,属于跨膜受体;7tm_1结构域由55-298AA组成,属于GCPRs受体,主要接受光刺激和G蛋白激活;PHA03087由130-314AA组成,属于临时的G蛋白受体。酉州乌羊第226位氨基酸的异义替换位于其7tm_1结构域上,可能影响MC1R G蛋白激活,进而影响皮肤黑色素的形成。
对酉州乌羊MC1R进行蛋白质功能位点预测显示,其有4个功能位点,分别是1个蛋白激酶C磷酸化位点,2个N端糖基化位点,3个酪蛋白激酶Ⅱ磷酸化位点,4个N端豆蔻酰化位点(表1)。酉州乌羊第226位氨基酸的异义替换位于其酪蛋白激酶Ⅱ磷酸化位点上,可能影响MC1R蛋白的磷酸化。
2.4 MC1R编码蛋白质二级结构分析
酉州乌羊MC1R蛋白质二级结构的预测结果见图8,其中构建α-螺旋的氨基酸为189AA(59.62%),构建延伸链的氨基酸为48AA(15.14%),构建β转角的氨基酸为61AA(19.24%),氨基酸序列大部分都用于构成α-螺旋。
2.5 MC1R编码蛋白质三级结构分析
用Swiss-model在线软件进行蛋白三级结构的预测,酉州乌羊MC1R第226位氨基酸显示为谷氨酸(E)的为突变型,显示为赖氨酸(K)的为野生型,构建出的突变型与野生型在其226位氨基酸的氢键构成上有较大差异,空间结构发生变化(图9)。
2.6 MC1R多态性分析
2.6.1MC1R酶切结果 以酶切引物扩增山羊MC1R基因片段,PCR片段长度为190 bp,经酶切反应后,酶切产物的琼脂糖凝胶电泳结果如图10所示。酶切反应共显示3种基因型,分别为AA型72 bp+118 bp,AG型190 bp+118 bp+72 bp,GG型190 bp。
2.6.2MC1R群体遗传分析 以酉州乌羊MC1R基因的CDS为参考序列(核苷酸差异位点的定位以山羊CDS起始密码子的第一位核苷酸为+1),将参考序列与本研究所测得的序列进行比对分析。由表2单核苷酸多态性(single nucleotide polymorphism,SNP)检测结果可知,MC1R基因c.676A>G变异位点在合川白山羊、巫溪白山羊、本地白山羊、酉州乌羊中共享,且在4个品种的山羊中杂合度均较低。Hardy-Weinberg平衡检验结果表明,SNP676位点都处于平衡状态(P>0.05)。

表1 MC1R蛋白功能位点预测Table1 The prediction of MC1R protein functional sites
2.6.3MC1R多肽性与肤色性状关联性分析 对合川白山羊、巫溪白山羊、本地白山羊、酉州乌羊MC1R基因的基因型进行统计并列联表独立性检验,由表3可知,c.676A>G位点的各基因型在皮肤白色和乌色山羊群体中的分布差异不显著(P>0.05)。
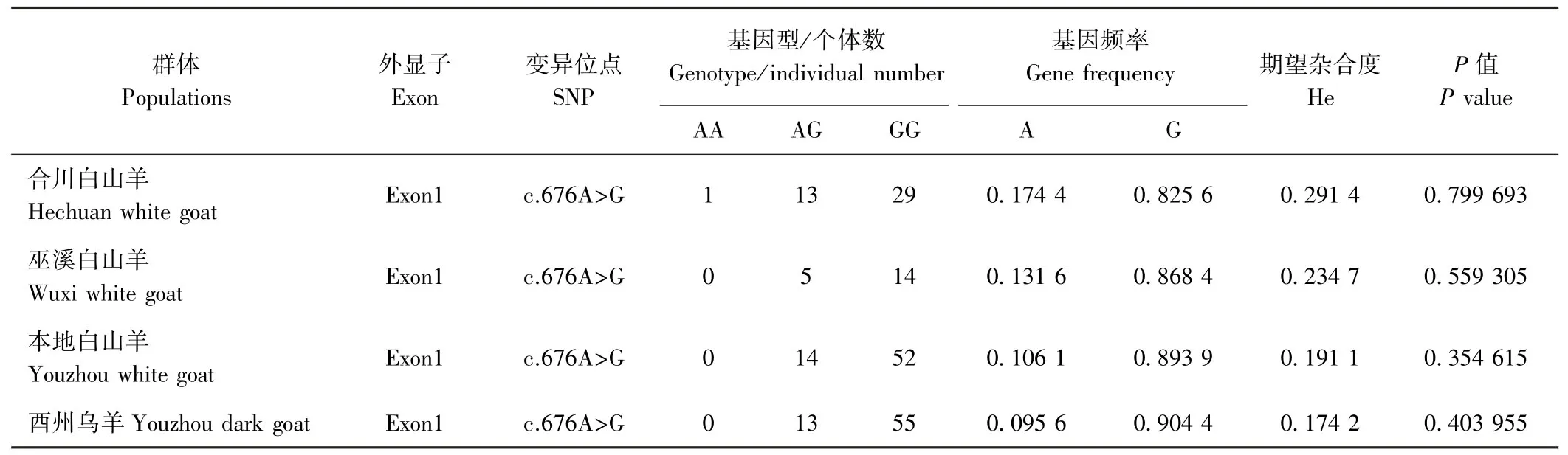
表2 MC1R基因编码区的遗传多样性Table2 The genetic variations for coding region of MC1R
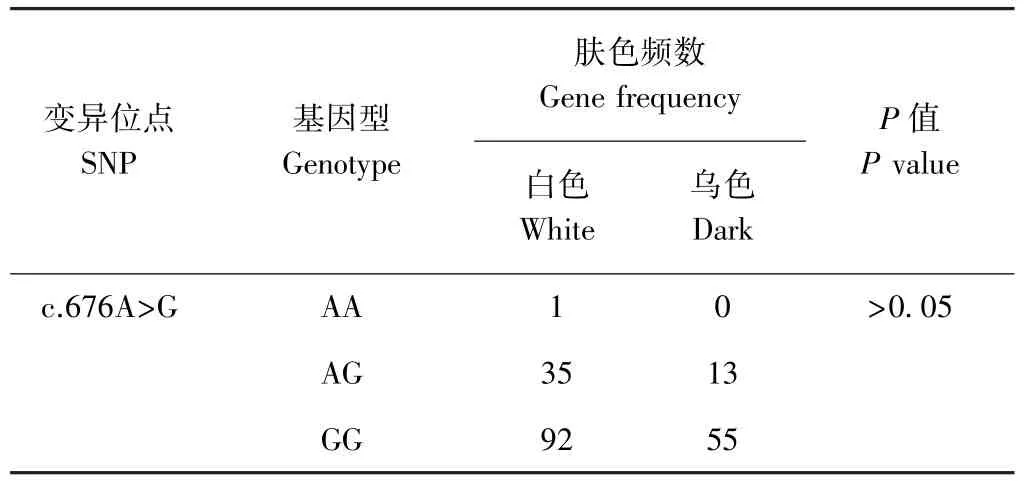
表3 MC1R基因的SNP基因型与皮肤乌质性状的关联分析Table3 Correlation analysis between goat skin melanin traits and SNP genotypes on MC1R gene
3 讨论
生物信息学技术可以分析基因序列所含的遗传信息,研究基因所控制形成的蛋白产物,并揭示其表达的生物学意义[19]。本研究从酉州乌羊皮肤中成功扩增出MC1R基因的cDNA序列,其CDS为954 bp,共编码317个氨基酸,基因序列同源性比较和进化树分析都显示了酉州乌羊与各物种MC1R的较高同源性。与其他G蛋白偶联受体(G protein-coupled receptors,GPCRS)一样,酉州乌羊MC1R有7个α-螺旋组成的跨膜结构域,细胞内C-末端具有酰化位点,细胞外N末端连接糖基化位点[20]。MC1R的C末端通常将蛋白质从内质网运输到血浆,还负责质膜上G蛋白受体的相互作用[21-22],细胞外N末端负责配体亲和力和信号锚的作用[23-24]。本研究结果表明,MC1R基因可在酉州乌羊皮肤组织表达,主要于细胞膜上发挥作用,这与其存在于黑色素细胞表面,接受α-MSH信号,进而调控肤色的功能相一致。此外,酉州乌羊MC1R(c.676A>G)突变还导致其226位氨基酸上发生了赖氨酸与谷氨酸的异义替换,氨基酸由碱性转变为酸性,异义替换同时位于其跨膜结构的第三个细胞内环和负责接收光刺激和G蛋白激活的7tm_1结构域上。此外,在MC1R第226位氨基酸上,其他物种都十分保守,氨基酸都为赖氨酸。前人研究发现,当MC1R环状结构上的突变发生在关键位点时,可能会降低其受体的功能、降低与MSH的偶联程度以及cAMP信号的传导水平,使真黑素与伪黑素的合成发生转换,并导致潜在诱变[25]。因此,研究初步推测酉州乌羊MC1R(c.676A>G)突变可能对酉州乌羊皮肤黑色素的沉淀有影响。对酉州乌羊MC1R突变型与野生型三级结构的预测结果还显示出其226位氨基酸的氢键构成有较大差异,空间结构发生变化,这一预测结果进一步为本研究的初步论断提供了佐证。
本研究对山羊MC1R基因多态性检测发现,c.676A>G变异位点在重庆合川白山羊、巫溪白山羊、本地白山羊、酉州乌羊中共享,且c.676A>G位点的各基因型在皮肤白色和乌色山羊群体中的分布差异不显著(P>0.05),这一结果与Peñagaricano等[26]的研究结果一致。Peñagaricano等[26]发现MC1R在皮肤中的表达量与考力代绵羊的白色皮肤和黑色斑点无关,并且提出了一些可能与皮肤黑色斑点沉积性状有关的新的候选基因(C-FOS基因和KLF4基因)。但Ren等[17]对酉州乌羊和渝东白山羊不同肤色山羊的100 d胎儿皮肤进行转录组水平分析以及差异表达基因分析发现,ASIP-MC1R的相互作用可能在胎儿山羊皮肤色素沉着的测定中发挥重要作用。Hepp等[27]研究还发现,MC1R和ASIP基因多态性与毛色分离极显著相关,所有的白色个体都是MC1R隐性等位基因(E+)且携带多拷贝的ASIP等位基因,显示两个基因的互作是克里奥尔羊毛色变异的主要原因。以上结果都预示着MC1R基因在影响羊皮肤黑色素沉积过程中的作用机制可能存在基因互作关系。目前,MC1R基因已发现有100多个非同义突变位点,MC1R基因多态性与皮肤相关性的研究多集中在人上。对欧美人群的研究发现,人MC1R变异体R151C、R160W、D294H与白皮肤、雀斑有一定的关系,这些变异体不仅可以降低受体功能,降低对MSH的反应,在体外降低与cAMP的功能,还与特定的表型相关,且MC1R等位基因变异的强弱可直接或间接反映信号传导通路受损的程度,最终导致黑素趋向于伪黑素的合成[28-31]。中国汉族人群MC1R多态性与肤色变异的关联研究共发现了2个较为重要的SNP位点,其中SNP274与皮肤颜色及雀斑有相关性,SNP421与皮肤颜色、对阳光的敏感性、雀斑等具有一定的相关性[32-33]。诸多研究结果显示,MC1R基因确实可影响皮肤黑色素的沉积,但其作用机制较为复杂,可能与基因的互作、等位基因变异的强弱、信号通路、皮肤颜色、对阳光的敏感性等有关。本研究中,SNP676在皮肤白色和乌色山羊群体中的分布差异不显著,但其突变的位置在接收光刺激和G蛋白激活的7tm_1结构域上,其是否影响受体的功能、降低与MSH的偶联程度以及cAMP信号的传导水平、通过与ASIP等黑色素沉积的关键候选基因互作影响皮肤的黑色素沉积等问题还需要进一步深入研究。
4 结论
本研究发现酉州乌羊MC1R基因CDS序列c.676A>G突变,导致226位氨基酸上发生了赖氨酸与谷氨酸的异义替换,突变位于其跨膜结构的第三个细胞内环和负责接收光刺激和G蛋白激活的7tm_1结构域上,还位于其酪蛋白激酶Ⅱ磷酸化位点上,氨基酸的异义替换于造成了酉州乌羊MC1R空间构象的差异,推测c.676A>G可能影响MC1R G蛋白激活,进而影响酉州乌羊皮肤黑色素的沉淀。群体变异检测发现,c.676A>G变异位点在重庆合川白山羊、巫溪白山羊、本地白山羊、酉州乌羊中共享,但各基因型在皮肤白色和乌色山羊群体中的分布差异不显著(P>0.05)。综上所述,MC1R基因可能影响酉州乌羊皮肤黑色素沉积,但其突变影响黑色素沉积的作用机制较为复杂,c.676A>G突变并不是酉州乌羊皮肤黑色素沉积的直接影响因素,其还可能通过与ASIP基因的互作、激活下游G蛋白受体等影响黑色素的沉淀,具体机制还需进一步研究。
