蔬菜液体培养基用于发酵培养青春双歧杆菌的研究
2021-01-27张腾霄蔡宏达冯俊宇王瑞祥张世东
张腾霄,王 斌,蔡宏达,冯俊宇,王瑞祥,张世东
绥化学院 食品与制药工程学院,黑龙江 绥化 152061
双歧杆菌(Bifidobacterium)是革兰阳性厌氧无芽孢杆菌,是人和动物肠道内最有益的乳酸菌群[1],在维持人体健康方面起到不可忽视的作用[2-3]。双歧杆菌在婴儿肠道菌群中处于优势地位且呈现多种类共存的微生态特征,特别是母乳喂养的婴儿,双歧杆菌占肠道菌群总数的90%[4],但人体肠道内双歧杆菌等益生菌会随年龄增大而减少[5],补充双歧杆菌等益生菌成为一种公认的保健方法。
液体发酵法是获取双歧杆菌活菌最便捷的方法,当前食品和制药工业上用液体培养基规模化发酵培养双歧杆菌,然后收集活性菌体冷冻干燥制成冲剂、片剂[6]、微胶囊[7-8]等各种活菌制剂产品,深受广大消费者的青睐。然而,当前用于发酵培养双歧杆菌等益生菌的培养基含有较多动物来源的营养成分,例如牛肉膏、蛋白胨、乳酪素、氯化血红素等[9-10],同时还含有多种化学成分,例如L-半胱氨酸盐酸盐、磷酸钾盐、乙酸盐、钙盐、镁盐、锰盐等[11-12],配制培养基的原料价格昂贵且配制方法烦琐,存在生产成本高、使用不方便的缺陷。寻找探索新的、价格低廉的益生菌发酵培养基原料是亟待深入研究的课题。
我国是蔬菜生产大国,某些蔬菜富含丰富营养物质,包括微生物生长所需要的碳源、氮源、无机盐和生长因子,因此,以蔬菜作为筛选原料,从中提取天然可溶性营养物质制成双歧杆菌的液体发酵培养基,具有原料供应充足、价格低廉的巨大优势,开发应用前景广阔。
1 材料与方法
1.1 原料及药品
黄秋葵、紫薯、番茄、马铃薯、胡萝卜购于绥化市北方果蔬综合超市;蒙牛纯牛奶购于绥化市华辰超市;TPY琼脂培养基:上海博微生物科技有限公司;PYG液体培养基配制所用的氯化血红素、L-半胱氨酸盐酸盐、维生素K1:上海麦克林生化科技有限公司;氯化钙、硫酸镁、磷酸氢二钾、磷酸二氢钾、碳酸氢钠、氯化钠、葡萄糖、蔗糖、乙醇、考马斯亮蓝G250、三氯乙酸、硫酸、蒽酮、磷酸等药品均为分析纯。
1.2 供试菌株
青春双歧杆菌(Bifidobacteriumadolescentis),从双歧杆菌活菌胶囊制剂(丽珠集团丽珠制药厂)中分离纯化培养获得。
1.3 实验仪器
YXQ-LS-50SII立式压力蒸汽灭菌器、HPX-9162MBE数显电热培养箱:上海博迅实业有限公司医疗设备厂;BS-2E空气浴振荡培养箱:金坛市良友仪器有限公司;SW-CJ-ZF双人双面净化工作台:苏州净化设备有限公司;KQ5200ES超声波清洗器;昆山市超声仪器有限公司;组织捣碎匀浆机:江苏省金坛市荣华仪器制造有限公司;电热恒温水浴锅:天津市泰斯特仪器有限公司;全自动菌落分析仪:杭州迅数科技有限公司;FA2104电子天平:上海舜宇恒平科学仪器有限公司;微量移液器:泰州市大龙医疗器械有限公司。
1.4 培养基的制备
1.4.1 蔬菜液体培养基的制备
将黄秋葵、紫薯、番茄、马铃薯、胡萝卜5种蔬菜,分别用自来水洗净外皮灰尘,各自切成小碎块,按果蔬碎块(湿质量)与水质量比为1∶2混合,放入组织捣碎匀浆机中以12 000 r/min匀浆处理5 min。将每种蔬菜的匀浆液转移到1 000 mL的烧杯中,200 W超声波破壁处理15 min,然后75 ℃水浴加热浸提30 min。加热浸提结束后,趁热抽滤,弃掉滤渣,保留浸提液并称质量,按照浸提液质量的2%加入蔗糖,然后分别把黄秋葵、紫薯、番茄、马铃薯、胡萝卜5种蔬菜提取液分装到250 mL的三角瓶(依次编号为A、B、C、D、E),每瓶培养基的装量为250 mL,备用。
1.4.2 牛奶液体培养基和PYG液体培养基的制备
选取牛奶液体培养基和PYG液体培养基作为对照和参比。
量取250 mL纯牛奶装于250 mL的锥形瓶中(编号为F),用间歇灭菌法灭菌2次,即每次100 ℃ 灭菌10 min,灭菌间隔时间为5 h。
根据GB 4789.34—2016规定的方法配制PYG液体培养基[13]。制备完毕后,将其分装到250 mL的锥形瓶中(编号为G),每瓶培养基的装量为250 mL,121 ℃灭菌15 min,自然冷却备用。
1.4.3 TPY琼脂鉴别培养基的制备
选取TPY琼脂鉴别培养基用于测定青春双歧杆菌活菌浓度。称取TPY琼脂46.4 g,在1 000 mL蒸馏水里加热煮沸至完全溶解,然后分装于500 mL锥形瓶中,121 ℃灭菌15 min,灭菌后置于50 ℃烘箱中备用(48 h内使用),防止凝固。
1.5 青春双歧杆菌种子液的制备
在超净工作台内取1粒双歧杆菌胶囊(活性青春双歧杆菌标示含量为5×107CFU·mL-1),将胶囊内活菌药粉倒入500 mL灭菌生理盐水中,振荡摇匀10 min,得青春双歧杆菌悬液,作为后续发酵试验接种用的种子液。
1.6 接种及发酵培养
无菌操作下,吸取1.5中制备的青春双歧杆菌种子液1 mL分别接种于1.4.1中制备的5种蔬菜液体培养基和1.4.2中制备的2种对照培养基。接种后,放入振荡培养箱中进行培养,设置温度为37 ℃,振荡速度为100 r/min,各个系列试验平行3次。发酵培养期间,每隔一定时间分别取样,考察青春双歧杆菌在各类培养基中的生长规律。
1.7 青春双歧杆菌在各类培养基中的生长规律测定
分别从上述发酵培养液中取样,以接种时刻为定期取样起点,在接种培养0、12、24、48、72 h取样,用梯度稀释混合平板法测定青春双歧杆菌生长动态变化。操作过程:依次取出各组培养瓶,振荡均匀后立即精确吸取发酵培养液1 mL,用生理盐水稀释104~105倍,再精确吸取1 mL稀释培养液加入无菌培养皿中,然后倒入约25 mL的TPY鉴别琼脂培养基,振荡混匀,凝固30 min,装入密封袋,袋内放脱氧剂,置于37 ℃恒温培养。培养72 h后,观察计数菌落数。各个样品平行取样3次,活菌计数取平均值。取样后的发酵培养瓶再次封口后放入振荡培养箱中继续培养。用SPSS软件对结果进行差异显著性分析,考察上述各组活菌浓度的差异。
1.8 发酵过程中发酵液中可溶性糖、蛋白质含量的监测
分别从上述1.6发酵培养液中取样,在接种培养0、12、24、48、72 h取发酵液样品4 mL,用于测定伴随青春双歧杆菌发酵过程中发酵液中可溶性糖(碳源)、可溶性蛋白质(氮源)含量的变化,考察培养液中碳源、氮源被利用和消耗的情况。将上述发酵液样品4 mL装于离心管中,9 000 r/min高速离心10 min,除去菌体及不溶性杂质,上清液用三氯乙酸法沉淀蛋白质,收集蛋白质沉淀并复溶,采用考马斯亮蓝法测定其蛋白质的含量。取脱除蛋白的上清液测定其可溶性糖的含量,测定方法采用蒽酮-硫酸法。用SPSS软件对结果进行差异显著性分析,考察上述各组碳源和氮源营养物质质量浓度的差异。
2 结果与分析
2.1 青春双歧杆菌在不同液体培养基中的生长情况
针对试验组的5种蔬菜液体培养基和对照组的2种液体培养基,在0~72 h的发酵培养过程中,通过对青春双歧杆菌5个发酵培养时间点的活菌浓度进行动态跟踪测定,得到的青春双歧杆菌活菌浓度变化情况,如表1所示。
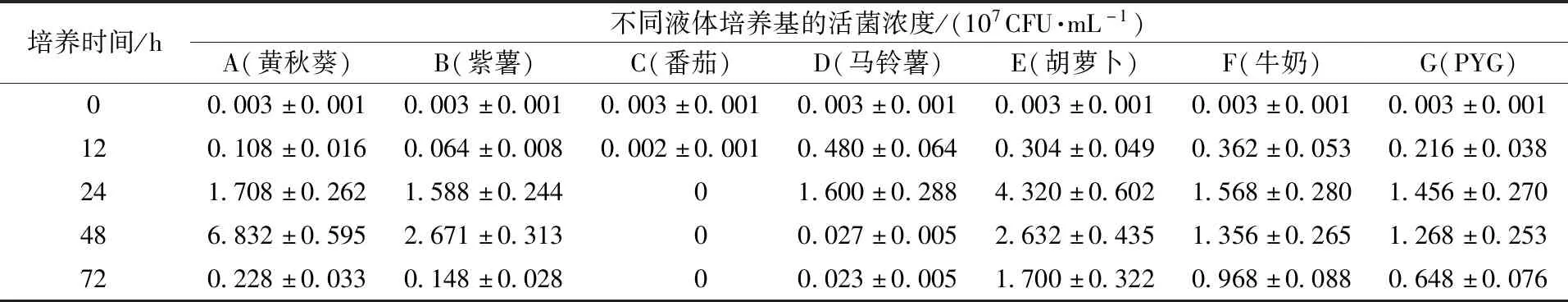
表1 青春双歧杆菌活菌数量在7种液体培养基中72 h内的动态变化Table 1 Dynamic change of the amount of viable Bifidobacterium adolescentis in 7 liquid culture media within 72 h
2.2 发酵过程中发酵液中可溶性糖、蛋白质含量的变化
培养基中的碳源和氮源的供给水平及青春双歧杆菌对其吸收利用水平是影响青春双歧杆菌繁殖、存活的最主要的影响因素。监测试验组的5种蔬菜液体培养基和对照组的2种液体培养基,在0~72 h的发酵培养过程中,发酵液中可溶性糖、蛋白质含量的变化情况如图1、图2所示。
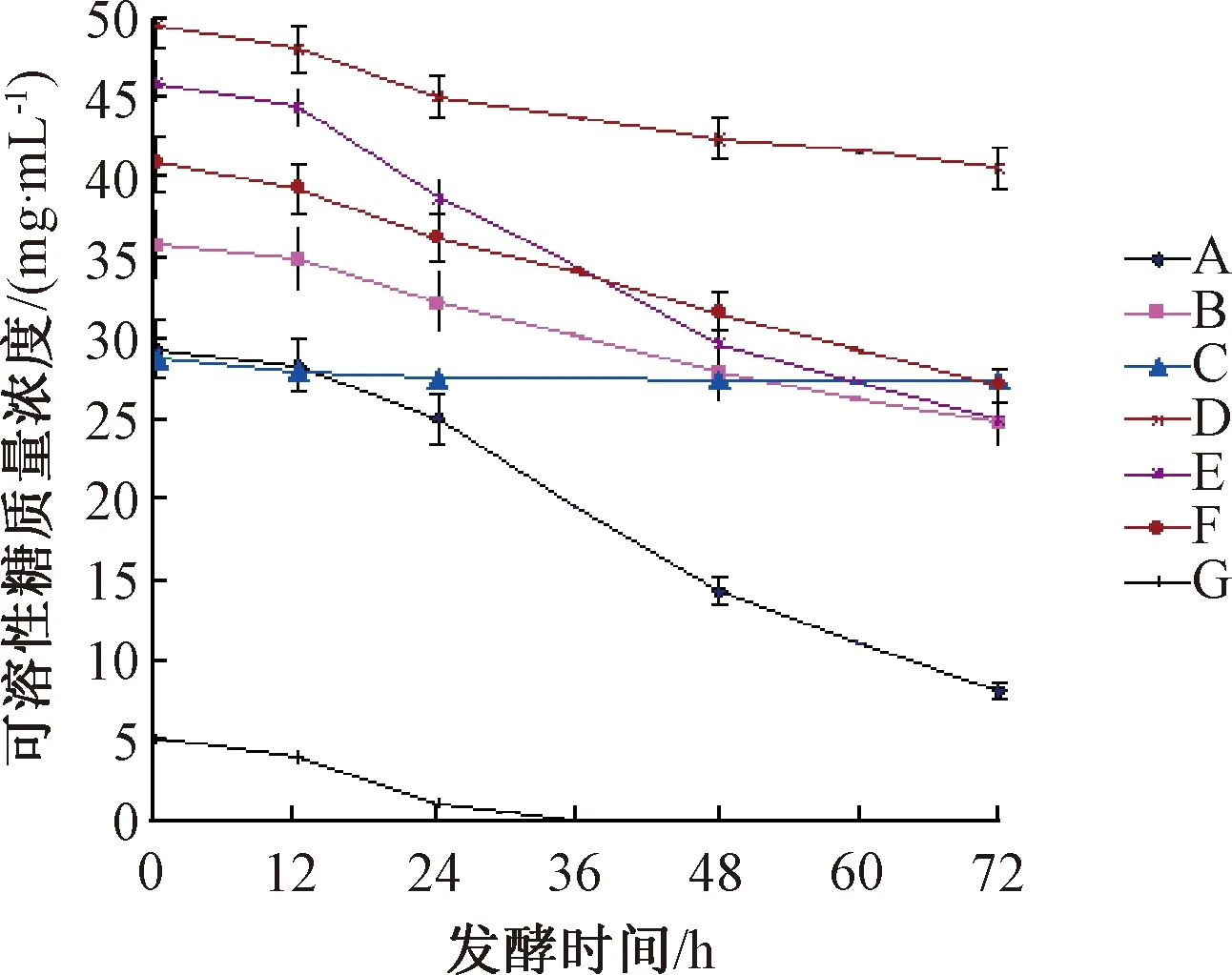
图1 发酵过程中发酵液中可溶性糖含量的变化Fig.1 Change of soluble sugar content in fermentation broth
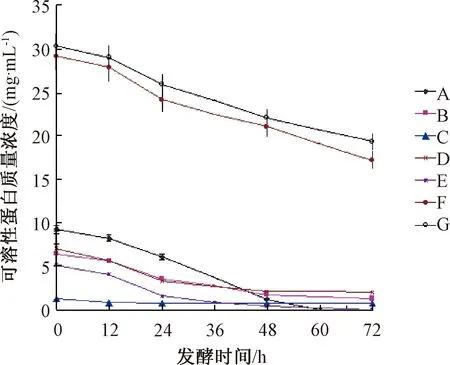
图2 发酵过程中发酵液中可溶性蛋白质含量的变化Fig.2 Change of soluble protein content in fermentation broth
从图1、图2可知,各种培养基的初始碳源、氮源营养物质的含量及比例均存在明显差异(P<0.05)。按培养基中初始可溶性糖(碳源)的质量浓度由大到小的顺序排列为D(49.56 mg·mL-1)、E(45.95 mgmL-1)、F(40.91 mg·mL-1)、B(35.85 mg·mL-1)、A(29.37 mg·mL-1)、C(28.71 mg·mL-1)、G(5.08 mg·mL-1),但培养青春双歧杆菌的效果并不是初始的可溶性糖的质量浓度越高越好,对比发酵结束时糖的消耗量(发酵开始至结束时的质量浓度差)可知,A、E的消耗量较高,分别为21.30 mg·mL-1、21.07 mg·mL-1,F、B和D的消耗量分别为13.80 mg·mL-1、11.02 mg·mL-1、8.93 mg·mL-1,结合表1可知,糖的消耗量越高所获得的青春双歧杆菌活菌浓度越高,培养液中可利用糖的供给能力是决定青春双歧杆菌生长繁殖的关键因素。从对糖的利用率角度看,青春双歧杆菌对G、A和E的利用率较高,分别为100%、72.52%、45.85%,对C、D和B的利用率较低,分别为4.46%、18.02%、30.74%。PYG中碳源为葡萄糖,黄秋葵中碳源为甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖和阿拉伯糖6种单糖组成的多糖[14],而马铃薯和紫薯中的碳源为淀粉。因此,青春双歧杆菌能很好地利用葡萄糖及黄秋葵多糖,而难以利用淀粉。
按培养基中初始可溶性蛋白质(氮源)的质量浓度由大到小的顺序排列为G(30.33 mg·mL-1)、F(29.19 mg·mL-1)、A(9.23 mg·mL-1)、D(7.02 mg·mL-1)、B(6.36 mg·mL-1)、E(5.11 mg·mL-1)、C(1.24 mg·mL-1),结果显示初始的可溶性蛋白质的质量浓度与培养效果呈非正相关关系,作为对照的G组和F组虽然蛋白质含量最高但并没有呈现活菌浓度的最大值,而蛋白质含量处于第3位的A组获得了活菌浓度的最大值,E组蛋白质含量偏低却获得较高的活菌浓度。综合比较,A组和E组的共同特点是蛋白质的利用率均最高,为100%,且糖的利用率也高,分别为72.52%、45.85%。因此,7种培养基中的糖和蛋白质的性质存在差异,被青春双歧杆菌吸收利用的程度存在差异,只有两者的利用率均高时才能获得较高的活菌浓度。
2.3 青春双歧杆菌在每种液体培养基中不同时间点生长规律分析
根据表1数据,从宏观角度分析,除了C组(番茄)外,青春双歧杆菌在6种液体培养基中的生长繁殖均呈现大致相同的生长趋势,即从接种后均经历了迟缓期、对数期、稳定期、衰亡期的较为典型的分批发酵生长曲线,各组均在发酵培养的0~12 h内增殖速度缓慢,均处于迟缓期,各组均在发酵培养72 h处于衰亡期,这反映了青春双歧杆菌对营养条件依赖性强且容易衰老死亡,与文献[15-16] 研究结果一致。但各组的对数期、稳定期、衰亡期持续时间不同,各组的活菌浓度峰值大小存在明显差异。
从接种到发酵培养72 h的过程中,青春双歧杆菌在A组(黄秋葵)和B组(紫薯)表现出相似的生长规律,两组都是从12~48 h处于对数期,直至培养48 h左右才达到生长峰值,之后活菌浓度迅速下降,对数期持续时间长,但两者的活菌浓度峰值存在显著差异(P<0.05),分别为6.832×107CFU·mL-1、2.671×107CFU·mL-1,A组的活菌浓度峰值是B组的2.56倍,且A组的活菌浓度峰值最大,高于其他6种培养基,培养效果最好。青春双歧杆菌在D组(马铃薯)、E组(胡萝卜)、F组(牛奶)和G组(PYG)呈现相似的生长规律,12 h后生长加速,在培养24 h后活菌浓度达到最大,随后菌体浓度逐渐下降。与A组和B组相比,其特点是对数期持续时间短,达到活菌浓度峰值时间短,比A、B组提前了24 h。其中,D组在培养至24 h活菌浓度达峰值后急速下降,衰亡速度非常快,而其余3组的活菌浓度达峰值后下降得相对平缓。青春双歧杆菌在C组没有呈现典型的生长曲线,发酵12 h活菌浓度低于接种初始浓度,发酵至24 h时没有检测到活菌存在,这说明接种后,在番茄液体培养基内直接进入衰亡期,青春双歧杆菌不能在此种培养基内增殖。
在分批发酵模式中,培养基中的营养成分比例越协调、含量越高,菌体繁殖密度越高[17]。当培养基中的营养成分(特别是限制性营养成分)被菌体利用完毕时,菌体生长进入衰亡阶段[18]。7种培养基中,增殖培养青春双歧杆菌效果好的3种为黄秋葵、胡萝卜和紫薯,达到活菌浓度峰值的发酵时间分别为48 h、24 h、48 h,由此可知,黄秋葵、胡萝卜和紫薯提取液中的维持菌体生长的营养成分种类及浓度较高,再结合图1和图2可知,该培养效果的产生与3种培养基中的可溶性糖和蛋白质的利用率高密切相关,特别是黄秋葵(与胡萝卜、紫薯相比)所含的可溶性糖和蛋白质含量均较高且两者的比例均衡。
2.4 青春双歧杆菌在相同时间内不同液体培养基中的生长规律分析
表1表明:接种初始(即0 h时),在7种培养基中接入了相同浓度的活菌,且以低浓度的活菌群体接种量作为测试起点。发酵12 h后,除了番茄培养基活菌浓度下降外,其他6种培养基均有不同程度的增殖,其中,以D组(马铃薯)、F组(牛奶)、E组(胡萝卜)3种培养基中活菌浓度较高,推测其中的某些营养成分能够刺激青春双歧杆菌快速增殖,缩短了迟缓期。发酵24 h后,番茄培养基活菌浓度降低至零,而青春双歧杆菌在其他6种培养基中均继续增殖,且以较高的生长速率增殖,其中的黄秋葵、紫薯、马铃薯、牛奶、PYG 5种液体培养基内菌体浓度大致相同,而胡萝卜液体培养基的活菌浓度最大,高达4.320×107CFU·mL-1,对青春双歧杆菌增殖培养效果均优于对照组F和G。发酵48 h后,各组的活菌浓度差异最为显著,各种培养基对青春双歧杆菌增殖培养效果形成强烈对比,显然黄秋葵培养基对青春双歧杆菌的增殖培养效果最好,其次为E组、B组。发酵72 h后,青春双歧杆菌在6种液体培养基中的活性均显著降低,只有E组、F组和G组中还残存有较多的活菌。
C组对青春双歧杆菌的培养效果最差,对其原因进行分析:1)番茄液体培养基在高温灭菌后析出大量不溶性沉淀物,即大量营养物质在高温灭菌条件下转变为不溶于水的成分,因而不能被青春双歧杆菌所利用;2)结合图1和图2数据分析,发酵液初始可溶性蛋白质含量太低(0.12 mg/mL),不能满足青春双歧杆菌对氮源的需求量,番茄自身的含糖量也非常低(3.30 mg/mL),且不容易被青春双歧杆菌吸收利用,利用率最低;3)对灭菌后的番茄液体培养基总有机酸含量进行测定,测定方法采用标准碱液滴定法[19],总有机酸的含量为1.06 mg·mL-1,可见培养基初始有机酸含量高,抑制了菌体生长繁殖。
3 结论
对5种蔬菜液体培养基和对照组的2种液体培养基中的初始可溶性糖(碳源)、可溶性蛋白质(氮源)含量进行测定,结果显示2种营养物质在各种培养基中含量及比例均存在明显差异。发酵培养青春双歧杆菌的结果显示,初始的可溶性糖和蛋白质的质量浓度与培养青春双歧杆菌的效果没有呈现典型的正相关,这与7种培养液中的糖和蛋白质的性质存在差异有关,两者被青春双歧杆菌吸收利用的程度存在差异,只有两者的利用率均高时才能获得较高的活菌浓度,例如黄秋葵、胡萝卜制成的液体培养基中所含可溶性糖和蛋白质均不高,但两者的利用率却都较高,均获得了较高的活菌浓度。
在人体胃肠道内双歧杆菌的活菌浓度必须达到106CFU·mL-1以上才能发挥明显的益生作用[20-21],本研究中选取的黄秋葵、紫薯、马铃薯、胡萝卜4种蔬菜液体培养基在0~72 h的发酵培养试验期间,对应的活菌浓度峰值分别为6.832×107、2.671×107、1.600×107、4.320×107CFU·mL-1,均超过了106CFU·mL-1益生作用的浓度底限,其中,黄秋葵液体培养基对青春双歧杆菌的增殖作用具有绝对优势,不仅活菌浓度峰值高出其他培养基数倍,而且菌体对数生长期维持时间较长。
在牛奶和PYG 2种标准对照培养基中,发酵培养24 h菌体浓度均达到最大值,分别为1.568×107、1.456×107CFU·mL-1,而黄秋葵、紫薯、马铃薯、胡萝卜4种蔬菜液体培养基培养青春双歧杆菌的活菌浓度的峰值超过了PYG、牛奶2种标准对照,这表明以黄秋葵、紫薯、马铃薯、胡萝卜为原料的液体培养基均可替代PYG、牛奶2种液体培养基用于青春双歧杆菌活性菌体的发酵生产。
