缓冲体系pH值对黑豆皮花青素含量及抗氧化活性测定影响的研究
2021-01-27张春雨谢岩黎杨玉辉
张春雨,谢岩黎*,杨玉辉
1.河南工业大学 谷物资源转化与利用省级重点实验室,河南 郑州 450001 2.河南工业大学 粮油食品学院,河南 郑州 450001
随着人们对营养健康食品的需求逐渐增大,含有花青素等天然抗氧化剂的食品受到消费者的青睐。食品工业中富含花青素的加工食品体系有较宽的pH值范围,例如:山楂酒的pH值在2.3~2.5之间[1],葡萄酒[2-3]、果汁[4-6]等产品的pH值在2.9~3.7之间,豆浆、面条等食品的pH值则可以达到6.4~7.3[7-8]。在加工过程中,为了使最终的产品具有一定的风味和较长的货架期,还引入了非常多的热处理,如工业烹饪、热烫、热挤压和热杀菌等[9]。目前作者所在实验室已经针对黑豆的综合利用开展了其在面制品方面的研究[10-11],为了拓展黑豆皮花青素在食品及保健品等领域的应用,有必要研究花青素在较宽pH值范围和不同温度热处理条件下的稳定性和抗氧化活性,降低工业化处理导致的损失,达到最大程度保留花青素的目的。
pH示差法是实验室常用的测定花青素含量的方法,该方法以强酸环境下花青素黄烊盐阳离子在520 nm附近的吸光度为依据对花青素进行定量[12-13]。天然产物的抗氧化活性测定有多种方法,其中ABTS和DPPH自由基清除能力是实验室常用的测定方法,两种物质的自由基都位于结构中的N原子上[14]。由于不同方法之间抗氧化机理存在差异,且相同的方法也因试验材料、试验对象等的不同而具有细节上的差异,导致数据之间的横向对比存在困难。鉴于此,作者探讨了pH示差法在测定花青素液体时的局限性以及自由基种类对黑豆皮花青素抗氧化活性的影响。
1 材料与方法
1.1 材料与试剂
矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G):纯度98%,从黑龙江双鸭山市出产的黑豆中分离提纯,采用文献[15]的方法制备;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,98%)和1,1-二苯基-2-三硝基苯肼(DPPH,98%):酷尔化学科技(北京)有限公司;试验中所用其他试剂均为分析纯,所用水为去离子水。
1.2 仪器与设备
HH-2型数显恒温水浴锅:金坛市华峰仪器有限公司;UV-6100S型紫外可见分光光度计:上海美谱达仪器有限公司;PHS-3C型pH计:上海雷磁仪器厂;DL-5-B型低速大容量离心机:上海安亭科学仪器厂。
1.3 试验方法
1.3.1 花青素样品的制备
使用0.2 mol/L的柠檬酸-磷酸氢二钠的缓冲液体系,分别取1 mg花青素固体溶于25 mL的pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0缓冲液,得到7个pH值的花青素溶液;取花青素溶液5 mL于25 mL玻璃试管中,分别在65、85、100 ℃下水浴加热处理30 min后立即置于冷水中降至室温,得到热处理样品。
1.3.2 pH示差法测定花青素含量
参考文献[16]的方法,分别用0.2 mol/L的盐酸-氯化钾缓冲液和0.2 mol/L乙酸-乙酸钠缓冲液配制pH 1.0、4.5的缓冲液,取上述花青素溶液样品0.4 mL与3.2 mL缓冲液混合,平衡10 min后测定样品在510、700 nm处吸光度A510、A700,每个样品处理做3组平行试验。
花青素含量按照下式[17]计算:
A=(A510-A700)pH1.0-(A510-A700)pH4.5,
式中:C为花青素含量,mg/L;A为吸光度;ε为矢车菊素-3-O-葡萄糖苷的吸光系数,26 900 L·mol-1·cm-1;F为稀释因子;M为矢车菊素-3-O-葡萄糖苷的摩尔质量,449.2 g/mol;d为光程,1 cm。
1.3.3 花青素抗氧化活性测定
1.3.3.1 ABTS清除率的测定
参考Van Den Berg等[18]的方法,并作适当调整。
分别配制7 mmol/L ABTS水溶液和2.45 mmol/L过硫酸钾水溶液作为储备液,等体积混合两种储备液后在室温下避光放置12~16 h,形成工作母液,使用无水乙醇将工作母液稀释23倍后作为ABTS工作液。
分别量取2.85 mL ABTS溶液、0.15 mL花青素溶液,2.85 mL ABTS溶液、对应pH值的空白缓冲液,2.85 mL无水乙醇、0.15 mL花青素溶液于10 mL离心管中,振荡混匀后避光反应10 min。未离心样品组直接在734 nm处测定得到吸光度A1、A0和A2;离心样品组经3 000g离心5 min后在相同波长下测定吸光度A1、A0和A2。
1.3.3.2 DPPH自由基清除率的测定
参考Brand-William等[19]的方法并作适当修改。
取DPPH固体溶于无水乙醇得到80 μmol/L的DPPH工作溶液,然后分别量取2.85 mL DPPH溶液、0.15 mL花青素溶液,2.85 mL DPPH溶液、对应pH值的空白缓冲液,2.85 mL无水乙醇、0.15 mL花青素溶液于10 mL离心管中,振荡混匀后避光反应30 min。未离心样品组直接在515 nm处测定得到吸光度A1、A0和A2;离心样品组经3 000g离心5 min后在相同波长下测定吸光度A1、A0和A2。
上述两种自由基清除率按照下式计算:
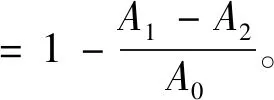
1.4 数据处理
使用Excel软件对测定数据进行汇总整理,用Origin 8.5软件对数据进行可视化,使用SPSS 19.0软件中的单因素方差分析(ANOVA)及配对样品T检验对数据进行显著性分析(P<0.05)。
2 结果与分析
2.1 缓冲体系pH值对花青素含量测定的影响
在强酸环境下花青素黄烊盐阳离子呈现出鲜艳的红色,pH示差法主要是通过测定其在520 nm附近的吸光度判定溶液中花青素含量。当被测体系不在强酸环境中,花青素在水溶液中主要存在黄烊盐阳离子、甲醇假碱、查尔酮以及醌式碱4种结构,4种结构之间存在化学平衡[20-21]。因此,当花青素受到热加工等外界因素影响导致其无法以阳离子结构存在,以pH示差法测定的花青素含量会降低。
试验pH值范围内不同温度热处理后的花青素含量如表1所示。可根据花青素含量的变化规律将pH值划分成3个范围:pH 2.0~4.0,花青素在各种加热条件下保持相对稳定,变化率小;pH 5.0、6.0,花青素含量在特定加热环境下出现升高的趋势;pH 7.0、8.0,花青素含量随着温度升高而迅速降低。试验结果主要是由花青素结构随pH环境变化而变化导致的:花青素在pH<4.0时主要以黄烊盐阳离子结构存在[22],该结构稳定性较好;在pH 5.0~6.0之间是黄烊盐阳离子、查尔酮、甲醇假碱及醌式碱4种结构共存的状态,加热虽然会导致一部分花青素降解成小分子或转变成查尔酮,但由于其他结构之间存在相互转化,整体表现出较强的稳定性;花青素在pH≥7.0的环境则以查尔酮和醌式碱结构为主,这两种结构都是由黄烊盐阳离子结构转化来的,二者之间不存在直接转化途径[20, 23],因而溶液中残留的花青素在此pH值环境下无法逆回到黄烊盐阳离子结构显色,导致以pH示差法检测的花青素含量下降。

表1 pH值对热处理后花青素含量的影响Table 1 Effect of pH on anthocyanin content after heat treatment mg/L
2.2 缓冲液pH值及自由基种类对花青素抗氧化活性的影响
2.2.1 ABTS清除率
在测定花青素清除自由基能力时,离心处理对不同pH值环境热处理后花青素ABTS清除率的影响如图1所示。在未经离心处理的样品组中,pH 2.0~8.0范围内花青素对ABTS的清除率呈现倒“U”形的趋势,图1a、图1b和图1c中的花青素在pH 2.0时的清除率最低,pH 3.0~6.0之间的清除率较高且互相之间没有显著差异(P>0.05),而pH值达到7.0和8.0时清除率降低且两种环境无显著差异(P>0.05)。图1d仍具有倒“U”形的趋势,但是两种处理的样品组清除率分别在pH 4.0、5.0时达到最高点。经离心处理的样品组中花青素对ABTS的清除率却呈现类似“~”的波动趋势,清除率在pH 4.0、5.0、8.0达到较高,pH 2.0环境的清除率最低。
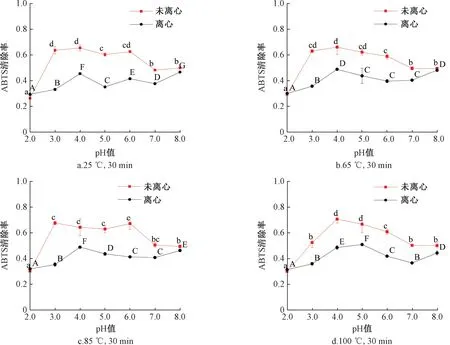
注:不同的大写字母表示离心处理样品组不同pH环境之间具有差异性,不同的小写字母表示未离心处理样品组不同pH环境之间具有差异性,P<0.05。图2同。图1 缓冲液pH值对热处理前后花青素ABTS清除率的影响Fig.1 Effect of buffer pH on ABTS free radical scavenging rate of anthocyanin before and after heat treatment
2.2.2 DPPH清除率
离心处理对不同pH值环境经热处理后花青素DPPH清除率的影响如图2所示。在未经离心处理的样品组中,pH 2.0~8.0范围内花青素对DPPH的清除率呈现和图1类似的倒“U”形趋势,pH 2.0环境下的花青素对DPPH清除率也同样是最低的。经离心处理的样品组对DPPH的清除率在25 ℃和65 ℃时呈现“M”形趋势,而在85 ℃和100 ℃处理后则呈现倒“U”形趋势,其清除率的最低点为pH 8.0环境。
对比上述两种自由基试验结果可以看到,花青素所处的pH值环境对花青素的自由基清除率有显著影响(P<0.05),但是热加工对相同pH值环境下的自由基清除率却只在个别条件下影响显著(以离心组数据为基准)。这可能是因为pH值对花青素结构有较大影响,而花青素各个结构之间可以通过化学反应维持相对平衡,虽然热加工会导致一部分花青素发生降解,花青素依然可以通过一定的结构动态平衡以及降解产物来发挥抗氧化活性[24-27]。另外,两种自由基试验表明,花青素的未离心组和离心组在pH 2.0时清除率基本一致,在pH 3.0~8.0环境下离心组花青素对DPPH的清除率远低于未离心组,但pH 8.0环境下离心组花青素对ABTS清除率出现明显上升且接近未离心组。同样采用柠檬酸-磷酸氢二钠缓冲体系且以乙醇作为自由基溶剂的文献[26, 28-29]并没有提到离心处理。除了pH 2.0的样品,其他pH值的花青素样品加入自由基溶液后会出现明显的白色浑浊,这是缓冲液中含有的不溶于乙醇的磷酸氢二钠析出导致的,如果未经离心处理直接测定会因为钠盐晶体对光路的遮挡作用导致吸光度增大,从而使得测定的花青素抗氧化活性增大。ABTS自由基溶液的吸光度在加入pH 8.0的缓冲液后显著下降,比其他缓冲液的吸光度低约14%(从1.512下降到1.300),这可能是导致pH 8.0环境的离心组样品ABTS清除率异常升高的原因。
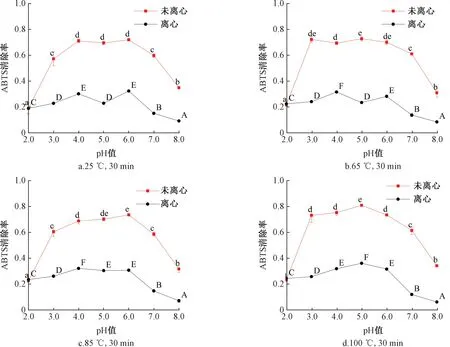
图2 缓冲液pH值对热处理前后花青素DPPH清除率的影响Fig.2 Effect of buffer pH on DPPH free radical scavenging rate of anthocyanin before and after heat treatment
3 结论
由于花青素在pH 2.0~8.0缓冲体系中存在黄烊盐阳离子、甲醇假碱、查尔酮以及醌式碱4种结构之间的化学平衡,导致以pH示差法检测此范围溶液中花青素含量出现偏差。
弱酸环境(pH 4.0~6.0)下花青素的自由基清除率显著高于强酸及碱性环境,而热处理对自由基清除率的影响较小。花青素对两种自由基的清除能力在pH>7.0的环境下出现显著差别,可能与DPPH属于氮自由基而ABTS属于氮阳离子自由基有关。
缓冲液体系中含有的磷酸氢二钠在乙醇中析出对光路产生物理阻挡,导致测定的未离心处理组抗氧化活性显著高于离心处理组。
