温度对生命体寿命的影响
2021-01-27赵佐舜刘宝林
赵佐舜,刘宝林
(上海理工大学 医疗器械与食品学院,上海 200093)
衰老是生命体的内在固有过程,是对外源因素和内源因素的处理和反应,衰老损伤体内分子和细胞的功能和结构,最终导致疾病或死亡。衰老的特征在于生理功能受损并逐渐丧失,无法维持生命体内环境稳态(homeostasis)。衰老也是导致许多疾病的主要因素,包括癌症、心血管疾病、糖尿病及神经退行性疾病等[1]。生命速率理论(rate-of-living theory)常被用于解释温度对寿命的影响[2],即低温减慢了生化反应速率,从而减缓衰老的进行,而高温则加速衰老。由阿伦尼乌斯方程k=Aexp(-Ea/(RT))可以知道,生化反应速率常数k随着温度T的降低而下降,体温降低可以减少生命体正常生化反应中有毒物质生成,减少这类物质积累引起的各类损伤,进而延缓衰老[3]。A表示指前因子,Ea表示表观活化能,R表示摩尔气体常数。温度是生物系统的基本特性,许多物种的研究都将温度与衰老、寿命联系起来。早期的研究主要集中于变温动物,因为,变温动物的体温会随着环境温度变化,一个世纪前的研究证明了果蝇的寿命与温度呈负相关[4]。针对恒温动物的研究表明,其可以依据环境温度的变化而调节自身产热,使体温稳定在一个狭窄的范围内。Ames侏儒小鼠的寿命比野生型长1年左右,可能因为其体温较低[5]。恒温动物摄入较少卡路里热量时,则体温也降低,这一现象常被用来研究核心体温对寿命的影响[6]。自从上述温度与寿命关系的早期开创性研究以来,随着该领域研究的不断发展,近期研究的模型已经扩展到其他物种,并探讨了延长寿命的影响因素之间的关系。
本文综述了温度对生命体寿命的影响,包括温度通过基因表达影响细胞信号传导通路的寿命调节作用、生化反应对温度的响应。这些机制可能相互影响、相互作用,所以,长寿的温度调节比人们预想的更复杂。
1 温度通过基因表达影响寿命
对衰老的研究由于发现了影响寿命的特定细胞信号传导通路得到了进一步发展[7-8]。文献[7]总结的信号传导通路包括瞬时感受器电位(transient receptor potential, TRP)通 路、生 长 激 素(growth hormone, GH)、胰岛素/类胰岛素样生长因子(the insulin/insulin-like growth factor, IGF-I)通路。在对轮虫寿命的研究中发现,虽然低温延长了所有品系轮虫的寿命,但在不同遗传背景下,寿命延长效果具有显著性差异[9]。这表明生物对低温的响应取决于遗传因素,并且可能由特定的遗传通路驱动,如TRP通路影响细胞死亡率,延长或缩短细胞存活。TRP通路介导的钙离子内流产生不同的细胞内钙离子信号,其调节下游通路诱导细胞凋亡或存活,进而影响心血管、神经、代谢或肿瘤疾病的发生[10]。其中,TRPA-1是一种在线虫中存在的冷敏感TRP通路,可以检测环境中的温度下降,从而启动基因程序以延长寿命[11-12]。在小鼠实验中,遗传性GH缺乏或抗性导致寿命的显著延长,伴随着衰老减缓的迹象。在其他哺乳动物中也显示了GH信号传导通路和IGF-1相关机制与长寿的负相关。在人类中,GH抗性或缺乏的综合征对长寿没有类似的显著影响,但可以提供对癌症、糖尿病和动脉粥样硬化的抵抗[13-14]。
最近的研究[12]表明,特定的机制可以响应较低的温度来延缓衰老,如图1所示,在秀丽隐杆线虫(Caenorhabditis elegans, C.elegans)中,已发现其冷敏感TRP通路TRPA-1可通过诱导钙离子流入细胞依次激活PKC-2(一种钙离子敏感的蛋白激酶C)和SGK-1(DAF-16 / FOXO激酶),通过SGK-1激活DAF-16 / FOXO 转录因子(一种寿命调控因子),该遗传程序有助于在低温下延长寿命[11]。但是,DAF-16可能在幼虫阶段和成虫阶段以相反的效果影响线虫的寿命,结果是在低温条件下,DAF-16调节基因表达使幼虫寿命缩短,延长成虫寿命[11]。总的来说,温度对秀丽隐杆线虫寿命的影响不是一个被动的过程,这个结果对以热力学为基础的生命速率理论是一个挑战。
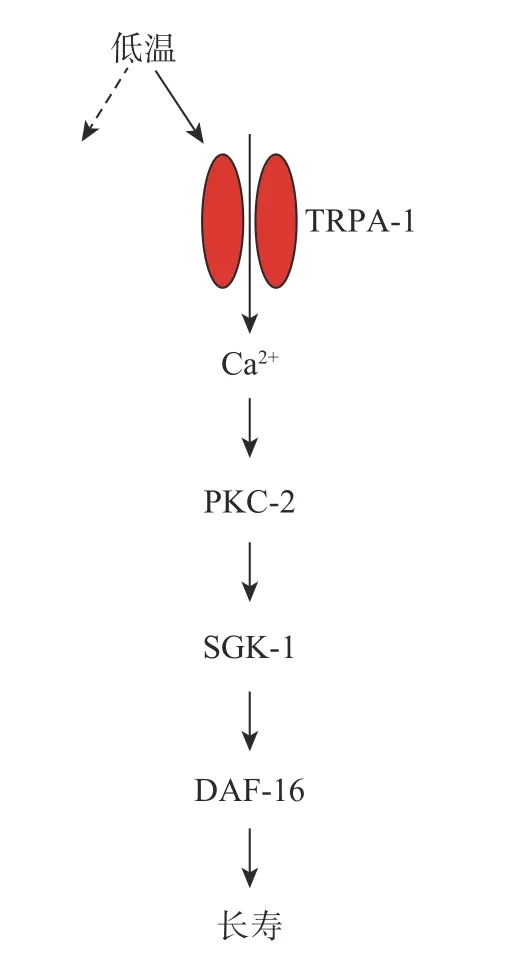
图1 冷敏感TRPA-1通路激活遗传程序以延长寿命Fig. 1 Cold sensitive pathway TRPA-1 activation genetic programs to extend life
由于Ames和Snell侏儒小鼠缺乏促甲状腺激素和GH,所以,它们的体温较低[15]。Ames和Snell侏儒小鼠分别在Prop-1和Pit-1基因座中发生突变,导致促甲状腺激素、催乳素和GH缺乏以及胰岛素水平降低[7]。GH受体敲除的小鼠和侏儒小鼠,具有较低水平的胰岛素和循环IGF-1,因此,与GH和促甲状腺激素相关的胰岛素通路可能是啮齿动物体温调节的潜在机制。同时,GH和IGF-1循环水平的降低可能导致衰老期间的功能缺陷。IGF-1/胰岛素通路还控制从线虫到哺乳动物的许多生命体的寿命和衰老,虽然减少IGF-1信号不利于生长和增殖,但可以延长寿命[14]。
类似于低体温对生命体的影响,GH相关突变体寿命延长的机制可能包括抗氧化防御改善、胰岛素敏感性增强、胰岛素水平降低、炎症反应和细胞衰老减少、线粒体功能和能量代谢变化以及更强的应激抵抗力[13-14]。
热量限制(caloric restriction, CR)是一种通过在确保营养的情况下减少热量摄入,延长物种寿命的干预措施。在大部分实验中都观察到CR导致包括小鼠、灵长类动物和人类在内的恒温动物的核心体温降低[16]。在热量限制条件下,动物基因表达的变化或某些细胞信号传导通路的激活可能影响寿命,例如,葡萄糖转运蛋白4、胰岛素激活的氨基酸转运蛋白和脂肪酸转运蛋白受到长期CR的影响上调[17]。同时,参与糖酵解和脂解通路,氨基酸代谢和线粒体能量代谢的基因的表达受到长期CR的影响上调[17]。这表明经历长期CR的小鼠,其葡萄糖、氨基酸和脂肪酸的效率和摄取能力增强了,相反,在长期CR的小鼠的白色脂肪组织中,参与炎症的基因表达显著降低[18]。因此,CR动物较好的健康状况是由于基因表达活性的增强而引起的脂肪减少。
2 温度对生命体生化反应的影响
早期的研究集中在温度对无脊椎变温动物的寿命的影响,因为,它们的体温由周围环境决定,在实验室条件下比恒温动物更容易操作。其中一项早期研究表明[19],黑腹果蝇在21 ℃时的寿命大约是27 ℃时的2倍。其他研究也得到相似的结果[20],表明温度对黑腹果蝇和秀丽隐杆线虫的寿命和衰老速率有显著影响。在有脊椎变温动物实验中也获得了类似结果[21-22],两项关于短寿鳉鱼寿命的研究表明,温度分别下降5 ℃和6 ℃时,它们的寿命对应增加了43%和75%。环境温度的变化对拉氏假鳃鳉的寿命影响更大,从30 ℃降低到25 ℃,其寿命增加了50%,而从25 ℃降低到20 ℃,寿命增加了64%[23]。目前的数据表明[24],在较低的环境温度下,两栖动物表现出与其他变温动物一样的寿命延长。
与变温动物相比,恒温动物具有更强的产热能力、更稳定的体温。低温对恒温动物的寿命也有影响,例如,在一年中较冷的季节出生的婴儿体重、孕龄和寿命增加,并且胎儿发育缺陷和早产的风险较低,而在温暖的季节出生的婴儿中得到了相反的结果[25-26]。冷暴露实验中[27],小鼠暴露在较低环境温度中,慢性低温诱导肩胛间棕色脂肪组织(brown adipose tissue, BAT)增加,细胞增殖和解偶联蛋白1(uncoupling protein1, UCP1)增加,以应对低温环境。如果人类暴露在冷的环境中,在短时间内引起急性生理反应,增加产热并减少散热,长期冷暴露会促使人体通过自身生理生化调节过程,形成冷驯化,可以改善心血管功能、免疫功能[28]。对非人类灵长动物和人类的CR实验结果[29-30]表现出与啮齿动物相同的现象,都出现了体温降低,血液胆固醇、血压、空腹血糖和白细胞计数降低。转基因“冷鼠”实验[31]得到了仅在下视丘分泌素(Hcrt)神经元中过表达解偶联蛋白2(UCP2)的Hcrt-UCP2小鼠,与野生型相比,转基因雌性小鼠核心体温平均减少0.34 ℃,预期寿命提高了20%,转基因雄性小鼠的核心体温平均减少0.3 ℃,预期寿命提高了12%。这些实验结果表明,对恒温动物和变温动物,体温或者环境温度在寿命调节中具有普遍作用。
2.1 能量代谢
长期以来,人们都应用热力学理论来解释衰老现象,认为衰老是分子紊乱增加和代谢稳定性降低的结果。低体温的情况下,体内生化反应的速度和代谢率降低,延缓了衰老[4,32]。在热力学第二定律适用于开放系统的条件下,代谢稳定性下降使生命体内分子熵随时间增加,提高了患年龄相关性疾病的可能性,这样的过程基本上等同于衰老过程[33]。由于代谢率随温度呈指数增加,因此,在较小的温度范围内,低体温使寿命呈指数级增长[34]。尽管低体温小鼠长寿的具体机制仍然未知,但代谢需求因维持较低的体温而下降,导致能量代谢效率上升,这可能影响各种形式的分子损伤,包括减轻氧化应激和DNA损伤。
早期的冷暴露实验可以支持生命速率理论,确定了低体温是否会影响寿命。相对于变温动物的冷暴露实验,一项小鼠实验研究结果表明[35],冷暴露中或冷暴露后小鼠的核心体温没有变化,但食物摄入量增加44%,平均每日能量消耗显著升高,并且与对照组相比具有显著的低体重,研究结果没有显示出寿命差异,但冷暴露小鼠的恶性肿瘤发生率显著降低。这些研究结果揭示了低温引起的代谢变化对寿命影响的现象。
冷暴露动物的脂肪含量降低具有重要的健康意义,例如,脂肪含量增加与炎症有关,而炎症又与几种慢性疾病相关,因为,分泌的脂肪因子与免疫细胞相互作用以释放炎症蛋白并将免疫细胞聚集到脂肪组织中,随后产生并释放促炎介质[36-37]。
2.2 氧化还原水平
在恒温动物中,BAT起到产生热量的作用,目的是在寒冷环境中维持体温。BAT在动物幼体、成年啮齿类及冬眠哺乳动物的颈部和腋部分布较多,其数量与动物的体型大小成反比,脂肪细胞之间的疏松结缔组织中有较丰富的毛细血管和神经纤维,能产生大量热量流经其周围的血流,对维持初生和冬眠动物的体温有重要意义[38]。
解偶联蛋白,特别是UCP1,是位于BAT线粒体内膜中的线粒体转运蛋白,可增强质子传导性,使三磷酸腺苷(ATP)的产生与氧化磷酸化过程分离,从而产生热量。有证据表明UCP家族中的几种其他蛋白质(UCP2,UCP3,UCP4和UCP5)在产热、抵抗活性氧(reactive oxygen species, ROS)和长寿中起作用[39]。在冷暴露和低体温期间,去甲肾上腺素和甲状腺激素通过UCP刺激BAT产热,这表示冷暴露啮齿动物中BAT的UCP表达增加[40]。反过来,由于UCP将氧化磷酸化过程与ATP产生分离导致ROS的产生减少。基于以上所述,UCP现在被广泛认为在生物的抗氧化防御系统中发挥作用。
UCP表达上调时引起的ROS产生减少,可能是较低体温和长寿之间相关性的因素之一。传统的自由基衰老学说(the free radical theory of aging)认为氧化应激损伤细胞,当这种氧化损伤积累到体内稳态无法修复时,就会引起衰老。然而,在线虫实验中发现[41],幼虫阶段经历的高温暴露反而延长了寿命,这可能是因为高温引起的氧化应激在幼虫中积累了高水平的抗氧化物质。因此,尚不清楚ROS诱导的损伤是否是衰老的主要原因。啮齿动物实验发现[42],在低温环境中蒙古沙鼠不同器官中的抗氧化防御能力和氧化损伤有显著差异。随着年龄的增大,ROS会提高某些疾病的发病率,原因可能是随着衰老的进行,生物的氧化还原应激反应能力降低,包括产生适量ROS激活细胞信号通路的能力、激活抗氧化系统维持氧化还原平衡的能力和降解氧化损伤蛋白的能力,生物无法将体内的氧化还原水平维持稳态[43]。
2.3 免疫功能
研究已经证明[44-45],在不同的哺乳动物模型中,低体温会诱导免疫功能细胞和体液免疫功能的变化,包括淋巴细胞增殖的减少,以及自然杀伤细胞数量和其细胞毒性的降低。人类实验表明[46],低体温可能对免疫功能有利,例如,核心温度降低0.8 ℃不会改变白细胞总数,而手术期间核心温度降低1 ℃会导致手术后24 h和48 h淋巴细胞增殖和白介素2产生减少。此外,核心温度降低0.5 ℃和0.6 ℃导致自然杀伤细胞活性降低。体外实验的结果支持了这些发现[46],与在37 ℃孵育1 h相比,在34 ℃下孵育1 h的单核细胞,能够杀死更多的大肠杆菌,这有利于宿主防御。更重要的是,体温的缓慢降低,与CR期间观察到的相似,已被证明可以提高免疫反应性,特别是T淋巴细胞、T辅助细胞和T抑制细胞数量增加以及活化的T淋巴细胞和B淋巴细胞的表达增加[28]。但是,持续冷暴露对不同个体的影响仍不明确,甚至可能抑制免疫反应,未来的工作可以关注冷暴露引起的应激水平与免疫功能变化的关系。
2.4 热量限制
CR中的啮齿动物减少30%~40%的食物摄入量,会使寿命增加约50%~65%[47]。CR会改变核心体温并通过抗衰老基因表达促进物种寿命[48]。如图2所示,经历CR的哺乳动物脂肪量显著减少,导致脂肪因子(adipokines)的循环水平发生显著变化[2,49-50]。脂肪组织的改变以及生长激素释放肽(ghrelin)水平的改变,导致CR期间观察到的循环促炎性细胞因子水平降低[50]。如上文所述,CR的抗衰老机制也涉及基因表达和细胞信号传导通路[17-18],以及BAT激活引起的UCP1表达上调导致ROS水平下降[39]。低体温对调节由CR引起的生理变化具有重要作用,为了节约能量,在响应甲状腺激素和代谢率降低的CR哺乳动物中出现体温降低[2]。低体温不仅是CR的结果,文献[7]总结了低体温对寿命的独立影响,同时低体温和CR在对寿命的延长机制上有部分重叠,包括降低脂肪量、影响氧化损伤程度、影响包括GH / IGF-1途径在内的寿命的内分泌调节。温度也对CR有重要影响,实验证明,经历CR的小鼠在高温环境下,一些CR的效果减弱[51]。

图2 热量限制与体温之间的关系及其对寿命的影响Fig.2 Relationship between caloric restriction and body temperature and their influence on longevity
2.5 温度与死亡率
人类死亡率基本符合1825年Benjamin Gompertz提出的指数公式,这个指数公式被称为Gompertz的“死亡率定律”:婴儿时期具有较高的死亡率,随着年龄增长死亡率下降,直到10~15岁时死亡率降至最低点。之后,死亡率急剧增加,每10年死亡率都会翻倍。这个趋势将会一直持续到80岁。但因为温度不是Gompertz函数的变量或参数,所以,死亡率定律不能预测温度对寿命的影响,可以通过引入一个假设的活化能E1来解决这个问题[3]。假设活化能El是保护生命体内重要的化学物质免受自生或其他分子损害的能量,并且E1与一个重要的分子单位的数量成正比,这个分子单位随时间线性减少。这个分子单位没有被确定,目前端粒是最好的选择。
端粒是真核生物染色体末端的DNA-蛋白质复合物,具有保持基因组稳定性的作用[52]。最短端粒的长度是衰老开始的主要决定因素[3,52-53]。端粒的缩短速率满足阿伦尼乌斯公式。文献[3]通过在死亡率定律中加入阿伦尼乌斯公式和一级动力学公式,将活化能E1、分子单位的消除速率与温度联系在一起。最终得到了一个关系式:
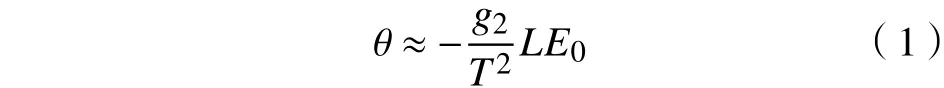
式中:θ表示生命体的温度系数;LE0表示出生预期寿命;T表示体温;g2表示一个与T无关的常数。
式(1)中的负号表明,随着T的增加,LE0减小。通过实验数据[54-55]确定g2大约为10000 K,可得θ=−0.12LE0,即温度下降1 ℃,寿命会增长出生预期寿命的12%,当温度降低8 ℃时,平均寿命将会翻倍[3]。
3 结 论
温度能明显地影响变温动物和恒温动物的寿命,最初人们认为是热力学效应和低代谢的影响,如减少的氧化损伤、DNA损伤及脂肪量。现在的一些研究表明,温度对寿命的影响不能简单地使用热力学效应来解释。本文综述了特定基因表达和细胞信号传导通路通过响应低温环境影响衰老过程并延长寿命的机制。温度对生化反应的影响并不能仅用温度定律解释,体温降低会改变能量代谢和氧化还原水平,改变免疫功能。低体温和CR在对寿命的延长机制上有部分类似。低温对衰老的延缓是许多生化反应相互影响、相互作用的最终结果,其具体机制还尚不明确。同时,将温度系数引入死亡率定律的研究,也提出了温度变化能改变重要分子单位数量的假设,这种改变可能引起人体器官生理活动的变化,为研究温度对寿命的直接影响提供了理论基础。
