牦牛骨胶原蛋白肽的制备及其抗冻性能研究
2021-01-27陈晓宇吴嘉颖阿提坎吾斯曼
谭 杨,陈晓宇,郭 文,吴嘉颖,阿提坎·吾斯曼,曹 慧
(上海理工大学 医疗器械与食品学院,上海 200093)
抗冻蛋白(antifreeze proteins,AFPs)亦可称作冰结合蛋白(Ice binding proteins,IBPs)、冰结构蛋白(ice structuring proteins,ISPs)[1],是一类具有提高生物抗冻能力的蛋白质类化合物的总称,不仅能够降低生物体液的冰点,抑制冰晶的形成,还能改变冰晶的生长规律,抑制重结晶[2],因此其在动植物组织以及细胞低温保存、食物的贮藏等方面具有良好的市场前景[3-5]。到目前为止,国内外研究人员已经从植物、鱼类、陆地昆虫、细菌等各类生物体中分离出多种抗冻蛋白[6-9]。由于较低的产率及较高的成本,科研工作者仍然试图从各种资源中寻找新的AFP分子,筛选活性更强的组分。我国是畜禽生产和消费大国,由于加工技术的落后,产生了大量下脚料,研究发现,畜禽下脚料富含的胶原蛋白中具有高活性的抗冻组分[10],可能成为AFP的主要来源之一。目前,常采用多种色谱联用技术对AFP进行不同程度的筛选,该筛选过程繁琐耗时,难以实现快速、高效筛选目的。近年来,随着对AFP功能性质研究的日益重视,已见一些利用冰晶吸附AFP的研究报道,如Kuiper等[11]通过“cold finger”吸附的冰晶分离AFP。与传统的分离方法相比冰晶特异性亲和吸附法有明显优势。不足的是,该法对抗冻组分的吸附量小,产量很低。基于此,本研究以高寒地区的牦牛骨为原料制备酶解胶原蛋白,并采用改良的可大面积吸附抗冻组分的冰亲和吸附法对其中的抗冻组分进行高效吸附,同时研究其抗冻性能。
1 材料与方法
1.1 材料与试剂
实验中的原料为新鲜的牛大骨,由上海申宏冷藏储运有限公司提供;重组抗冻蛋白,购自武汉华美生物工程有限公司;市售抗冻蛋白,购自上海聚鑫生物科技有限公司;胃蛋白酶(酶活力为37200 U/g)、羟脯氨酸标准品等其他试剂均为分析纯,购自国药试剂集团有限公司。
1.2 仪器与设备
HP-1100高效氨基酸分析仪,北京Agilent公司;J-715圆二色谱仪,上海Jasco公司;UV-6000 PC型紫外可见分光光度计,上海元析仪器有限公司;J-20XP型冷冻离心机,上海安亭科学仪器厂;LD85B3型真空冷冻干燥机,美国millrock科技公司。
1.3 方法
1.3.1 牛骨脱钙以及钙含量的测定
选取10倍体积的0.25M EDTA·2Na作为脱钙液对粉碎后的牛骨粉进行脱钙,每8 h更换一次脱钙液。钙含量测定依据《GB 5009.92—2016 食品安全国家标准 食品中钙的测定》。
1.3.2 牛骨胶原的制备及提取率测定
脱钙结束后过滤去掉脱钙液,加入10倍体积0.5M醋酸溶液浸泡12 h;在醋酸浸泡后的骨粉溶液中加入质量分数为1%的胃蛋白酶酶解48 h,离心沉淀,收集上清液;将上清液蒸发浓缩冻干,保存备用。
依据《GBT 9695.23—2008肉与肉制品 羟脯氨酸含量测定》测定胶原蛋白含量。胶原蛋白提取率为提取获得胶原蛋白总质量与牛骨原料中胶原蛋白的总质量之比。具体换算公式为

式中:A为羟脯氨酸的百分含量;M1为羟脯氨酸的质量,ug;M2为样品质量,mg;B为胶原蛋白提取率。
1.3.3 胶原抗冻肽的制备
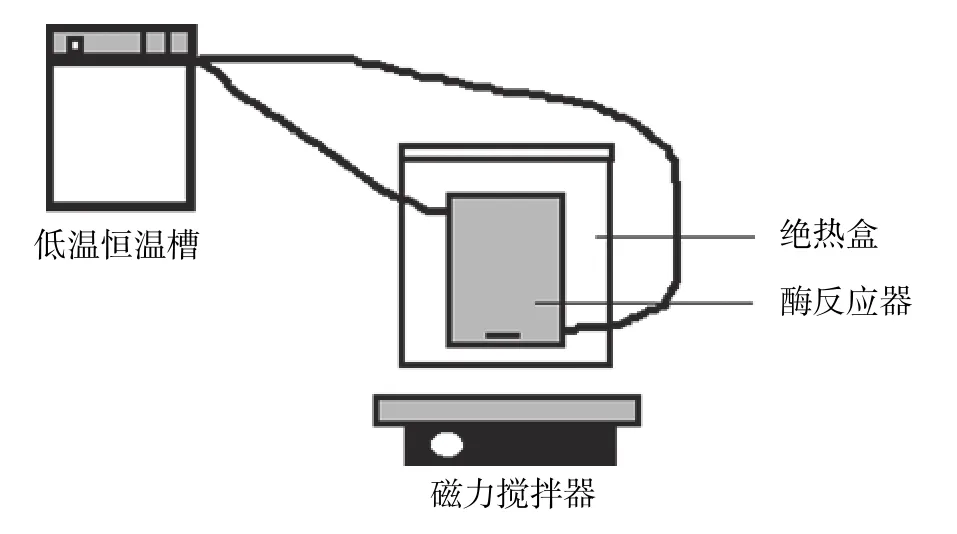
图1 冰亲和吸附装置Fig. 1 Ice affinity adsorption device
在Knight等[12],Zhang等[13]及阮功成等[14]的研究基础上,搭建了由低温恒温槽、磁力搅拌器、酶反应器及绝热盒组成的冰亲和吸附装置,如图1所示。具体吸附流程如下:先取一定量的纯净水倒入酶反应器中,用低温恒温槽将温度降到−4 ℃并恒温20 min,预先在酶反应器内壁获得2~4 mm厚的冰层,倒出酶反应器中多余的水,将冰层在−4 ℃恒温2 h。再将已降温到0 ℃的酶解液倒入内壁制备好冰层的酶反应器中,开启磁力搅拌器在相应温度下吸附一定时间。吸附完毕后,倒出吸附后的液体,然后将恒温槽升温至2 ℃,使酶反应器内壁上含有抗冻肽的冰晶充分溶解得到多肽溶液。在此基础上,考察了吸附时间(2,4,6,8 h)、吸附温度(−3,−2.5,−2,−1 ℃)和吸附浓度(1,2,3,4 mg/mL)对热滞活性值的影响。
1.3.4 热滞活性的测定
称取约10 mg多肽溶液于铝皿内,并置于DSC仪器内。当仪器充满液氮并稳定后,首先以10 ℃/min的速率降温至−30 ℃保持10 min,再升温至10 ℃保持 5 min,获得样品溶液的熔融热△Hm和熔点Tm。再以10 ℃/min将样品降温至−20 ℃保持5 min;然后以5 ℃/min升温至样品呈固液共存状态,即到达其保留温度Th,保持5 min;再将温度以1 ℃/min的速率从Th降至 −20 ℃。重复上述升降温程序,在不同的Th下保持5 min,分别记录样品的起始结晶温度T0以及结晶热△Hr[15],并分别按照式(1)计算热滞活性THA值。

1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
采用SDS-PAGE电泳方法鉴定提取的牛骨胶原的纯度,电泳条件如下:
分离胶质量分数为15%;浓缩胶质量分数为5%;电极缓冲液1 L:3 g Tris,14.4 g甘氨酸,1 g SDS,加蒸馏水至1 L;样品缓冲液10 mL:0.6 mL 1 mol/L Tris-HCl(pH 值6.8),5 mL 质量分数50%甘油,2 mL质量分数 10%的SDS,0.5 mL β-巯基乙醇,1 mL质量分数1%的溴酚蓝,0.9 mL双蒸水;固定液:质量分数20%的三氯乙酸;染色液:质量分数为0.25%的考马斯亮蓝R-250溶液;脱色液:75 mL冰醋酸+50 mL甲醇+875 mL蒸馏水混合;直流稳压电源:电流10 mA;电泳时间3 h。
将maker和提取的牛骨胶原蛋白配制成1 mg/mL的溶液,置于沸水浴中煮沸 3 min,10000 r/min 离心1 min,取上清液待上样,上样量为10 μL。在120 V电压下电泳完毕之后,用0.1%的考马斯亮蓝R-250溶液染色过夜,加水脱色至背景没有颜色后拍照。
1.3.6 原子力显微分析
将40 μg/mL的5 μL的胶原溶液吸移到新剥离的云母板的中心,让液滴自然铺平,放入干燥器中自然凉干30 min 以上。将制备好的云母板置于样品台上进行原子力显微镜观察[16],测试参数为:针尖为125 μL蚀刻硅,弹性常数20-80 Nm−1,扫描头为A型,谐振频率范围200~400 Hz,成像模式为轻敲模式(tapping mode),所有图像经过自动平滑处理以消除慢扫描导致的低频噪音。
1.3.7 氨基酸组成分析
将约200 mg左右胶原样品称入水解管中,加入6 mol/L HCL,抽真空并封口,并在110 ℃下水解24 h。将水解后的样品转移定容后过滤,取滤液在加NaOH的真空干燥器中蒸干,再加盐酸复溶后,取样上机测定。色谱条件:4.0×125 mm C18柱;柱温40 ℃;流速1.0 mL/min;检测波长338 nm,262 nm(Hypro);流动相A为20 mmol醋酸钠液,流动相B为20 mmol醋酸钠液∶甲醇∶乙腈 =1∶2∶2。
1.4 数据处理
每组数据至少重复3次,实验结果用Excel及Origin处理作图。
2 结果与分析
2.1 脱钙工艺的优化
2.1.1 脱钙剂浓度对脱钙率以及胶原蛋白提取率的影响
牛骨中无机矿物质含量高达53%,这些钙质紧紧附着于骨胶原之上,若不进行脱钙处理,牛骨难以被蛋白酶酶解,导致胶原蛋白溶出率低[17-18]。因而本研究考察了EDTA·2Na浓度(0.05,0.15,0.25 ,0.35 mol/L)对牛骨脱钙率及胶原蛋白提取率的影响,脱钙时间为48 h。由图2可见,随着脱钙剂浓度的升高,脱钙率逐渐增加。当脱钙剂浓度为0.25 mol/L时,脱钙率可以达到91.88%;当脱钙剂浓度达到0.15 mol/L以上时,胶原蛋白的提取率达到比较稳定的状态。
采用原子力显微镜对不同浓度脱钙剂脱钙后的牛骨胶原蛋白的微观结构进行观察,结果如图3所示。其中,图3(a)、(c)、(e)为胶原微观结构平面图,图3(b)、(d)、(f)为胶原微观结构三维图。可以看出,经0.15 mol/L的脱钙剂脱钙后,牛骨中胶原结构与其他两组明显不同,这可能是由于低浓度的脱钙剂无法完全去除骨中的钙质,牛骨中钙质与蛋白紧密结合,在原子力测定过程中胶原蛋白难以聚集。因此在原子力显微镜结果中只能看到较小的聚集体。经0.25 mol/L和0.35 mol/L的脱钙剂脱钙后,在原子力图谱中明显看到较大的聚集体,这可能是由于较高浓度的脱钙剂使胶原蛋白从骨中完全游离出来,当采用原子力显微镜观察时,多肽链上疏水氨基酸残基的疏水作用占优势,分子内和分子间的氢键作用增强,分子聚集成球形,从而形成较大的聚集体[16]。
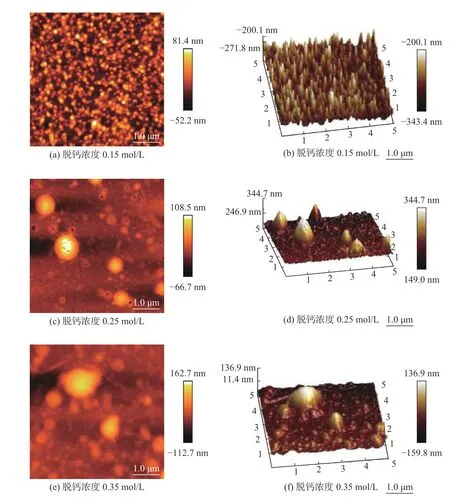
图3 脱钙剂浓度对胶原蛋白的影响Fig.3 Effect of decalcification agent concentration on collagen
2.1.2 脱钙时间对脱钙率和提取率的影响
进一步考察不同脱钙时间(24 ,48,72 h)对骨料脱钙率及胶原蛋白的提取率的影响,EDTA·2Na浓度初始设为0.15 mol/L。结果如图4所示。由图可见,随着脱钙时间的增加,脱钙率也随之增加,当脱钙时间为72 h时,脱钙率达到最大,为87.10%。但随着脱钙时间的进一步增加,胶原的提取率反而下降,在脱钙时间为72 h时,胶原蛋白的提取率仅为13.54%,这可能是因为长时间的脱钙可能导致骨料中的胶原蛋白发生流失,并随脱钙液一起被过滤除去。
采用AFM比较了不同脱钙时间的胶原蛋白的微观结构,见图5。其中图5(a)、(c)、(e)为胶原微观结构平面图,图5(b)、(d)、(f)为胶原微观结构三维图。可以看出,脱钙24 h后获得的胶原蛋白只能看到细丝状的胶原纤维,没有形成明显的聚集体;而脱钙48 h和72 h后,胶原蛋白能很好地自组装成高度均匀有序的聚集体。综合考虑脱钙率和胶原蛋白提取率,脱钙时间选为48 h。
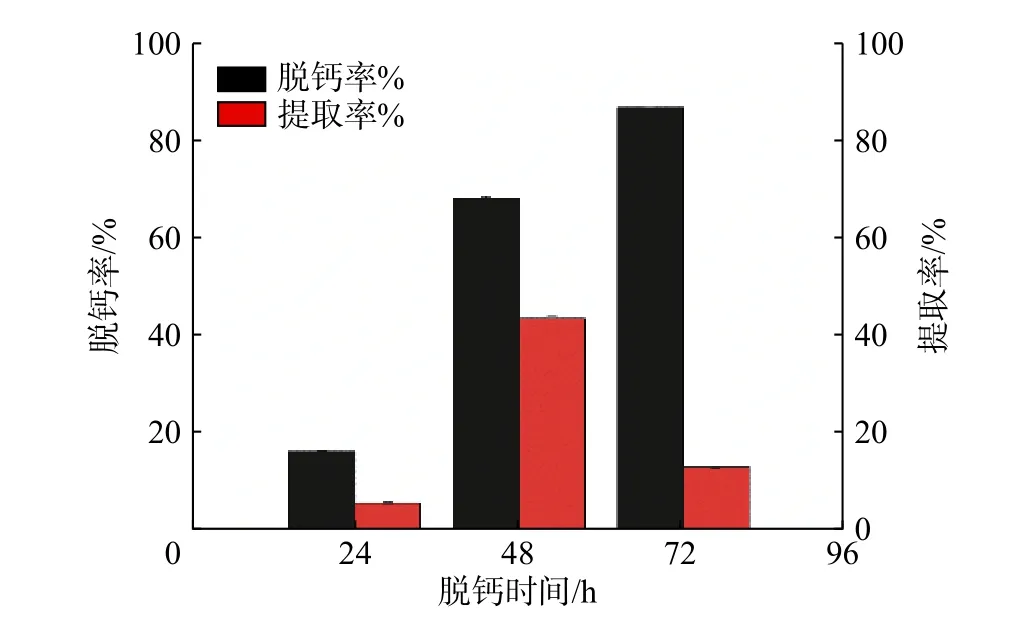
图4 脱钙时间对脱钙率的影响Fig. 4 Effect of decalcification time on decalcification rate and extraction efficiency
2.2 酶水解胶原蛋白的制备

图5 脱钙时间对胶原蛋白的影响Fig.5 Effect of decalcification time on collagen
采用胃蛋白酶对脱钙后的物料进行处理,考察酶解温度(10,20,25,37 ℃)和时间(10,24,48,72 h)对胶原蛋白提取率的影响,其结果如图6所示,底物质量分数为10%。由图6可见,在酶解温度为25 ℃时,胶原蛋白的提取率最高,达到48.53%。随着酶解时间的增加,胶原蛋白的提取率增加,在酶解72 h后,胶原蛋白的提取率可以达到58.38%。这是因为长时间的酶解使牛骨中的胶原蛋白充分释放。但考虑到长时间的酶解可能会使胶原蛋白酶解过度从而产生较多的短肽链,因此本研究选择酶解时间为48 h。
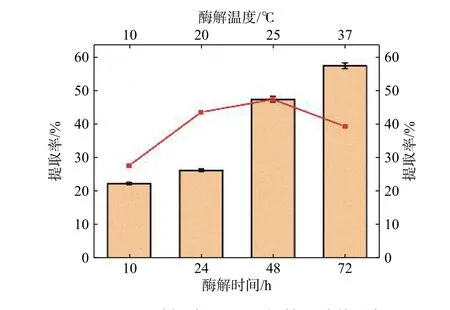
图6 不同酶解时间以及温度对提取率的影响Fig. 6 Effect of enzymolysis time and temperatures on extraction efficiency
2.3 SDS-PAGE电泳
采用SDS-PAGE 法鉴定胶原蛋白的分子量及纯度,结果如图7所示,SDS-PAGE 图谱上出现了α1,α2,β及γ4个条带,其对应的分子量分别约为90,100,110,200 kDa,这是典型的I型胶原蛋白SDS-PAGE图谱。其中,在分子量约100 kDa附近出现了3个条带,它们分别为胶原蛋白的α1,α2链,和α链的二聚体,即β-链;在高于200 KDa出现的条带是α链的三聚体,即γ-链。图谱上杂带较少,说明采用胃蛋白酶法制备的胶原蛋白中小分子多肽较少,可见所获得牛骨胶原蛋白具有较高的纯度。
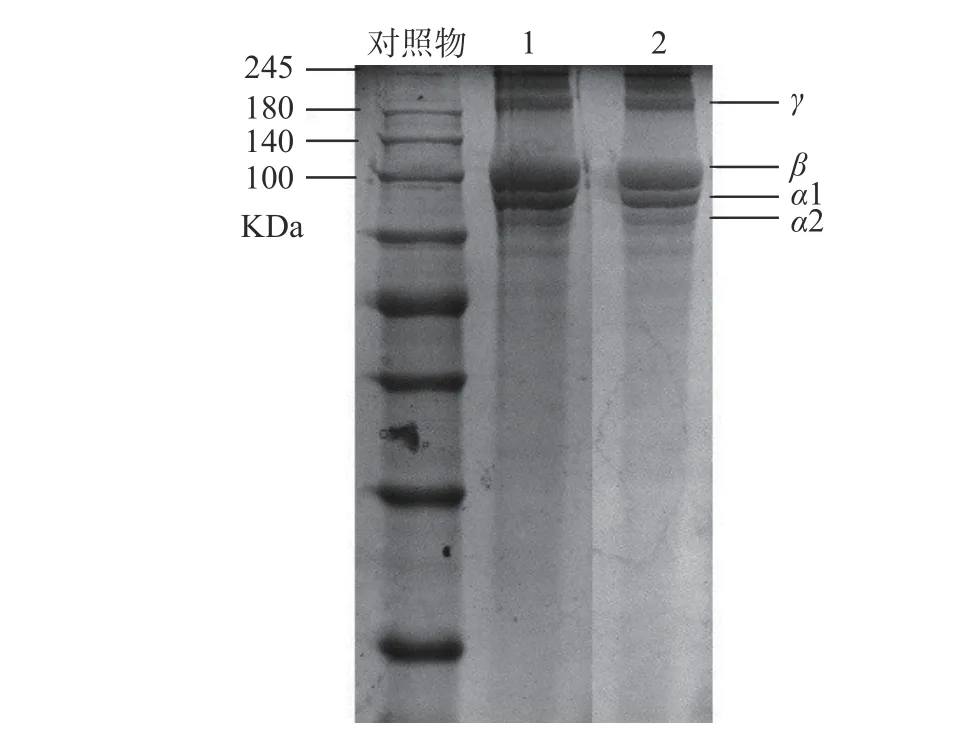
图7 胶原蛋白SDS-PAGE 电泳图(line1,line2重复)Fig. 7 SDS-PAGE electrophoresis of collagen before and after salting out
2.4 胶原酶解复合物的氨基酸组成
由表1可见,采用胃蛋白酶法制备的胶原酶解复合物的氨基酸组成中,Gly,Glu和Pro含量较高,其中每1000个氨基酸残基中Gly残基数为300,Glu和Pro残基数分别为88和146;His、Tyr和Met含量较低;牛骨胶原蛋白中富含Pro、Gly和Hyp,这与胶原三股螺旋区由连续的Gly-X-Y重复序列组成相一致,其中X、Y是除Gly外的其他氨基酸残基,X为Pro,Y为Hyp或羟赖氨酸。该结构与雪蚤抗冻蛋白[19]的活性结构域相似,因此以胶原蛋白为原料制备抗冻多肽具有可行性。
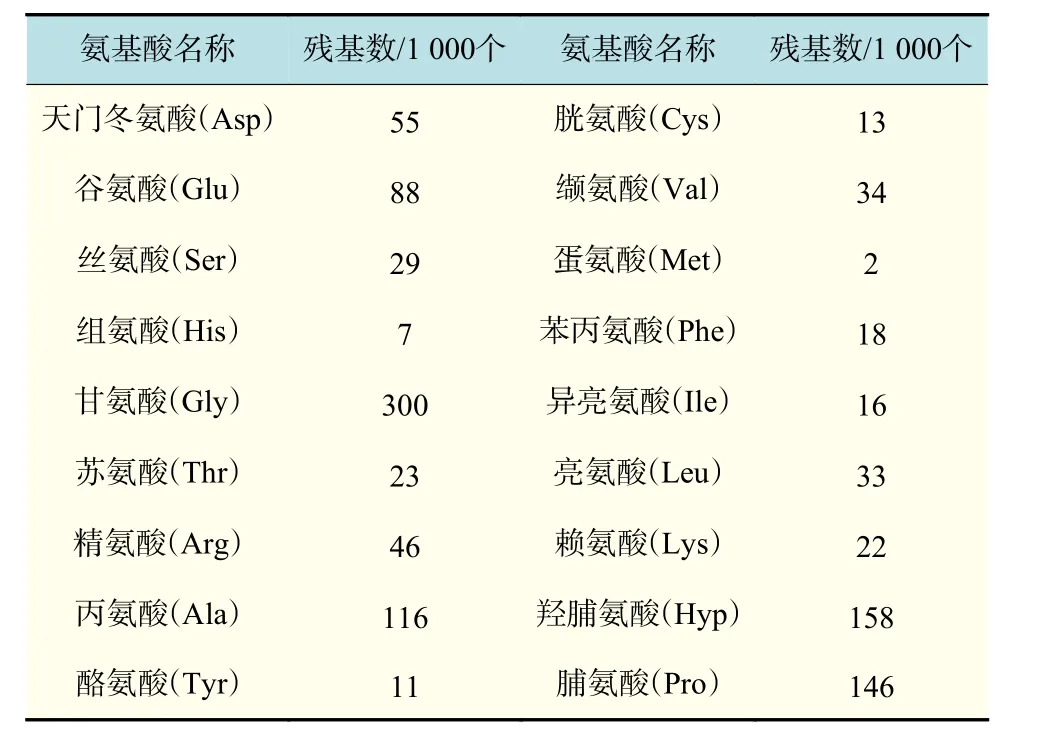
表1 胶原酶解复合物的氨基酸组成Tab.1 Amino acid composition of collagen
2.5 不同冰亲和吸附条件下胶原抗冻肽的热滞活性分析
利用抗冻蛋白能特异吸附于冰晶表面的原理,在前人研究基础上,搭建了可增大吸附面积的冰亲和吸附装置(图1),并应用于酶解复合物中胶原抗冻肽的吸附。采用DSC法考察了不同吸附时间(2,4,6,8 h)、吸附温度(−3,−2.5,−2,−1 ℃)以 及 吸 附 浓 度(1,2,3,4 mg/ml)对THA值的影响,结果如表2,图7~9所示。
本研究首先对冰亲和吸附的时间进行了优化,结果如表2和图8所示。在吸附4 h后蛋白得率达到最大,为49.30%。随着吸附时间的增加,蛋白得率反而降低,这可能是由于过长的吸附时间导致冰晶表层吸附了大量杂质,过长的吸附时间也导致抗冻肽的热滞活性降低,在吸附时间为4 h时,获得的胶原抗冻肽的热滞活性值最大,为4.77 ℃,因此选择其为最适吸附时间。
冰晶对胶原抗冻肽的吸附,不仅受吸附时间影响,还与吸附温度有关。若吸附温度过低会使得冰晶迅速结冰,冰层形成时间较短,从而影响胶原抗冻肽与冰晶的特异性吸附。结合表2和图9可以发现,在−1 ℃时,所获得的胶原抗冻肽的热滞活性值最小,为0.57 ℃。这可能是由于当吸附温度较高时,水结冰的速度变慢,酶反应器内表面不能迅速形成新的吸附层。而此时酶反应器内壁事先制备好的冰层面已经全部被胶原抗冻肽所饱和,阻隔了水与冰层的接触,从而抑制了连续吸附的过程,导致所获得的胶原抗冻肽热滞活性降低。当温度达到−2 ℃时,热滞后活性值达到最大为5.76 ℃,因此选择其为最佳吸附温度。

表2 不同吸附条件对热滞活性(THA)以及蛋白得率的影响Tab.2 Effects of different adsorption conditions on thermal hysteresis activity and protein yield

图8 吸附时间对抗冻蛋白热滞活性的影响Fig. 8 Effect of adsorption time on thermal hysteresis activity of antifreeze proteins

图9 吸附温度对抗冻蛋白热滞活性的影响Fig. 9 Effect of adsorption temperature on thermal hysteresis activity of antifreeze proteins
在相同吸附温度及吸附时间下,考察了吸附浓度对胶原抗冻肽热滞活性的影响。结果发现,在吸附浓度为1 mg/mL时,蛋白得率较高,但热滞活性值较小,仅为3.05 ℃;在吸附浓度为3 mg/mL和4 mg/mL时,热滞活性值都较高,但蛋白得率有所降低;在吸附浓度为2 mg/ml时,蛋白得率和胶原抗冻肽的热滞活性值均较高。这可能是由于在较高浓度的酶解液中,大量抗冻肽迅速吸附到冰晶层表面,延缓了新冰层的形成,从而减少了杂蛋白的吸附,在降低蛋白得率的同时,提高了热滞活性。
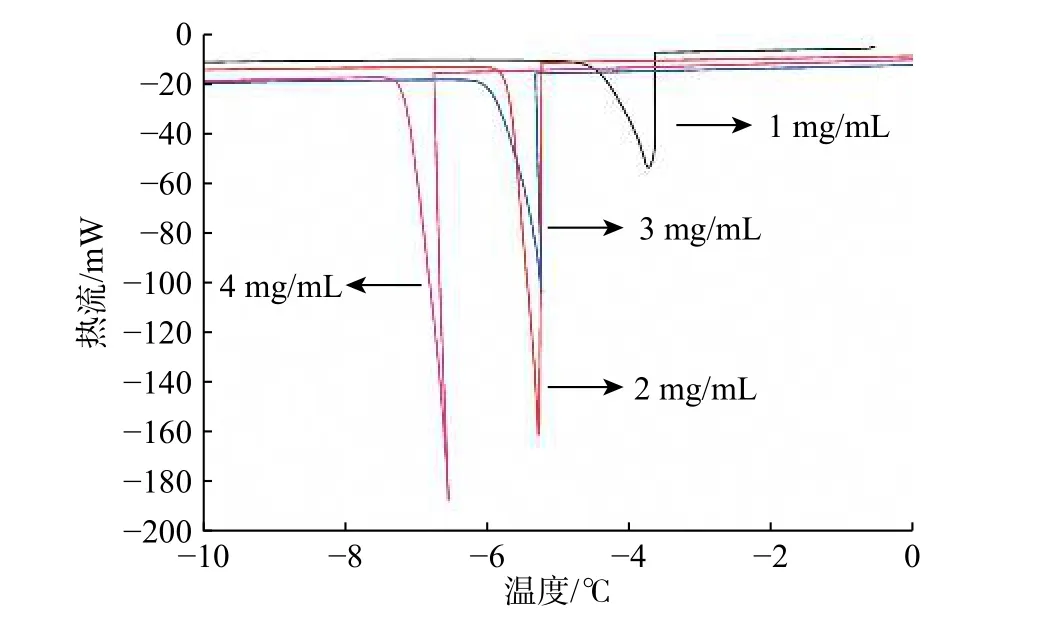
图10 吸附浓度对抗冻蛋白热滞活性的影响Fig. 10 Effect of adsorption concentration on thermal hysteresis activity of antifreeze proteins
结合以上结果可以得出冰亲和吸附装置的最佳吸附条件为:吸附时间4 h,吸附温度−2 ℃,吸附浓度2 mg/mL;此条件下的热滞活性值5.76 ℃,蛋白得率48.1%。根据热滞活性大小可将现有的抗冻蛋白分成两类,即低热滞活性抗冻蛋白和高热滞活性抗冻蛋白,低热滞活性抗冻蛋白的THA值一般在0.2~0.5 ℃之间,高热滞活性抗冻蛋白的THA值一般在0.5~4.1 ℃之间[20-23]。我们制备的牛骨抗冻肽THA值为5.76 ℃,表现出优秀的抗冻性能,将来可作为一种新型的生物抗冻剂。
3 结 论
以EDTA·2Na作为脱钙剂对牛骨进行脱钙,得到最佳脱钙工艺:脱钙时间为48 h,脱钙浓度为0.25 mol/L。在此条件下,脱钙率可达到87.10%,胶原蛋白提取率可达到43.99%。牛骨脱钙后用胃蛋白酶进行酶解制备牛骨胶原肽,在酶解时间为48 h,酶解温度为25 ℃时,胶原蛋白提取率可达48.53%。进一步考察了冰亲和吸附过程中,吸附时间、吸附温度以及吸附浓度对胶原肽THA值的影响。结果发现:最佳吸附时间为4 h,吸附温度为-2 ℃,吸附浓度为2 mg/ml。在此条件下,热滞活性值为5.76 ℃,蛋白得率为48.1%。牛骨胶原蛋白营养丰富且呈现出良好的抗冻性能,在食品工业上具有良好的市场前景。
