lncRNA TUG1和PCAT-1表达水平与多发性骨髓瘤预后的关系及其诊断价值分析*
2021-01-26贺冠强索晓慧刘洪峰
贺冠强,郭 敏,索晓慧,刘洪峰
河北省邯郸市中心医院血液内科一病区,河北邯郸 056001
多发性骨髓瘤(MM)是以骨髓浆细胞恶性增殖为特点的浆细胞恶性肿瘤,在血液系统恶性肿瘤中排名第二,约占10%[1]。MM在西方国家的发病率约为6.5/10万,以老年人群为主,我国MM的发病率低于西方国家,约为1.0/10万[2]。虽然近年来MM的治疗方法从传统的化疗发展到靶向药物治疗,但MM患者的生存率仍然较低,5年生存率为46.6%[3-4]。因此,寻找合适的生物标志物早期发现MM,对改善患者预后具有十分重要的临床意义。长链非编码RNA(lncRNA)是一类新发现的长度大于200个核苷酸的片段,并不参与编码蛋白质,但是研究发现其可通过转录调控基因的表达,参与机体的各种生理活动,也参与了肿瘤的发生、发展过程,并与肿瘤患者的预后密切相关[5-6]。已有研究显示,lncRNA在多种肿瘤患者的血清中稳定高表达,并与肿瘤患者的预后有关[7],且多种lncRNA与MM的发病密切相关[8]。lncRNA牛磺酸上调基因1(TUG1)和lncRNA前列腺癌相关转录产物1(PCAT-1)近年来被发现参与了多种肿瘤包括MM的病理生理过程[9-10],但是否与MM患者的预后有关尚不明确。因此,本研究通过检测MM患者血清lncRNA TUG1和PCAT-1的表达水平,探讨lncRNA TUG1和PCAT-1在MM中的作用,并分析其对MM预后的影响,现报道如下。
1 资料与方法
1.1一般资料 选取2013年1月至2016年11月于本院住院治疗的MM患者90例作为MM组,患者均符合《血液病诊断及疗效标准》[11]中MM的诊断标准,其中男51例,女39例;年龄41~78岁,平均(60.14±18.74)岁;按照美国血液病学会国际分期系统(ISS)[12]分为Ⅰ~Ⅱ期50例,Ⅲ期40例;按照M蛋白类型分为IgG型35例,IgD型32例,IgA型18例,轻链型 5例。纳入标准:(1)符合MM的诊断标准;(2)病历资料完整,患者入院时均进行血液生化、血常规、M蛋白类型鉴定等检查;(3)年龄≤80岁;(4)均行VCD(硼替佐米+环磷酰胺+地塞米松)方案治疗。排除标准:(1)病历资料缺乏患者;(2)合并其他肿瘤的患者;(3)入院前已经接受相关治疗的患者;(4)精神疾病患者。选取同期本院体检中心健康体检者90例作为对照组,其中男49例,女41例;年龄41~76岁,平均(61.46±15.53)岁。MM组和对照组研究对象的性别和年龄比较,差异无统计学意义(P>0.05),具有可比性。本院伦理委员会已批准本研究。所有研究对象均知情同意,并签署知情同意书。
1.2方法
1.2.1血液标本采集 MM组患者于入院当日清晨空腹采集静脉血5 mL,对照组于体检当日清晨空腹采集静脉血5 mL。室温放置30 min,高速离心机提前预冷至4 ℃,将凝血后的血液在离心机中以3 000 r/min离心10 min,离心完毕后将血清转移至新的离心管中做好编号标识,放于-80 ℃超低温冰箱中保存。
1.2.2实时荧光定量PCR检测血清lncRNA TUG1和PCAT-1的表达水平 使用TRIzol试剂(美国Ambion公司)提取血清中的总RNA,测量RNA水平和纯度,随后使用Takara反转录试剂盒将RNA反转录成cDNA,按照Takara实时荧光定量PCR试剂盒说明书进行实时荧光定量PCR,反应体系(10.0 μL):cDNA 0.2 μL,正向引物(10.0 μmo/L) 0.5 μL,反向引物(10.0 μmo/L) 0.5 μL,ROXⅡ(50×) 0.2 μL,SYBR (2×) 5.0 μL,RNase free water 3.6 μL。实时荧光定量PCR反应条件:预变性95 ℃,5 min;重复循环(40次)94 ℃,30 s→55 ℃,30 s→72 ℃,30 s;溶解曲线72 ℃,1 min。lncRNA TUG1正向引物:5′-AATGGCATGAACCTGGGAGGCG-3′;反向引物:5′-GGCTTTGGGAAGTGCTTTGGAG-3′;lncRNA PCAT-1正向引物:5′-GAGAGCTGACATAGGCACCC-3′;反向引物:5′-TCTC CACTGGTGTTCATGGC-3′;GAPDH正向引物:5′-TGATGACATCAAGAAGGTGGTG AAG-3′;反向引物:5′-TCCTT GGAGGCCATGTGGGCCAT-3′。
1.2.3临床资料收集 收集MM患者性别、年龄、ISS分期、M蛋白类型,以及β2微球蛋白、C反应蛋白水平等资料。根据MM患者lncRNA TUG1和PCAT-1表达水平的平均数,将MM组患者分为lncRNA TUG1高表达组(41例)、lncRNA TUG1低表达组(49例),以及lncRNA PCAT-1高表达组(37例)、lncRNA PCAT-1低表达组(53例)。根据MM患者的临床病理特征,本研究将年龄分为<65岁和≥65岁,β2微球蛋白分为<3.5 μg/mL和≥3.5 μg/mL,C反应蛋白分为<5.8 mg/L和≥5.8 mg/L,血红蛋白分为<110 g/L和≥110 g/L,清蛋白分为<35 g/L和≥35 g/L,乳酸脱氢酶分为<170 U/L和≥170 U/L,Ca2+分为<10 mg/dL和≥10 mg/dL,按此分组进行研究。
1.2.4随访 MM患者出院后每半年进行1次随访,随访时间为3年,随访截止日期为2019年12月30日,采用电话随访或者上门随访,记录患者的存活情况。
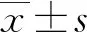
2 结 果
2.1两组血清lncRNA TUG1和PCAT-1的表达水平比较 MM组患者的血清lncRNA TUG1和PCAT-1表达水平高于对照组,差异均有统计学意义(P<0.05)。见表1。
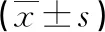
表1 两组血清TUG1和PCAT-1的表达水平比较
2.2MM患者lncRNA TUG1和PCAT-1的表达水平与临床病理特征的关系 lncRNA TUG1高表达组和lncRNA TUG1低表达组的年龄、β2微球蛋白和Ca2+水平比较,差异有统计学意义(P<0.05),两组在性别、ISS分期、M蛋白类型,以及C反应蛋白、血红蛋白、清蛋白、乳酸脱氢酶水平方面比较,差异无统计学意义(P>0.05);lncRNA PCAT-1高表达组和lncRNA PCAT-1低表达组的年龄、β2微球蛋白和Ca2+水平比较,差异有统计学意义(P<0.05),两组在性别、ISS分期、M蛋白类型,以及C反应蛋白、血红蛋白、清蛋白和乳酸脱氢酶水平方面比较,差异无统计学意义(P>0.05)。见表2。
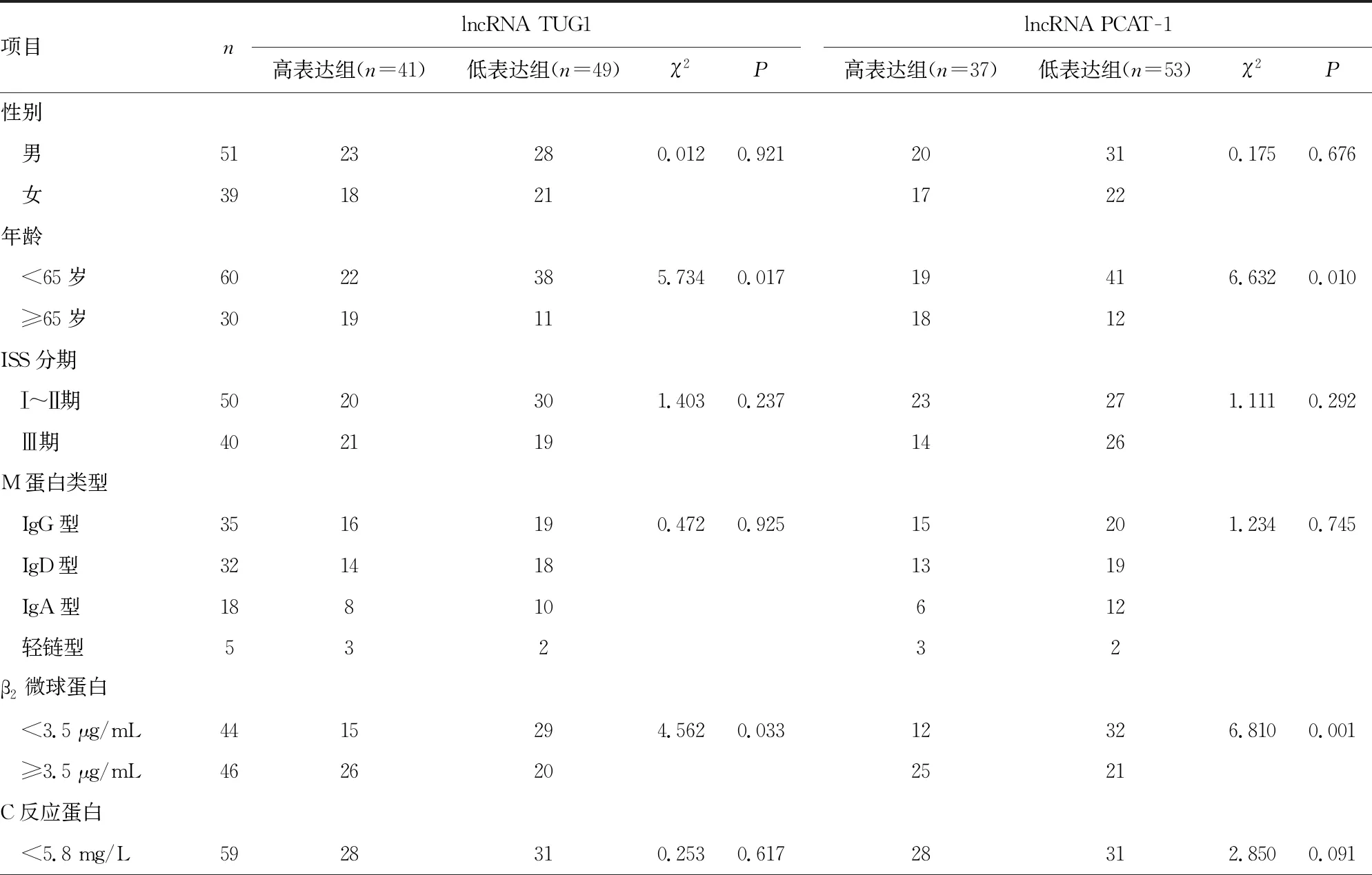
表2 MM患者lncRNA TUG1和PCAT-1的表达情况与临床病理特征的关系
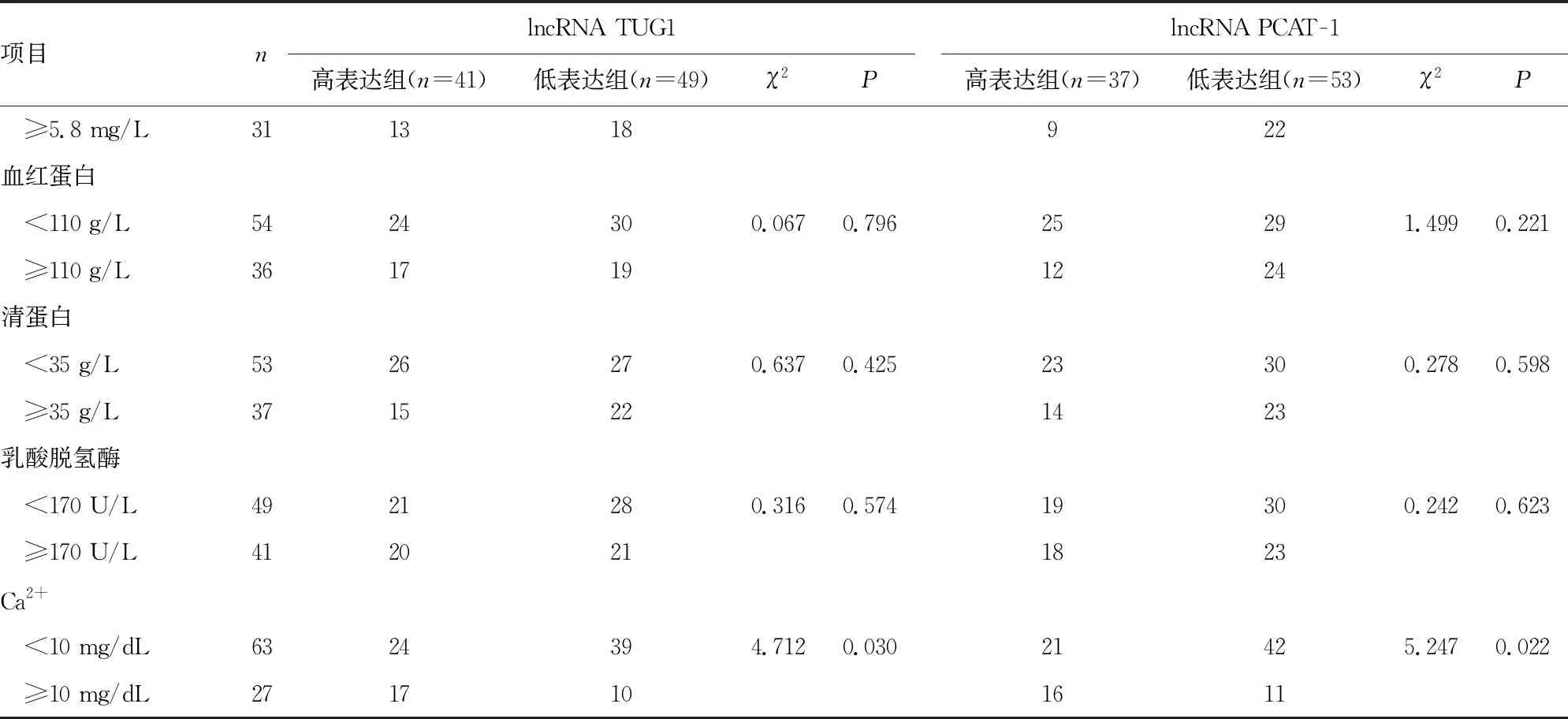
续表2 MM患者lncRNA TUG1和PCAT-1的表达情况与临床病理特征的关系
2.3lncRNA TUG1和PCAT-1的表达水平与MM患者预后的关系 随访3年,随访过程中未出现失访患者,生存人数为54例,生存率为60.00%,其中lncRNA TUG1高表达组的生存人数为18例,生存率为43.90%(18/41),明显低于lncRNA TUG1低表达组的73.47%(36/49),差异有统计学意义(χ2=8.131,P=0.004);lncRNA PCAT-1高表达组的生存人数为17例,生存率为45.95%(17/37),明显低于PCAT-1低表达组的69.81%(37/53),差异有统计学意义(χ2=5.171,P=0.023)。
以因变量为MM患者3年中的生存情况(存活:0;死亡:1),自变量见表3,单因素COX风险回归模型分析结果显示:年龄、Ca2+、β2微球蛋白、lncRNA TUG1、PCAT-1表达水平与MM患者预后有关(P<0.05)。建立多因素COX风险回归模型,因变量同上,将单因素分析中的年龄、Ca2+、β2微球蛋白、lncRNA TUG1、PCAT-1表达水平纳入多因素COX风险回归模型,将连续型变量进行分层,转变成二分类变量,分别进行赋值(年龄≥65岁=1,<65岁=0;β2微球蛋白≥3.5 μg/mL=1,<3.5 μg/mL=0;Ca2+≥10 mg/dL=1,<10 mg/dL=0;lncRNA TUG1和PCAT-1高表达=1,低表达=0),使用后退法进行自变量的选择(P<0.05)和剔除(P>0.10)。结果显示,年龄较大、β2微球蛋白水平较高、lncRNA TUG1高表达和 PCAT-1高表达是影响MM患者预后的危险因素(P<0.05),见表3。
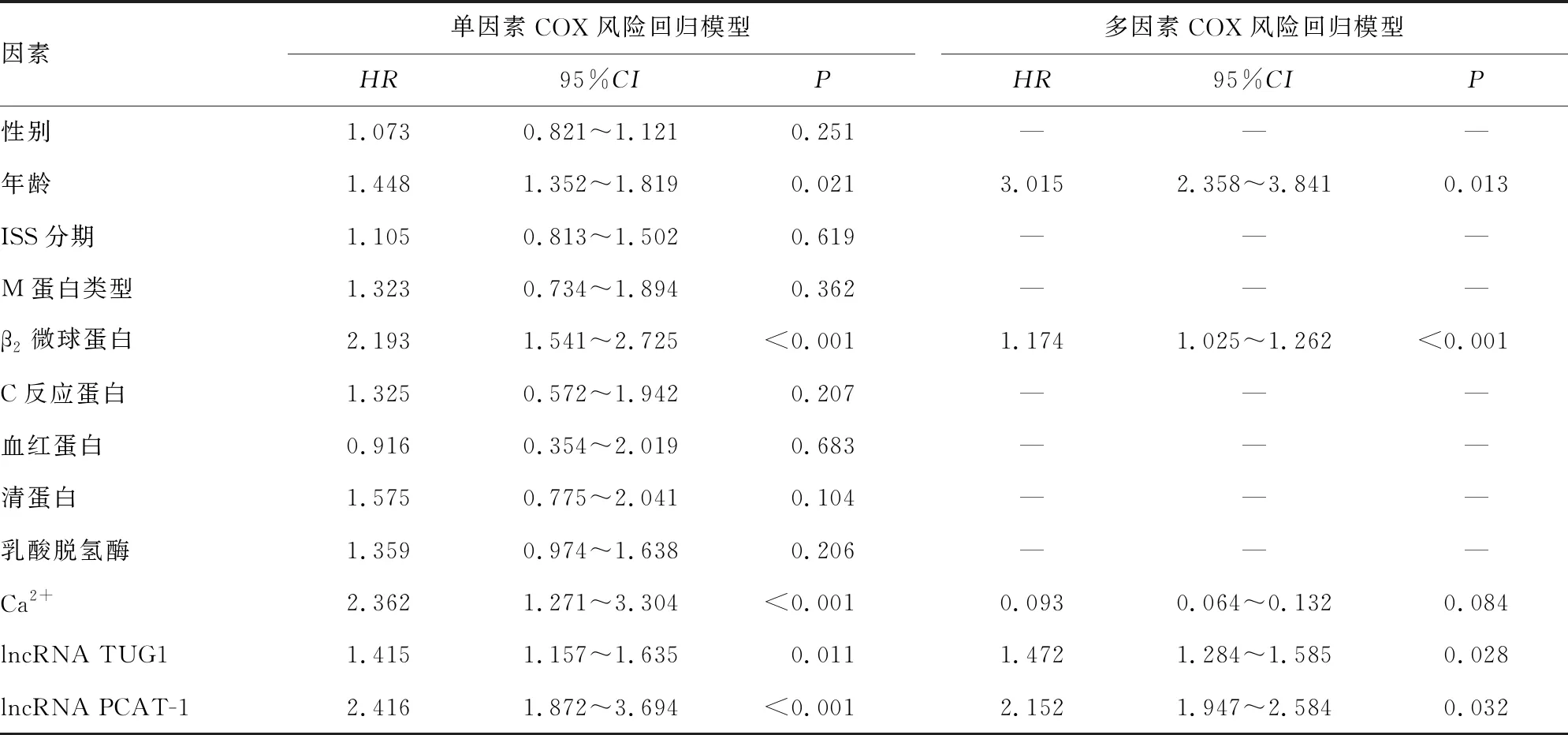
表3 MM患者预后影响因素的COX风险回归模型
2.4lncRNA TUG1和PCAT-1对MM患者的诊断价值 采用ROC曲线分析lncRNA TUG1和PCAT-1对MM患者的诊断价值,如图1所示,血清lncRNA TUG1曲线下面积为0.777(95%CI:0.704~0.850),最佳临界值为1.88,灵敏度和特异度分别为81.11%和77.78%;血清lncRNA PCAT-1曲线下面积为0.648(95%CI:0.566~0.729),最佳临界值为2.92,灵敏度和特异度分别为61.11%和67.78%。
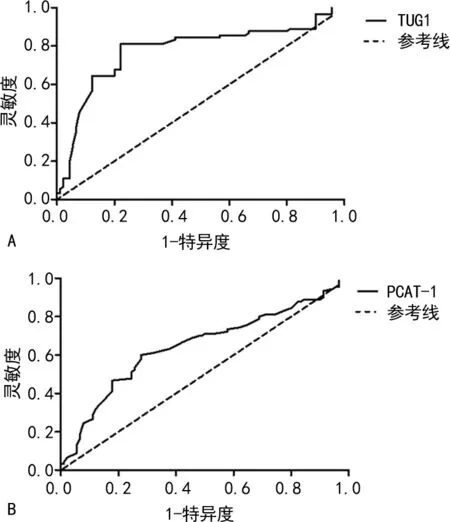
注:A为TUG1;B为PCAT-1。
3 讨 论
MM是血液系统常见的一种恶性肿瘤,目前无法完全治愈,由于其发病隐匿,大多数患者因为感染、肾功能不全或出现骨痛等症状前来就诊,容易误诊,错过最佳治疗时机,严重影响MM患者的生活质量和预后[13]。此外,MM异质性较明显,且患者病情进展程度差异较大,一些具有高危因素的MM患者生存率更低[14]。因此,准确识别这部分患者,对MM患者的个体化治疗和预后具有十分重要的临床意义。lncRNA在机体中发挥了重要的调节功能,有研究显示lncRNA参与了肿瘤的病理生理过程,可以作为肿瘤的预测因子[7]。本研究发现,MM组患者血清lncRNA TUG1和PCAT-1表达水平高于对照组,提示TUG1和PCAT-1可能参与了MM的病理生理过程。
lncRNA TUG1是一个长约7.1 kb的RNA片段,最初发现其主要在视网膜和脑组织中表达,随着研究的深入,发现它在肿瘤发生过程中表达异常[10]。ISIN等[15]研究了5种不同的lncRNA,发现只有lncRNA TUG1表达水平在MM患者中明显高于健康对照者,与本研究结果一致,表明血清lncRNA TUG1异常表达可能与MM的发生、发展有关,提示lncRNA TUG1可能是诊断MM的一种重要的生物标志物。本研究中的ROC曲线分析发现,血清lncRNA TUG1曲线下面积为0.777(95%CI:0.704~0.850),最佳临界值为1.88,灵敏度和特异度分别为81.11%和77.78%,表明血清lncRNA TUG1在诊断MM时具有较高的价值,可以用来辅助诊断MM。一项研究显示,lncRNA TUG1能与多梳蛋白抑制复合体2结合形成复合物,该复合物可以集中到抑癌基因的启动子区,促进肿瘤的发生、发展和转移[16],此外lncRNA TUG1还可以通过调控Wnt/β-catenin、转化生长因子-β(TGF-β)和Notch等多条信号通路促进肿瘤的发生、发展[17-20],但具体机制有待进一步研究。然而,lncRNA TUG1的表达水平与患者临床病理特征之间的关系仍不明确,本研究发现MM患者血清lncRNA TUG1的表达水平与患者的年龄、β2微球蛋白、Ca2+水平相关,提示高龄、血清β2微球蛋白及Ca2+水平较高的患者容易出现lncRNA TUG1高表达。本研究进一步分析了不同血清lncRNA TUG1表达水平患者的预后情况,发现lncRNA TUG1高表达组3年生存率显著低于lncRNA TUG1低表达组,并且多因素COX风险回归模型分析结果显示,lncRNA TUG1高表达是影响MM患者预后的危险因素,提示lncRNA TUG1高表达的患者预后较差,在治疗过程中应当优化lncRNA TUG1高表达MM患者的治疗方案,改善其预后。
lncRNA PCAT-1已经被证实是前列腺癌的致癌因子,可以诱导肿瘤细胞的增殖并影响化疗的敏感性,在多种肿瘤组织中表达明显增加[20-21]。本研究显示,MM组lncRNA PCAT-1表达水平明显高于对照组,表明血清lncRNA PCAT-1异常表达可能与MM的发生、发展有关,提示lncRNA PCAT-1可能也是诊断MM的一种重要的生物标志物。ROC曲线分析发现,血清lncRNA PCAT-1曲线下面积为0.648(95%CI:0.566~0.729),最佳临界值为2.92,灵敏度和特异度分别为61.11%和67.78%,说明血清PCAT-1用来辅助诊断MM的价值较低,其灵敏度和特异度均低于lncRNA TUG1。有研究显示,lncRNA PCAT-1通过干扰PHLPP/FKBP51/IKKα复合物激活AKT和NF-κB信号通路促进前列腺癌的发展[22]。HUANG等[23]研究发现,lncRNA PCAT-1可以调控细胞周期,增加细胞周期蛋白的表达,通过外泌体途径促进食管鳞状细胞癌细胞增殖,但lncRNA PCAT-1是否通过上述途径促进MM的发生尚需进一步探讨。本研究还发现,血清PCAT-1的表达水平与患者的年龄、β2微球蛋白和Ca2+水平相关,提示高龄、高血清β2微球蛋白及高血清Ca2+水平患者容易出现lncRNA PCAT-1高表达。进一步分析不同血清lncRNA PCAT-1表达水平患者的预后情况,发现lncRNA PCAT-1高表达组3年生存率显著低于lncRNA PCAT-1低表达组,并且多因素COX风险回归模型分析结果显示,lncRNA PCAT-1高表达是影响MM患者预后的危险因素,提示PCAT-1高表达的患者预后较差,应当优化诊疗方案,改善患者的生存质量。
lncRNA TUG1和PCAT-1在MM患者中高表达,可以用来辅助诊断MM。lncRNA TUG1和PCAT-1高表达的患者预后较差,在诊疗过程中,应优化高表达患者的诊疗方案,改善患者预后。lncRNA TUG1和PCAT-1在MM患者中的作用机制有待进一步探讨。
