不同切片厚度免疫组化标记Ki-67对惰性淋巴瘤和侵袭性淋巴瘤鉴别诊断的影响
2021-01-23吉佳乐姚馨悦何志承
吉佳乐,曾 晖,徐 丹,张 宇,林 爽,姚馨悦,何志承
非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)是临床上最常见的淋巴系统恶性增殖性疾病,占整个淋巴瘤的90%以上,发病率和病死率位居恶性肿瘤前10位,且呈逐年增加的趋势[1]。目前临床上最常见的两种NHL分别是黏膜相关淋巴组织(mucosa associated lymphoid tissue, MALT)淋巴瘤和弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)。Ki-67作为反应细胞增殖的重要标志物,其增殖指数(proliferation index, PI)高低可用于淋巴瘤分级鉴别诊断和预后指导,且Ki-67 PI值越高,患者预后越差[2]。在病理诊断工作中,通常采用免疫组织化学(immunohistochemistry, IHC)方法对Ki-67表达进行检测,其结果判读的准确性和稳定性至关重要。ASCO/CAP指南指出处理手术病理标本时,常规HE切片厚度应在4~5 μm,但对IHC切片厚度并没有给出明确标准。因此,本文选取了2、4、6、8 μm 4种切片厚度,对石蜡切片厚度与IHC染色中惰性淋巴瘤和侵袭性淋巴瘤组织Ki-67表达的影响进行初步探讨。
1 材料与方法
1.1 标本来源收集陆军军医大学第一附属医院2016年4月~2019年4月收治的淋巴瘤标本46例,其中MALT淋巴瘤18例,年龄46~78岁;DLBCL 28例,年龄27~77岁;所有患者术前均未进行任何治疗。
1.2 主要试剂及仪器Ki-67、OptiView DAB IHC Detection Kit购自美国Ventana公司;BenchMark XT全自动免疫组化染色机购自美国Ventana公司。
1.3 IHC标本经固定脱水后制成蜡块,并分别以2、4、6、8 μm厚度连续切片,60 ℃烤片备用。将制备好的切片放入BenchMark XT中,并设定相应程序进行染色:75 ℃烤片4 min;EZ Prep溶液76 ℃脱蜡4 min;Cell Conditioning Solution(CC1)抗原修复液99 ℃修复30 min;抑制剂孵育45 min;加入Ki-67抗体60 μL,37 ℃孵育40 min;Reaction Buffer Concentrate(10×)缓冲液清洗5 min;37 ℃下二抗孵育8 min;DAB显色8 min,苏木精Ⅱ衬染12 min,返蓝液返蓝4 min。
1.4 IHC结果判定平均阳性染色面积百分比(average positive staining area percentage, APSAP),可反映相应病例染色结果中的阳性细胞表达情况。姜洋等[3]研究表明:APSAP法分析IHC结果与人工计数分析方法的符合程度较高,可以作为衡量图片中阳性细胞百分数的方法。细胞核出现棕黄色颗粒为Ki-67阳性细胞,同一病例不同切片厚度随机选取8个(200×)相同视野。用Image J软件对每个标本检测结果中的阳性信号进行定量分析,得到相应的APSAP,与临床判读的实际阳性信号比例相比,误差约5%。
1.5 统计学分析采用SPSS 22.0软件对Ki-67不同表达组的APSAP数据进行统计学分析。采用t检验和Two-way ANOVA分别对组内和组间进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
为减少统计误差,本实验根据Ki-67判读结果,将MALT淋巴瘤分为低表达组(0≤Ki-67阳性率<20%)、较低表达组(20%≤Ki-67阳性率<40%);将DLBCL分为中表达组(40%≤Ki-67阳性率<60%)、较高表达组(60%≤Ki-67阳性率<80%)、高表达组(Ki-67阳性率≥80%)。
2.1 切片厚度对染色强度的影响与2 μm厚度切片相比,4、6、8 μm厚度切片非特异性染色逐渐增多;6、8 μm厚度切片的组织结构与2、4 μm厚度切片相比出现一定程度组织脱落的现象(图1~3)。切片厚度与MALT淋巴瘤和DLBCL中Ki-67表达呈正相关,随着切片厚度的增加,病灶细胞核染色逐渐加深;当切片厚度在4 μm(±1 μm)时,组织结构相对完整,背景较为干净,更利于细胞计数。

①A①B①C①D②A②B②C②D③A③B③C③D
2.2 切片厚度对APSAP的影响Ki-67低、较低、中、较高及高表达组中,各切片厚度之间比较差异有显著性(P<0.05,表1)。比较各组中4种切片厚度的APSAP,结果提示组织切片越厚,其对应的APSAP值越高。比较5组Ki-67表达中各组间4种切片厚度对应的APSAP增长幅度和标准差可以发现:低表达组、较高及高表达组中厚度4 μm或6 μm切片APSAP对应的标准差分别低于2 μm和8 μm。综合分析结果显示:随着切片厚度的增加,Ki-67的APSAP也随之增加;组织切片厚度为4 μm或6 μm时,误差相对较小,可得到较为稳定可靠的检测结果。
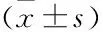
表1 淋巴瘤组织不同切片厚度与Ki-67 APSAP的关系
3 讨论
NHL具有很强的异质性,根据肿瘤细胞增殖速度和临床特点,临床上主要将NHL分为惰性淋巴瘤、侵袭性淋巴瘤和高度侵袭性淋巴瘤[4]。目前最常见的是MALT淋巴瘤和DLBCL,MALT淋巴瘤临床呈惰性表现;DLBCL有高度侵袭性且生长快速,若低度恶性的MALT淋巴瘤患者不及时治疗,恶化为DLBCL的机率较大[5]。活检穿刺组织如胃、肠等标本较小且部分含有坏死或纤维化的病变成分,仅靠单一的形态学分析难以对NHL进行准确的分型分级,需结合免疫组化标记对NHL进行联合诊断。Ki-67作为一种反映NHL细胞增殖活性的核表达蛋白,是MALT淋巴瘤和DLBCL鉴别诊断的关键指标,Ki-67 PI是低度恶性MALT转化为DLBCL的一种量化指标[6-7]。Broyde等[8]研究显示,Ki-67 PI为45%时,可作为区分惰性淋巴瘤和侵袭性淋巴瘤的临界值,侵袭性淋巴瘤恶性程度高于惰性淋巴瘤,且在高侵袭性淋巴瘤中Ki-67表达显著高于惰性淋巴瘤。Hashmi等[9]研究表明,Ki-67在MALT淋巴瘤中阳性细胞数一般不高于20%,在DLBCL中阳性细胞数一般不低于40%,有的呈过表达,阳性细胞数达90%以上。由于淋巴组织细胞丰富、间质少,切片过厚、染色深或有不着色的发白区等都会对病理医师诊断造成困扰。
文献报道,除标本类型、标本的固定及脱水、石蜡包埋、切片质量、抗原修复、一抗孵育、实验室水质等因素外,组织切片厚度对IHC结果也存在一定影响[10-11]。由于淋巴瘤肿瘤细胞胞核较大,如果切片较薄可能使部分抗原信号丢失,导致Ki-67检测受影响;而切片较厚则导致组织切片脱落,细胞计数过程中需不断调节显微镜微距,同时也不易区分核分界,容易造成细胞计数差异,导致结果误判。因此,需要探索出适宜的切片厚度,既能够保持组织细胞完整性,又能染色均匀,易于计数,得到比较准确稳定的计数结果,为临床病理诊断提供可靠依据。有研究报道组织切片间2 μm的差异对染色强度有一定程度的影响,导致IHC中标志物染色结果的错误判读。本实验对MALT淋巴瘤和DLBCL两种病变标本切片厚度分别选取2、4、6、8 μm四个变量进行分析,结果显示,随着切片厚度的增加,病变部位细胞核染色逐渐加深:当切片厚度为2 μm时,暴露细胞核层数相对较少,组织抗原暴露不充分,使IHC染色较浅且颜色对比不鲜明,对于阳性细胞较少的标本不好计数,同时病灶细胞核染色较浅;随着切片厚度的增加,暴露细胞核层数逐渐增多,个别病灶细胞可能出现重叠,所以细胞核染色逐渐加深;此外,随着切片厚度的增加,组织横断面细胞数增加,细胞核染色强度为3+的细胞数相对多于细胞核染色强度为2+和1+的细胞数,故组织总体染色强度加强。但是当切片厚度为8 μm时,细胞结构较厚,会出现非特异性染色,不利于细胞计数,并伴随有部分组织断裂和脱片。相比之下,4 μm和6 μm厚度切片组织结构清晰完整,没有明显的组织断裂和脱片,染色对比鲜明,可以很好的分辨并进行细胞计数。此外,本实验中Ki-67的APSAP也随着切片厚度的增加而增加,中~低表达组、中表达组、中~高表达组及高表达组中切片厚度2~8 μm的APSAP差值大于15%,导致计算出来的阳性细胞面积比例增大,使对应的阳性细胞数增多,从而也会导致Ki-67 PI出现较大差异。特别是对Ki-67增殖指数处于临界值45%的组织而言,如果APSAP偏高,可能导致Ki-67增殖指数大于45%;APSAP偏低,可能导致Ki-67增殖指数小于45%,这两种结果都可能误导医师对MALT淋巴瘤和DLBCL的鉴别诊断。所以,切片厚度过薄或过厚都会导致细胞计数误差较大,计数结果可能误导医师诊断。因此对于Ki-67增殖指数为45%左右的淋巴瘤组织,建议切片厚度在4~6 μm,该范围内的APSAP误差较小,可获得较为稳定可靠的结果,更为准确地辅助医师诊断。
