基于荧光定量PCR 技术分析滇池沉积物产甲烷菌空间分布特征*
2021-01-22罗明没李尚磷李春艳冉玉芳
陈 悦 ,罗明没,李尚磷,李春艳,冉玉芳,李 玮 ,胡 斌
(1.云南大学 生态与环境学院,高原湖泊生态与治理研究院,云南 昆明 650091;2.云南省高原山地生态与退化环境修复重点实验室,云南 昆明 650091)
甲烷是重要的温室气体,对全球变暖有重要的作用,其变暖潜力是CO2的25 倍,同时会导致平流层臭氧层破坏加剧[1-2]。自工业革命以来,大气中的甲烷浓度已经增加了1 倍,并且在持续增加。许多生态系统中都有甲烷排放,如泥炭地[3-5]、垃圾填埋场[6]、水稻土[7-8]、湖泊沉积物[9]和内陆湖泊[10-11]等。净甲烷产生通常来自于沉积物以及底部水体中,沉积物中大部分甲烷排放可能是由于产甲烷菌利用H2产生,即利用H2/CO2的氢营养型途径[12-13]。产甲烷菌在甲烷的循环中起主导作用,是唯一已知主要利用H2/CO2、甲酸盐和乙酸作为底物、并将其分解代谢得到甲烷的生物[14-15]。产甲烷菌的所有底物代谢途径都是为了使初级底物转化为甲基或甲基化化合物,接着将甲基转移至辅酶M,形成中间甲基辅酶M (甲基-COM),然后由产甲烷古菌中特有的关键酶−甲基辅酶M 还原酶(methyl-coenzyme M reductase,MCR)催化产甲烷最终步骤[16-18]。产甲烷古菌跨越了广古菌门7 个目[19],即甲烷杆菌目(Methanobacteriales)、甲烷球菌目(Methanococcales)、甲烷微菌目(Methanomicrobiales)、甲烷八叠球菌目(Methanosarcinales)、甲烷火菌目(Methanopyrales)、甲烷胞菌目(Methanocellales)和马赛球菌目 (Methanomassiliicoccales)[20]。这些目都含有种类繁多的类群,它们在形态和生理特征上有很大的差异,所需底物不同,生存环境各异,但都含有催化产甲烷最终步骤的特征酶−MCR,且都具有厌氧产甲烷的功能[17,21-22]。因此在鉴定产甲烷菌的过程中,利用mcrA基因进行PCR 检测是稳定且有效的方法[23]。
滇池是中国西南云贵高原的40 个湖泊之一,也是第六大淡水湖,位于亚热带或温带气候区,在为邻近的城市和农村地区提供淡水资源和发展水产养殖方面发挥着非常重要的作用,具有很高的生态经济价值;随着人口增长对清洁水的需求日益增长,其水质变化越来越受到政府及公众的关注[24]。滇池作为高原湖泊,与其他湖泊相对隔离,极易富营养化[25]。由于地处城市边缘,人口密集,工业和生活污水未经处理就向滇池及其支流排放,有机碳、氮磷负荷大,富营养化已成为滇池最大的威胁,是制约周边城市经济发展的首要问题[26]。在全球变暖的背景下,湖泊富营养化程度会影响湖泊碳平衡,严重富营养化可能还会加剧湖泊CH4排放[27]。湖泊沉积物是富营养化水体大量营养素的来源及其储存空间,且厌氧产甲烷主要来源于湖泊沉积物中的厌氧产甲烷菌,因此,研究沉积物产甲烷菌对于富营养化湖泊碳循环研究具有重要的理论指导意义。微生物群落丰度与样地的物理化学性质和甲烷产量显著相关,而湖泊营养状态、沉积物基质的物理和化学特性,如土壤水分、温度、海拔、pH 和盐度等对产甲烷菌群落丰度有影响[28-33]。研究表明:滇池的产甲烷潜力变化以及甲烷菌的丰度和群落结构与沉积物层深度相关[34],但对产甲烷菌空间水平的分布特征缺乏探讨。本研究以滇池沉积物为对象,采用荧光定量PCR 方法研究产甲烷菌丰度及分布特征,以期为高原富营养化湖泊生物甲烷排放潜力估算提供一定的理论指导作用。
1 材料与方法
1.1 研究区概况
滇池位于云南省昆明市区,沿湖全长308.6 km,平均水深5.03 m,最大水深11.35 m。水温变化范围为9.8~24.5 ℃,年平均水温16 ℃[35]。随着城市化进程,大量的生活与工业污水排放逐年增加,导致滇池成为典型的高原富营养化湖泊。滇池分为草海与外海两部分,其污染程度各不相同,草海富营养化程度明显高于外海[26]。本研究在滇池草海和外海选取存在明显环境差异的4 个代表性区域采样,分别为A1:草海,滇池北部排污密集区;A2:外海北,水华严重区;A3:外海中,农业污染排放密集区;A4:外海南,靠近磷矿和钾肥厂区,磷钾污染排放密集区(图1)。

图1 滇池采样点(A1~A4)分布Fig.1 The distribution of sampling sites (A1-A4)in Dianchi Lake
1.2 样品采集与保存
分别在采样点A1~A4 用沉积物采样器采集深度0~10 cm 的沉积物底泥,每个样点4 个重复,共16 个样品。采集后立即将沉积物转移至厌氧瓶中,用硅胶塞塞住,迅速转移至4 ℃便携式恒温箱中。带回实验室后立即存放于−20 ℃冰箱,用于后续荧光定量PCR 分析。
1.3 产甲烷菌丰度检测
用Omega 试剂盒提取16 个沉积物样品中的DNA,然后通过1%凝胶电泳来检测提取效果后放于−20 ℃冰箱中保存,以备后续使用。以提取沉积物中的总DNA 为模板,利用mcrA基因特异性引物进行PCR,同时设置阴性空白对照(CK,不加DNA 模板)。扩增体系为25 μL:Master Mix 12.5 μL,DNA 1 μL,10 μmol/L 引物F 1 μL,10 μmol/L 引物R 1 μL,ddH2O 9.5 μL。扩增引物和程序[36]见表1。
扩增完成后采用天根 DP219 试剂盒进行目的片段回收纯化。纯化PCR 产物与pGM-T Fast Vector载体连接,取部分连接产物加至50~100 μL DH5α感受态细胞中。在预先制备预热的含有氨苄青霉素终质量浓度为100 μg/mL 的LB 琼脂糖平板进行涂布培养,37 ℃培养过夜,直至可观察到菌落。
将得到的白色菌落接种至1~5 mL LB (含有终质量浓度为50~100 μg/mL 的氨苄青霉素)培养基,37 ℃摇床振荡培养过夜,保存菌种后提取质粒(采用TIANprep Mini Plasmid Kit 质粒小提试剂盒提取)。以原有的引物对质粒进行PCR 扩增,初步验证阳性克隆。菌液PCR 扩增后,有目的条带的样品送至生工生物工程(上海)股份有限公司,通过一代测序的方法验证确认阳性,阳性克隆菌液测序结果在GenBank 上利用BLAST 进行序列的同源性分析。用Nandrop 2000 测定提取的质粒质量浓度后,将质粒质量浓度进行10 倍梯度稀释,然后在罗氏LC96 仪器进行荧光定量PCR 扩增,建立荧光定量标准曲线。
在获得稳定和可信度高的标准曲线后,为确定荧光定量PCR 扩增的特异性情况,以标准质粒为阳性对照,以无菌蒸馏水为阴性对照(CK),对16 个样品DNA 的荧光定量PCR 的扩增曲线及熔解曲线进行特异性评价。最终将待测样品和标准质粒同时扩增,根据建立的标准曲线计算样品产甲烷菌的拷贝数,并对荧光定量结果进行分析,揭示滇池的产甲烷菌丰度及分布特征。荧光定量PCR 扩增体系为20 μL:2×SybrGreen qPCR Master Mix 10 μL,DNA 0.5 μL,10 μmol/L 引物F 0.5 μL,10 μmol/L 引物R 0.5 μL,ddH2O 8.5 μL,扩增引物和程序[36]见表1。

表1 引物序列与扩增程序Tab.1 Primer sequence and amplification program
1.4 数据分析
(1)绝对荧光定量分析完成后,用Light Cycler® 96 SW 1.1 软件分析数据。
(2)按照以下公式计算mcrA基因的拷贝数和土样中产甲烷菌的拷贝数:
标准样品质粒的mcrA基因的拷贝数(copies/μL)=(6.02×1023)×(质粒质量浓度×10−9)/[(T 载体长度+mcrA基因长度)×660];
土样中产甲烷菌的拷贝数(copies/g)=(样品中DNA 的拷贝数×总DNA 稀释倍数×总DNA 体积)/土壤质量。
式中,质粒质量浓度单位为ng/μL;T 载体长度为3 031 bp,来自天根 DP219 试剂盒的pGM-T Fast Vector 载体;因本试验的目的条带接近500 bp,故计算时mcrA基因长度取标准范围464~491 bp中的491 bp;样品中DNA 的拷贝数单位为copies/μL;总DNA 体积单位为 μL;土壤质量根据Omega 试剂盒说明书称取0.3 g。
(3)用Excel 软件进行数据预处理,计算平均值和标准差。采用SPSS 进行单因素方差分析,比较不同采样区域间沉积物产甲烷菌丰度的差异显著性。
2 结果与分析
2.1 目的片段扩增
以样品总DNA 为模板,运用mcrA基因引物PCR 扩增的条带接近500 bp (图2),产甲烷菌目的条带位于464~491 bp,基本吻合。可初步判定:试验条件满足扩增产甲烷菌特异性片段的要求。

图2 沉积物mcrA 基因PCR 扩增结果Fig.2 PCR amplification results of sediment mcrA gene
2.2 重组质粒扩增、测序
将目的片段扩增后的目标条带回收,连接转化涂布出的菌液提取质粒后,进行PCR 扩增的目标条带清晰明亮,接近500 bp (图3),初步证明目的基因成功克隆。阳性克隆菌液测序结果在GenBank 上利用BLAST 进行序列的同源性分析,结果表明:产甲烷菌mcrA基因的阳性克隆序列与GenBank 上的已知产甲烷菌的菌种相似性为97%。
2.3 荧光定量PCR 标准曲线及可信度分析
测定的质粒质量浓度为25.6 ng/μL。将标准质粒进行10 倍梯度稀释后,选取5 个稀释梯度的稀释质粒作为模板进行荧光定量PCR 反应。标准曲线(表2、图4) 显示:每个稀释梯度点的3 个重复变化不大,变异系数很小,说明标准曲线具有一致的重复反应、高的线性(R2=1)、高的扩增率(E=92%) 以及斜率(S=−3.525 0),是合格的标准曲线,满足绝对定量的要求,具有很高的可信度与良好的重复性。
图3 重组质粒的mcrA 基因PCR 扩增结果Fig.3 PCR amplification results of recombinant plasmid mcrA gene

表2 不同稀释倍数的标准质粒real-time PCR 检测精度Tab.2 Precision of standard plasmids of different dilution times detected by real-time PCR
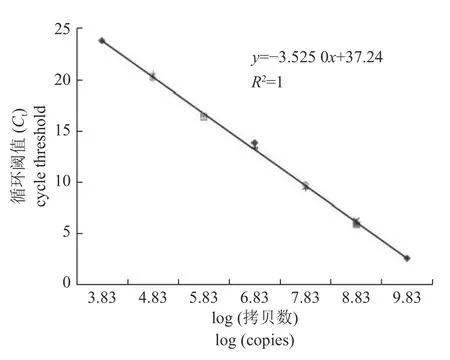
图4 荧光标准曲线Fig.4 Fluorescence standard curve
2.4 特异性扩增评价
由图5 可知:标准质粒与滇池沉积物土壤DNA 均呈S 型扩增曲线,显示阳性。标准质粒DNA 浓度从6.07×104至6.07×108copies/μL 范围内扩增曲线的线形均很好。从整体上看,重复性都很高。由熔解曲线(图6)可见:目的产物熔解温度为90~92 ℃,A1-1 和A2-3 引物二聚体熔解温度为76~78 ℃。阴性对照无检出目的产物峰值,说明扩增体系无污染。目的基因峰值接近,扩增产物基本一致,除A1-1 和A2-3 外,基本上无非特异性峰的出现。
2.5 荧光定量PCR 结果
由于拷贝数对数与Ct值呈线性关系,线性方程为y=−3.525 0x−37.24 (R2=1,x为拷贝数的对数值,y为Ct值),所以Ct值越大,拷贝数越小。由表3 可知:样品的Ct值范围在17.753~31.823之间,产甲烷菌DNA 拷贝数范围在3.07×103~1.04×109copies/g 之间。总体来说,A2 (外海北部)样品中Ct值普遍较大,所以DNA 拷贝数值很低;A3 (外海中) 样品则反之,Ct值整体都较小,所以DNA 拷贝数较高。Ct值的变化趋势为A2>A1>A4>A3,拷贝数反之为A3>A4>A1>A2,即沉积物产甲烷菌丰度表现为:外海中>外海南>草海>外海北。此外,产甲烷菌的拷贝数在各个采样区域差异显著(F=10.300 6,P=0.001 2<0.05),相同采样点4 个重复之间产甲烷菌拷贝数差异比较大,说明空间异质性很大,且A3 (外海中)和A4 (外海南部)与A1 (草海)和A2 (外海北部)有显著性差异(P<0.05)。
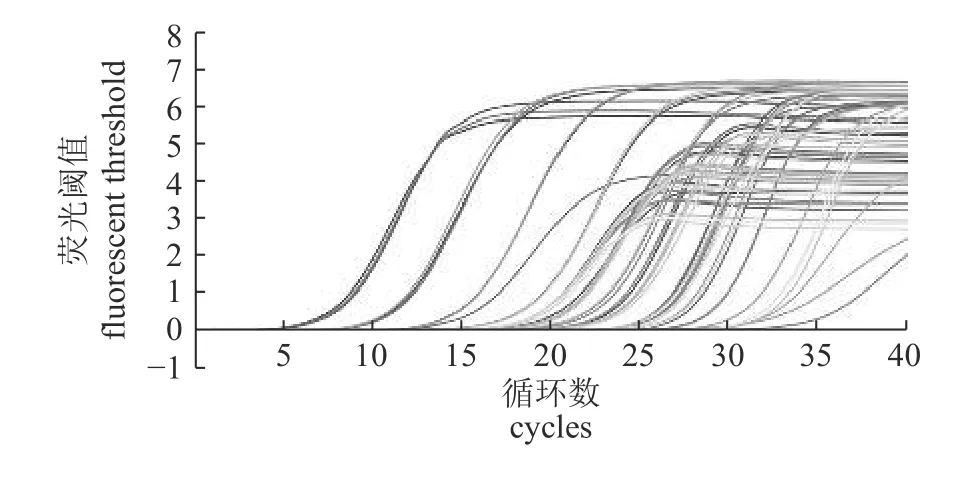
图5 扩增曲线Fig.5 Amplification curve

图6 熔解曲线Fig.6 Melting curve
3 讨论
本研究通过运用荧光定量PCR 技术成功扩增出滇池沉积物中产甲烷菌的特异性条带,并测定出产甲烷菌丰度结果为外海中>外海南> 草海>外海北,证实了高原淡水湖泊滇池中存在产甲烷菌,且产甲烷菌丰度在草海和外海4 个采样区域有显著差异性。BAI 等[35]研究表明:外海的沉积物细菌群落比草海更容易受到环境因素的影响,且样本的空间区域位置是细菌群落结构变化的主要原因。本研究也发现:产甲烷丰度存在空间分布特征,可能是环境因素影响了其分布。外海中部接近农业面源污染即氮磷负荷超标的地区,微生物生长旺盛,产甲烷菌含量最为丰富,而外海南接近磷、钾矿排污富集区域,这2 个区域产甲烷菌含量丰度与草海富营养严重区域有显著差异。分析其原因主要有以下2 个方面。

表3 滇池沉积物样品mcrA 基因的循环阈值(Ct)与基因拷贝数Tab.3 Cycle threshold (Ct) and copy number of mcrA gene in the sediments of Dianchi Lake
(1) 化学氮肥和有机氮肥联合施用能够改善土壤碳基质和产甲烷菌的活性,提高产甲烷菌的mcrA的丰度,从而提高甲烷的产量及通量,平衡的碳氮比有利于甲烷的产生[37-38],故可推断农田施肥灌溉污水中的氮素及矿厂工业废水的磷、钾等流入滇池,使产甲烷菌的生长基质发生变化,明显促进了产甲烷菌的生长。
(2) 有机质来源会影响产甲烷菌的丰度和活性。产甲烷菌利用溶解有机质和固体有机质的能力不同[39],甚至溶解有机质会抑制甲烷的产生[40]。本研究草海区域有机质含量高于外海[41],但产甲烷菌含量低于外海平均,且与外海南部和中部差异显著。说明外海有机质来源可能更适合于产甲烷菌的生长,特别是外海南部和中部。滇池水华密集区域,产甲烷菌的含量最低,可能是由于全球变暖的背景下,温室气体促进有害藻类的光合作用和生长繁殖,有害水华向周围生物释放有害的毒素,抑制了产甲烷菌的生长[42]。
4 结论
本研究仅是基于mcrA基因采用荧光定量PCR 的方法揭示产甲烷菌丰度的空间分布特征,主要结论为高原湖泊滇池沉积物存在较高产甲烷菌丰度,且产甲烷菌空间分布特征为外海中>外海南>草海>外海北。有关面源污染对滇池产甲烷菌影响机制和水华富集区藻类如何影响产甲烷菌等问题有待后续探讨研究。
