5 种通关藤花粉活力测定方法比较*
2021-01-22刘成琴赵兴旺康志钰丁家娟孙映雪王建军
刘成琴,赵兴旺,康志钰,丁家娟,孙映雪,王建军
(云南农业大学 农学与生物技术学院,云南 昆明 650201)
通关藤[Marsdenia tenacissima(Roxb.) Wight et Arn.]为萝藦科牛奶菜属藤本植物,分布于云南、广西和贵州等省区,是西南地区常用的民族药之一[1-2]。其味苦,性微甘,具有消炎止痛、清热解毒、止咳平喘等作用。临床广泛应用于治疗各种恶性肿瘤,疗效良好,是临床必用的抗肿瘤药物之一[3]。云南省红河州是通关藤的地道产区,近几年通关藤的贮藏量急剧下降,很多地方的通关藤遭到了严重砍伐,有些甚至是连根挖走,极不利于通关藤的自然更新[4]。
萝摩科植物的花粉以花粉块的形式存在,这是该科植物的典型特征,通关藤尤为典型。萝摩科植物的坐果率一般较低,平均0.33%~5.00%[5]。目前,国内外对通关藤的研究主要集中在化学成分、药理活性、种子萌发、资源调查和真伪鉴定等方面,而对其花粉活力测定方法鲜见报道。目前,规范化栽培和野生抚育种植的种苗均以种子为繁殖材料[6]。但由于通关藤坐果率普遍较低,使通关藤花多果少,产生的种子数量也少,成为利用种子进行扩大繁殖的限制因素之一。本研究采用不同方法测定通关藤花粉活力,并通过对比分析,筛选出通关藤花粉活力测定的最佳方法。对提高通关藤坐果率具有重要意义,也为通关藤的快速繁殖提供理论基础。
1 材料与方法
1.1 材料的采集与处理
试验材料于2019 年5—6 月采自云南省红河州蒙自市水田乡通关藤种植示范基地,选取处于初花期、盛花期和末花期的花,迅速带回实验室,用解剖针将花粉块取下,分别利用TTC 染色法、醋酸洋红染色法、I2-KI 染色法、过氧化物酶染色法以及花粉离体萌发法5 种方法进行花粉活力测定。
1.2 花粉活力测定方法
(1) TTC 染色法
取3 朵花的花粉置于普通载玻片上,滴入质量分数为0.5%的TTC 溶液2 滴,用镊子搅拌均匀,盖上盖玻片,于25~28 ℃放置15~20 min。在显微镜下观察不同的5 个视野,凡被染成红色的均为有生活力的花粉粒[7]。
(2) I2-KI 染色法
取3 朵花的花粉于干净的普通载玻片上,加水1 滴,使花粉散开,再加1 滴碘—碘化钾溶液,盖上盖玻片,置于显微镜下观察。取5 个视野进行观察并计数,凡被染成蓝色的均为有生活力的花粉粒[7]。
(3)醋酸洋红染色法
取3 朵花的花粉放在载玻片上,并滴入1~2 滴醋酸洋红溶液,用镊子搅拌均匀,盖上盖玻片,片刻后在显微镜下观察5 个不同的视野,有活力的花粉被染成红色[8]。
(4)过氧化物酶沉淀法
先配制试剂Ⅰ:0.5%联苯胺、0.5% α-萘酚、0.25%碳酸钠各10 mL 混合均匀。在干净载玻片上放3 朵花的花粉,然后加试剂Ⅰ和0.3% 过氧化氢各1 滴,搅匀后盖上盖玻片,将制片放置30 ℃恒温箱中10 min,置于显微镜下观察,取5 个视野统计并记录被染为红色的花粉数量[9]。
(5)花粉离体萌发法
先配置A、B 2 种培养基[10],用解剖针将3 朵花的花粉块取下放在凹面载玻片上,分别滴入2~3 滴B 培养基,将载玻片放入装有湿滤纸的培养皿中再盖上一较大的培养皿,置于30 ℃的恒温培养箱中暗培养,培养24 h,取出,滴入20%的KOH 溶液使花粉块壁溶解,然后压片并在显微镜下选5 个不同视野观察并计数。

以上5 种方法均在10 倍显微镜下观察,每种方法3 次重复。
1.3 数据处理
数据采用SPSS 19.0 和Excel 2010 处理,显著性方差分析利用LSD 法。
2 结果与分析
2.1 不同测定方法下花粉活力比较
从5 种通关藤花粉活力测定结果来看(图1):花粉活力由高到低依次为I2-KI 染色法>醋酸洋红染色法>TTC 染色法>过氧化物酶染色法>花粉离体萌发法。其中花粉离体萌发法测得的花粉活力最低,只有0.02%。醋酸洋红染色法、TTC 染色法和过氧化物酶染色法也比较低,分别为52.10%、51.44% 和39.02%,且三者之间差异不显著。I2-KI 染色法测得的花粉活力最高,达到了90.85%。因此最适合的通关藤花粉活力测定方法为I2-KI 染色法。

图1 不同测定方法下通关藤花粉活力比较Fig.1 Comparison of pollen viability of M.tenacissima under different determination methods
2.2 不同花期花粉活力比较
由于测定花粉活力最好的方法为I2-KI 染色法,所以用该方法测定了通关藤初花期、盛花期和末花期的花粉活力。从各个时期花粉活力比较来看(图2),花粉活力最高的为初花期达到90.85%,盛花期次之为79.40%,最低的是末花期花粉活力为69.16%。初花期和末花期差异显著,初花期和盛花期差异不显著,盛花期和末花期差异不显著。
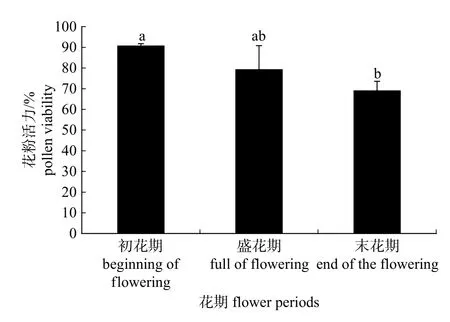
图2 不同花期通关藤花粉活力比较Fig.2 Comparison of pollen viability in different M.tenacissima flower periods
3 讨论
花粉活力直接关系到杂交授粉的成功率。花粉活力检测方法主要有花粉离体培养法和染色法[11]。花粉离体萌发法测定花粉活力时易受温度、pH 值、营养物质和矿质元素等的影响[12]。染色法对花粉活力测定具有简单、快速的优点,但不同植物花粉适宜的染色方法不同[13]。因此筛选适合测定某种植物花粉活力的染色法在杂交育种上具有非常重大的意义。
本研究采用的TTC 染色法、醋酸洋红染色法、I2-KI 染色法、过氧化物酶染色法和花粉离体萌发法5 种测定通关藤花粉活力的方法中,TTC染色法、醋酸洋红染色法和过氧化物酶染色法测出的花粉活力都相对较低,颜色较浅,染色效果不佳。可能是由于花粉块的膜没有充分破坏,导致花粉不能完全分散开,也有可能是通关藤花粉块的特殊结构和含有特殊成分使得这3 种方法不适合其花粉活力的测定。此外,TTC 染色法的染色效果还可能与花粉的呼吸作用和花粉外壁的结构有关[14]。花粉离体萌发法测定的花粉活力最低,在试验中发现培养4、6 和8 h 花粉都不萌发,只在培养24 h 时分别在初花期和盛花期的1 个视野中发现了1 粒花粉萌发。可能是本试验所用培养基不适合通关藤花粉萌发,对其萌发最适合的培养基的确定还有待进一步的研究。本研究中I2-KI 染色法的染色率最高,而且各重复之间差异显著,所以I2-KI 染色法能准确地反应通关藤的花粉活力,可作为测定通关藤花粉活力最佳的方法。这与在肋柱花[13]、大叶相思[15]等植物上的研究结果一致。这可能是通关藤花粉中淀粉含量较高,I2-KI 容易渗透进花粉壁使花粉粒着色。在本研究中还发现通关藤花粉活力随着花龄的增大而减小,但是在通关藤的整个花期中都保持着花粉活力,这可能是通关藤适应萝藦科植物传粉率低、坐果率低的一种机制。
4 结论
本研究采用的5 种测定通关藤花粉活力方法中,TTC 染色法、醋酸洋红染色法和过氧化物酶染色法测出的花粉活力都相对较低,颜色较浅,染色效果不佳,而I2-KI 染色法测得的花粉活力高达90.85%。所以,I2-KI 染色法为测定通关藤花粉活力有效的方法,并且随着花龄增大花粉活力有所下降。
