空间分辨代谢组学进展和挑战
2021-01-22殷志斌黄文洁伍欣宙晏石娟
殷志斌 黄文洁 伍欣宙 晏石娟
(1. 广东省农业科学院农业生物基因研究中心 广东省农作物种质资源保存和利用重点实验室,广州 510640;2. 华南农业大学植物保护学院,广州 510642)
植物体内含有极其丰富且化学结构多样的代谢物。这些内源代谢物在维持植物生长发育和抵御各种逆境胁迫中都发挥了至关重要的作用[1-3]。众多植物内源代谢物还是人类生活必需品的重要来源。例如,除虫菊可用于提取杀虫剂成分,茉莉和檀香可用作香水,三叶胶可用作橡胶,香樟可用作香料等[4]。很多药用植物被人们陆续发现和被用于提取特异性药物成分,例如从青蒿中提取出有抗疟活性的倍半萜内酯类化合物青蒿素[5]。尽管近10年来我们结合代谢组与基因组等技术,对主要农作物中代谢物生物合成途径的调控机制及遗传解析[6]、代谢工程研究[7]和代谢网络及功能研究进展迅速[8-11],但是对代谢物在植物体内何时、何地产生和贮藏仍有待进一步探究。事实上,植物体内代谢物的合成和累积往往具有精准的空间分布,且生理功能常与其在组织甚至单细胞中的空间分布紧密相关。因此,实现高空间分辨地精准定位组织中代谢物的分布对阐明植物中代谢物的合成、积累和调控机理至关重要。
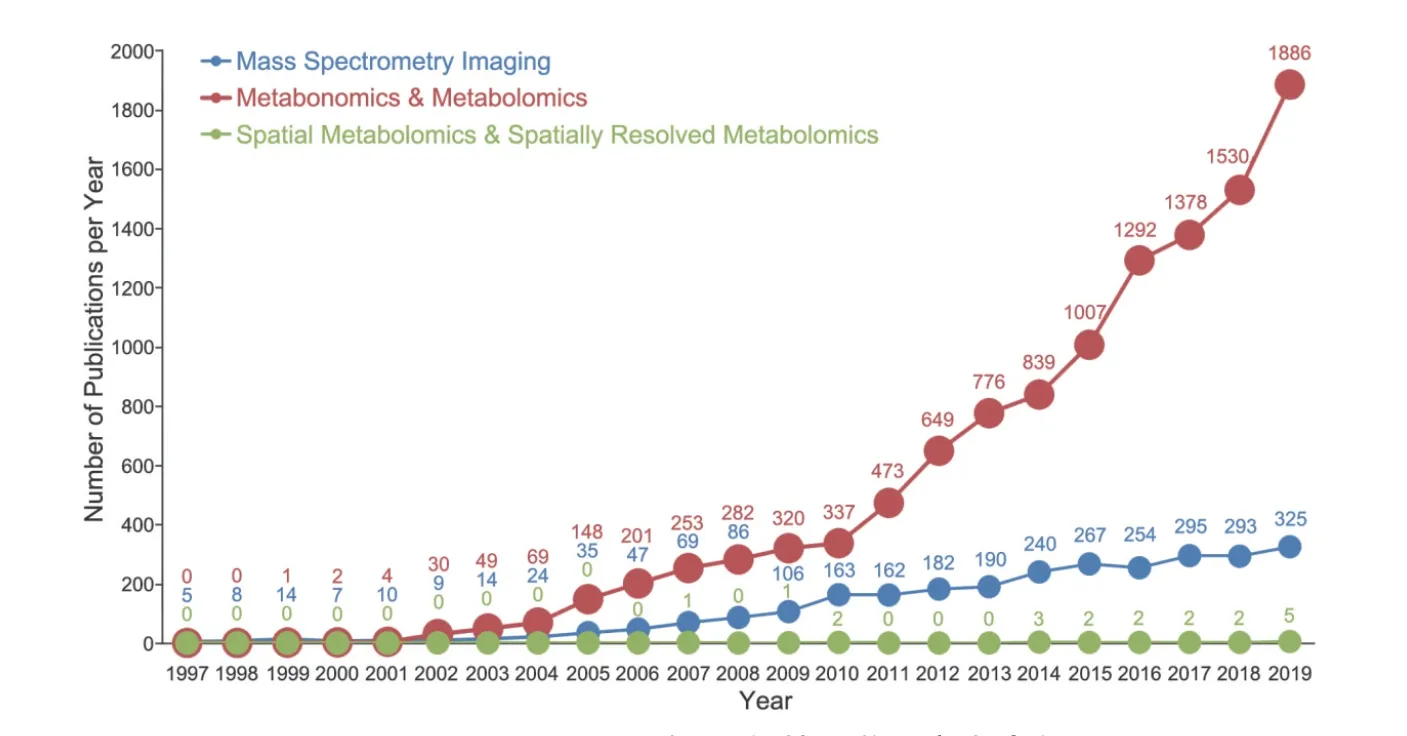
图1 1997-2019年间代谢组学文章发表数
传统的代谢组学旨在阐析动植物组织或细胞中含有的代谢物整体含量及其变化规律。随着研究的不断深入,缺少空间分辨信息对于代谢组学分析来说是不完整的。空间分辨代谢组学作为一个新兴前沿的分析技术,即整合质谱成像(Mass spectrometry imaging,MSI)和代谢组学手段,利用前者可准确识别并定位多种代谢物在组织、甚至细胞间的差异性分布,利用后者可对目标微区域组织进行深度代谢组学分析,获得代谢物种类和含量。质谱成像技术以其无需探针标记、非特异性检测、可一次分析同时获得数百个代谢物分子的成像等优势,可直接捕获目标代谢物在动/植物组织中的空间分布,为代谢组学分析提供了一种新的研究手段。空间分辨代谢组学(Spatially resolved metabolomics)一词最早于2007年由Sumner课题组在美国植物学联合年会上提出[12],当时主要是利用激光切割显微镜技术结合代谢组学手段来进行代谢物在组织层面的分辨。从2010年开始,Sumner等[1]、Lee等[13]和Horn等[14]才真正将MSI技术引入到植物组织的代谢组学研究中。2019年,Sun等[15]和Yamamoto等[16]利用基于MSI的空间代谢组学技术分别对人鳞片状食管癌组织中代谢相关的差异代谢物和植物单细胞中功能代谢物进行空间定位。进一步将空间分辨代谢组学技术从植物领域拓展到了动物组织甚至单细胞领域。得益于质谱仪器成像分辨率和检测灵敏度的提高,空间分辨代谢组学突破了传统代谢组学信息深度不足的缺点,将组学信息拓展到了二维水平,极大地提升了对样品信息的认知。如图1所示,以关键词“Mass spectrometry imaging”、“Metabonomics& metabolomics”和“Spatial metabolomics & Spatially resolved metabolomics”在Web of Science上进行搜索。从1997年-2019年间质谱成像、代谢组学和空间分辨代谢组学技术的发表论文数目的增长趋势来看,MSI技术仍是当前十分热门的研究领域之一。本文系统总结了代谢组学和MSI技术的研究现状;重点综述了空间分辨代谢组学在动/植物组织和单细胞层面的最新应用进展;最后对空间分辨代谢组学技术的现有瓶颈和未来发展进行了总结和展望。
1 空间分辨代谢组学的研究进展
1.1 代谢组学技术
代谢组学(Metabonomics 或者Metabolomics)的概念是在20世纪末由Jeremy Nicholson和 Oliver Fiehn先后提出[17-18],旨在对某一特定条件下(病理、生理或基因型)的生物、组织或细胞中所有低分子量化合物进行定性与定量分析,以及对不同条件下代谢动态应答的定量测定[19]。因此,代谢组学是一门关于生物体内源性代谢物质的整体及其变化规律的科学,它是继蛋白质组学、转录组学和基因组学发展之后的一种新兴组学技术。由于其发展迅速,目前已被成功地应用于生命科学和食品科学的多个研究领域。直至2019年,代谢组学的研究论文发表数一直处于指数级增长(图1)。
代谢组学的数据采集技术主要基于(1)色谱技术,如气相色谱(Gas chromatography,GC)、液相 色 谱(Liquid chromatography,LC)、毛 细 管 电泳(Capillary electrophoresis,CE);(2)质谱(Mass spectrometry,MS)技术;(3)核磁共振技术(Nuclear magnetic resonance,NMR);(4)傅里叶变换-红外光谱技术(Fourier transform-infrared spectrometer,FT-IR)等。其中,发展迅速、研究深入且应用广泛的主要是NMR技术和色谱-质谱联用技术。NMR技术是通过对小分子代谢物中1H、13C、15N和32P等原子核在电场中能级跃迁进行检测,从而获得代谢物的化学组成。由于样品前处理简单、对样品破坏性小、非特异性检测且结构信息丰富,NMR技术已成为代谢组学研究中不可或缺的方法之一。但该技术也有一些不足,如灵敏度相对较低、动态检测范围较小,不太适合于复杂体系中含量差异较大的多种物质同时检测。为此,通过提高磁场强度或使用超低温冷却探头等手段,可在一定程度上提高NMR技术的灵敏度和分辨率问题[20]。GC-MS技术具有高灵敏度、高分辨、高重现性和较为完整的标准质谱图数据库等优点,应用非常广泛,迄今仍然是主要的代谢组学研究平台之一。但由于GC-MS技术常要求待测分子具有挥发性,因此无法对热稳定性差或分子量较大的化合物进行检测。尽管可以利用衍生化等手段来改善样品的挥发性,但衍生化反应过程中常常会引入一些干扰物质。相比于气态样品分析,LC-MS技术不仅具有相同的优势(如灵敏度高、分析速度快和分辨率高),还十分适合于高沸点、热不稳定性和大分子量等待测物的检测。此外,相比于NMR技术,其动态范围和检测灵敏度得以大幅提升。最近,二维液相色谱技术的提出,大大提高了LC-MS技术的分离能力和峰容量,进一步提高了分析通量。CE-MS是利用阴/阳离子电泳速度不同来实现离子型化合物的分析,由于该技术样品消耗量小,成本低,且无需进行衍生化处理等优势而得到广泛应用,但其在灵敏度和分辨率方面略有不足,因此在植物代谢组学分析中应用相对较少。
代谢组学的数据分析技术包括质谱数据的预处理(峰对齐、滤噪、离子提取等)、未知代谢物的鉴定、化学计量学理论和多元统计分析等相关技术,它们随着代谢组数据采集技术的迅速发展而不断更新[21-26]。尽管系列公共代谢组学数据库的公开在未知代谢物的鉴定中发挥了重要作用,如Madison metabolomics consortium database(MMCD)[27]、MassBank[28]、KNApSAcK core database[29]、Plant metabolome database(PMD)[30]、Metlin[31]、RIKEN tandem mass spectral database(ReSpect)[32]、MeltDB[33]、Golm metabolome database(GMD)[34]等。但至今为止,大部分代谢物还是不能被鉴定出来。因此,国内外研究人员致力于开发出用于解析质谱和核磁共振数据的新技术及通过整合代谢途径信息进行代谢物注释的工具[35-39]。朱正江课题组开发了一款MetDNA软件算法,可实现小分子代谢物的精确结构鉴定,无需依赖于完备的代谢物标准品二级质谱数据库,便可大规模提高其鉴定数量和覆盖率[38]。最近,他们还发展了一种基于离子淌度质谱的碰撞截面数据库(AIICCS),并针对生命体内已知和未知代谢物的化学结构进行了鉴定[39]。
植物代谢组学是代谢组学的重要分支,植物相关的代谢物约有20-100万种。因此,植物代谢组学对揭示生命基本活动和规律十分重要,随着靶向/非靶向代谢组学技术的不断发展,以及代谢物数据库和数据分析软件的不断完善,代谢组学已被广泛用于功能基因组、天然产物的合成生物学及质量评价研究等。Fiehn等[18]最早将代谢组学技术用于拟南芥的功能基因组研究中。对4种不同基因型拟南芥材料共检测到326个代谢物,并最终区分没有明显表型的突变体及野生型拟南芥。Baniasadi等[40]在6个区域种植了50种非转基因玉米品种,随后利用非靶向代谢组学探究了种植环境和遗传因素对其影响。结果表明相比于遗传背景,种植环境对玉米谷粒的代谢组影响更大。Chang等[41]利用代谢组学和脂质组学方法对农药胁迫不同时间后非转基因和转基因水稻叶片上的代谢应答进行了分析,证明了转基因确实会对农药胁迫下水稻的代谢应答产生影响。
此外,代谢组学技术还被用于动物科学和食品科学等研究领域。如Sun等[42]利用代谢组学技术对食用常规饲粮和高脂肪饲粮的猪的尿液、粪便和血浆进行了聚类分析,发现了氨基酸类、脂质类和胆汁酸等代谢物可作为不同饲粮喂食后猪代谢絮乱差异的生物标志物。De Pascali等[43]通过代谢组学技术对喂食5种混合药物后的仔猪尿液进行了差异代谢物分析和评价。同时,代谢组学也为食品中营养及功能成分的作用机制和代谢途径的研究提供了可能。例如,Xia等[44]利用代谢组学手段确定了马奶发酵为马奶酒过程中的7个关键代谢途径,并揭示了初级胆汁酸和γ-亚麻酸等功能代谢物的下调与马奶及马奶酒的功效有直接关联。除了功能性营养成分,风味也是影响食品品质的关键因素之一。Potts等[45]通过液质联用技术鉴定到乳清酸、泛酸、马尿酸和对甲酚硫酸酯4种化合物对脱脂牛奶、低脂牛奶、全脂牛奶等的口感和风味有很大影响。
1.2 质谱成像技术
质谱成像技术,亦称为成像质谱技术,是最近发展起来的一门新兴成像技术,已被广泛用于动物组织、植物组织、甚至单细胞中药物、代谢物、多肽和蛋白的时空分布研究。为了避免与离子淌度谱(Ion mobility spectrometry,IMS)技术混淆,本文中统一将其表述为MSI。早在1967年,Liebl等[46]就利用二次离子质谱(Secondary ion mass spectrometry,SIMS)对元素和小分子有机物进行了成像分析。但直 到1987年,Tanaka等[47]和Karas等[48]发 明了基质辅助激光解吸/电离(Matrix-assisted laser desorption/ionization,MALDI)技术,实现了对分子量大于10 kD蛋白的测定,开创了将MALDI质谱技术用于生物大分子检测的应用中。在20世纪90年代初,Spengler等[49]和Caprioli等[50]才真正意义上将MALDI技术与MSI技术相结合并应用到生物组织中小分子、多肽和蛋白成像,由此开启了MSI的新纪年。此后该技术得到了不断的发展和应用拓展,时至今日MSI已成为最热门且活跃的交叉学科研究领域之一。
目前,按照离子源不同,常将MSI分为以下几种:MALDI-MSI、SIMS成像、解吸电喷雾电离质谱成像(Desorption electrospray ionization MSI,DESI-MSI)、激光溅射-电喷雾电离质谱成像(Laser ablation electrospray ionization MSI,LA-ESI-MSI)等。其中,MALDI-MSI已成为当前最主流且应用最广泛的一类技术。首先,根据动/植物组织样品性质不同选择合适的样品制备,如针对动物组织(脑、肾脏等)和植物组织(根、茎等)进行冷冻切片(厚度约为5-20 μm),针对叶片和花瓣等植物组织进行压印转移[49];根据待测物种类和性质选择合适的MALDI基质进行喷涂;采用激光束对每个采样点进行解吸采样并使其离子化产生离子;随后,通过XY二维平台对组织样品进行移动,通过质谱仪对待测物离子进行分离和检测,获得与样品空间位置相关联的质谱图;最后,将所有的质谱数据与其相应的二维空间位置进行匹配重组便可获得MSI图。MALDI-MSI的基本原理是将能吸收337 nm或355 nm紫外激光的基质分子与待测物混合形成共晶,利用基质分子吸收激光能量以防止多余能量直接作用在待测物分子使其发生碎片。因此,MALDI技术因其具有软电离特性、超高的检测灵敏度和耐盐性好等优点而被广泛用于蛋白、核酸等生物大分子分析。事实上,1997年Caprioli等[50]就利用MALDI-MSI实现了小鼠胰腺组织中胰岛素和小鼠脑垂体中激素肽的空间分布成像。随着MALDI基质的不断开发和质谱仪器的迅猛发展,使得该技术在内源性代谢物、脂质、外源性药物等小分子成像中得到了广泛的关注和发展。受限于激光聚焦光斑大小和共结晶颗粒大小,MALDIMSI的空间分辨率一般约为20 μm。
SIMS是目前为止具有最高空间分辨率的一种质谱成像方法。根据离子束类型和束流大小不同可分为动态SIMS和静态SIMS。前者通常使用高能溅射离子束,如O-源(正离子模式)和Cs+源(负离子模式),可获得低至50 nm的超高空间分辨率。但由于离子束束流很大,具有极强的破坏性,会将所有分子全部打碎成单原子离子或多原子离子,因此只适用于元素成像。考虑到采用元素来代表完整分子进行空间定位,常受到其他背景元素的干扰,因此无法真实反映细胞内代谢物分子的原始分布。此外,尽管动态SIMS拥有目前为止最高的空间分辨率,但由于其无法获得完整分子信息,在代谢物和生物大分子成像领域应用仍十分受限。为此,以多原子离子束(等)[51-52]和团簇原子离子束等)[53-54]为核心的静态SIMS很好地补充了上述动态SIMS成像分析的不足,可用于分子量小于1000 Da的脂质、代谢物、小分子药物和部分元素的单细胞成像分析[55]。虽然静态SIMS成像对元素和分子碎片可实现低至亚微米级的空间分辨率,但受限于较低的电离效率,其在完整分子水平的空间分辨率仍停留在低微米量级,因此在空间分辨代谢组学研究中仍有待进一步发展。
与MALDI-MSI和SIMS成像技术都在高真空下进行有所不同,DESI-MSI在大气压下即可实现待测物分子的离子化和成像,样品前处理简单,适合小分子和大分子分析,可实现真正意义上的原位分析。2004年,Nanita等[56]首次报道了DESI源,其基本原理是萃取溶剂在雾化气和电压的作用下形成电喷雾,并以一定角度喷扫样品表面,当二者接触时溶剂可以快速地将待测物溶解并形成带电液滴,随后带电液滴以合适的角度进入质谱进样口,从而被质谱检测。因其工作于常温常压下,且无需复杂样品前处理和基质辅助,DESI-MSI被广泛用于动/植物组织成像中。然而,DESI-MSI也有一些不足之处,例如电喷雾溶剂组成对不同的待测物可能存在解吸和离子化效率差异;其次,考虑到电喷雾液滴到达组织样品表面时存在扩散,因此DESI-MSI空间分辨率一般约为200 μm,较适合于大组织样品的成像。尽管Laskin等[57]采用了解吸纳喷源可将空间分辨率提高至12 μm,但普适性和操作性仍十分局限。
激光采样技术因其具有高空间分辨率、高重复频率和高能量输出而被广泛应用于质谱成像应用中。2007年,Nemes等[58]首次提出了LA-ESI源,并于2009年将其用于植物细胞的整体代谢物检测[59]。其基本原理是采用聚焦透镜或者刻蚀后的光纤对波长为2.94 μm的远红外激光进行聚焦和传输,由于植物组织中含有的大量水分子可与该波段激光发生共振吸收,从而将植物组织甚至细胞液中代谢物溅射出来,随后辅以一路垂直方向的ESI源对其进行后电离,并进入采样口被质谱检测。相比于DESIMSI,LA-ESI-MSI技术的空间分辨率得以大幅提升,Shrestha等[60]以50 μm的空间分辨率实现了洋葱表皮细胞间槲皮素和花青素等代谢物的差异性分布。Coello等[61]采用800 nm飞秒激光进行非共振溅射采样,实现了A. cepa表皮细胞的高分辨成像(空间分辨率为10-15 μm)。与DESI源相似,LA-ESI技术的优势在于可在大气压下直接分析且无需复杂的样品前处理过程,但该方法要求组织样品必须含有一定水分(与2.94 μm远红外激光共振),尽管可采用非共振飞秒激光弥补这不足,但其昂贵的激光器成本不容小觑。同时,有限的空间分辨率(50-100 μm)使得该方法一般较适合于植物细胞的整体分析和较大植物组织的成像分析。
2 空间分辨代谢组学技术的前沿应用
2.1 动物组织
尽管代谢组学已被广泛用于动物组织和病理组织应用中,但由于缺少空间维度信息导致无法准确反映组织的动态代谢过程以及代谢网络。目前,空间分辨代谢组学在动物组织中的应用主要是研究肿瘤组织代谢通路、监测外源性药物分子在组织内的吸收(Absorption)、分布(Distribution)、代谢(Metabolism)和排泄(Excretion)即ADME过程、候选药物评价等。如表1所示,在细胞癌变的发生和发展过程中,癌细胞会改变自身代谢模式以适应其生长,而代谢重编程则是维持其无限增殖的关键机制。许多研究表明,肿瘤细胞相比于正常细胞往往具有独特的代谢模式和特征[15]。为此,Sun等[15]利用基于空气动力辅助解吸电喷雾电离(Airflow-assisted desoprtion electrospray ionization,AFADESI)的质谱成像技术,建立了空间分辨的代谢组学方法,并以“上游代谢酶与下游代谢物相关联”的研究策略对食管癌异常的代谢通路进行了可视化分析。作者以256例人鳞片状食管癌组织样品为研究对象,利用AFADESI-MSI技术筛选出与癌细胞代谢相关的差异代谢物,揭示了包括脯氨酸合成,谷氨酸代谢,尿苷代谢,组氨酸代谢,脂肪酸合成和多胺生物合成在内的6个代谢通路都在食管癌组织中发生了明显的变化。同时,还验证了与之密切相关的6个异常表达的代谢酶,它们都广泛参与了食管癌相关的代谢过程。因此,空间分辨代谢组学可以高通量地发现肿瘤组织异常变化的代谢通路,从而为深入探究肿瘤的代谢过程提供全新的研究视角。Sun等[62]还利用基于质谱成像的代谢组学策略对乳腺癌中肉碱的新陈代谢重编程过程进行了可视化。代谢组学结果显示,不论是在人体还是小鼠模型中,左旋肉碱和短链肉碱都在乳腺癌组织中发生重新编程。此外,还发现了3个异常表达的代谢酶,包括肉碱棕榈基转移酶1A,肉碱棕榈基转移酶2和肉碱乙酰转移酶,都直接参与了脂肪酸的氧化过程。Morse等[63]还利用DESI-MSI技术对前列腺癌组织进行了空间分辨代谢组学分析,鉴定得到25个具有明显差异分布的代谢物,其中脂肪酸和脑磷脂在癌组织中显著上调。
除了动物组织中内源性代谢物外,了解并监测外源性药物分子在组织内的ADME过程,对于候选药物评价和新药研制至关重要。Wang等[64]利用AFADESI-MSI技术对服用马兜铃酸I药物后的小鼠肾脏组织进行了空间代谢组学分析。结果表明,经过药物处理后的小鼠肾脏组织,其与精氨酸-肌酸酐代谢途径、尿素循环、丝氨酸合成途径、以及与脂质、胆碱、组胺、赖氨酸和ATP代谢相关的38种代谢物都发生了空间分布的变化。此外,探究同分异构体药物在体内的作用机制和代谢差异对于质谱技术具有一定的挑战性。Luo等[65]利用相同的方法针对两种镇静催眠同分异构体药物(YZG-331和YZG-330)及其代谢物在整只小鼠切片的空间分布进行了成像。
2.2 植物组织
植物组织中的初生和次生代谢物对于维持其生长、繁殖、营养和生理功能都具有紧密的关联。因此,对植物组织中代谢物的精准定位和含量测定,对阐明代谢物的合成及调控机制具有重要意义。目前,空间分辨代谢组学在植物组织中的应用主要是代谢物的精准定位、重要功能代谢产物的生物合成和转运途径、功能基因验证等(表1)。理想的生物分析方法是无需进行样品前处理,就能提供空间分辨的定量信息。实际上,依靠单一的分析方法通常无法满足所有需求。Berisha等[66]在不进行样品制备的情况下,利用LA-ESI-MSI技术得知花青素主要分布在外表皮,利用色谱-质谱联用技术对蓝莓中包含氨基酸、碳水化合物和花青素在内的41种代谢物进行鉴定。Li等[67]利用MALDI-MSI技术对光果甘草根茎组织中黄酮苷元、黄酮苷和皂苷类化合物的空间分布进行了成像。结果表明,与黄酮苷类化合物主要分布在韧皮纤维和木纤维中不同,黄酮苷元类化合物则主要富集在木栓层中。萌发和成熟是种子生长发育过程中代谢高度活跃的两个阶段,而种子质量又与植物的生长发育状况密切相关。为此,Bhandari等[68]对油菜种子发育过程中不同代谢物的空间分布及动态变化进行了研究,揭示了环亚精胺和三咖啡亚精胺会在种子萌发过程中从种子的胚轴胚根区移动到刚要萌发的幼根上,为阐明植物不同生长发育过程中代谢物的动态变化提供了强有力的研究手段[68]。Li等[69]通过对银杏叶片内黄酮类化合物进行空间分辨代谢组学分析,揭示了银杏特有的穗花双黄酮和白果素等双黄酮类化合物只富集在叶片表面。最近,Dai等[70]利用微型样品制备装置,将完整叶片分别裁切出多个1.7×1.7 mm2小叶片分别进行代谢组学分析,开发了一种单叶片靶向空间分辨代谢组学方法。该方法实现了儿茶素、生物碱等56种代谢物的空间分布和定量分析,并证明了儿茶素、槲皮素苷和槲皮素可能参与了茶树对生物/非生物胁迫的防御反应。

表1 空间分辨代谢组学技术在动/植物组织、单细胞中最新应用汇总

表1 续表
除了精准定位植物体内代谢物的空间分布,综合运用质谱成像技术与多组学技术,探究代谢产物的生物合成、转运和积累规律,可为发掘关键代谢物的生物合成途径和解析重要酶功能提供重要的科学依据。例如,Li等[71]首次揭示了芍药根中五~九没食子酰葡萄糖等没食子酰单宁类物质的空间分布。除了五没食子酰葡萄糖主要分布在芍药根中,其他4种没食子酰葡萄糖只聚集分布在木栓层和木质部,为探究芍药中没食子酰单宁类物质的合成、转运及积累规律提供了重要的参考依据。此外,Li等[69]还结合基因表达分析和MSI结果,证实了银杏内脂等物质先在根中进行合成,随后从茎转运到叶片中。Kusari等[72]利用MSI技术揭示了两种金丝桃属植物(H. perforatum和H. olympicum)中金丝桃素(hypericin)等二蒽酮类化合物的前体物质大黄素主要分布在叶片表面除腺点外的广泛区域;然而,在缺少金丝桃素及其衍生物的H. patulum植物中,大黄素只聚集在叶片表面的腺点中。这一实验结果验证了之前的假说:金丝桃素是在叶片腺点之外的部位进行生物合成,再经转运和积累在腺点中。油籽工程成分的改变是通过引入新的酶反应或者阻断/促进现有酶反应进行的。然而在实际过程中,种子中积累的脂类种类数量往往与酶表达水平所预测的不同。为此,Woodfield等[73]利用MSI技术发现油菜(Brassica napus)的三酰基甘油及其磷脂前体在子叶和胚轴中分布不同,暗示了三酰基甘油代谢存在组织特异性。棕榈酸主要分布于胚轴处,而异油酸、亚麻油酸和α-亚油酸等优先定位于种皮和糊状层。此外,Horn等[74]还揭示了脂质分布在细胞水平上的异质性可能普遍存在,通过对陆地棉种子组织中的多种脂类物质(如三酰基甘油、磷脂酰乙醇胺、磷脂酸、甾醇和棉酚等)进行MSI分析,发现三酰基甘油和磷脂酰胆碱主要贮存于棉花胚胎。最近,Dong等[75]利用超高质量分辨率MALDIMSI方法对番茄果实中甾体糖苷类生物碱(Steroidal glycoalkaloids,SGAs)的合成途径进行了可视化分析,通过比较GAME25基因沉默型和野生型的番茄果实中SGAs的空间分布差异,证实了GAME25基因确实会导致饱和SGAs朝非饱和SGAs转化途径移动。Korenblum等[76]利用相同的方法对不同微生物群落诱导番茄根系分泌物的特异性变化进行了分析,揭示了Acylsucrose S1:5主要分布在侧根尖,而Acylsucrose S4:19主要分布在主根的根毛上;与之相反,SGAs、木脂素、羟基肉桂酸和有机酸等代谢物在整个根部都有积累。Schleyer等[77]利用MSI方法揭示了海洋球石藻(Emiliania huxleyi)与其特定病毒之间的宿主-病毒相互作用的代谢机制。以叶绿素和7个脂质类分子作为生物标志物,动态监测了整个病毒感染过程。
除了对植物自身代谢物的转运和积累过程进行可视化外,还可利用MSI技术对病虫害侵染之后的植物应激代谢物进行探究。Barbosa等[78]比较了受根结线虫侵染和未受根结线虫侵染的番茄根节中次生代谢物、多肽和蛋白的空间差异分布,揭示了根结线虫侵染后会使得某些多肽和蛋白表达量下调,且脂类代谢物的种类和丰度也明显下降。Shroff等[79]结合MSI和高效液相色谱分析,发现了几种主要芥子油甙在叶片的中脉和边缘分布比内部位置更多,而芥子油甙类代谢物在叶片中分布可能控制了棉铃幼虫的取食偏好,这也解释了为什么棉铃虫几乎不食用拟南芥叶片的中脉和边缘,只食用内部叶片。芥子油甙类代谢物的差异性分布可能对叶片的防御机制起到了重要作用,避免食草动物或昆虫经常从叶片边缘开始食用。
2.3 单细胞水平
一切生命的关键科学问题都要到细胞中去寻找。随着质谱仪器空间分辨率和灵敏度的快速提升,使得单细胞分析甚至单细胞成像成为了可能。每个细胞,即使是相同类型的细胞,自身都具有较大的异质性,因此在单个细胞水平上进行研究,不仅可以探究生命科学的起源,还可揭示重大疾病病变机理、生命现象活动规律、靶向药物开发和治疗等科学问题。单细胞中代谢物分析主要分为整体分析和成像分析,前者只能获得细胞与细胞间的代谢物差异,而丢失了它们的空间定位信息;而后者可以进一步洞悉单细胞内或细胞器间代谢物的差异性分布(图2)。然而,不同于单细胞的蛋白组学或基因组学可对待测物分子进行荧光标记和信号放大,即使是对单细胞进行整体分析都十分具有挑战性。目前,空间分辨代谢组学在单细胞中的应用主要是内源性代谢物和外源性药物分布、功能性代谢物的从头生物合成过程监测、纳米载药诱导癌细胞凋亡等。
Mizuno和Masujima等[80-81]于2008年首次提出了“Live single-cell video-mass spectrometry”策略,即先在高倍显微镜下利用1-5 μm曲率直径的毛细管针尖对单个细胞进行采样,随后将其作为纳喷针直接进行电喷雾电离质谱分析。结果表明,在正离子模式下可检测到66个颗粒体特异的谱峰和8个细胞质特异的谱峰。随后,他们对7种不同细胞的不同位置进行了主成分分析实现了细胞的聚类和鉴别。Gong等[82]结合了固相微萃取(Solid-phase microextraction,SPME)技术,开发了探针电喷雾离子源。将直径约为1 μm的SPME探针插入活细胞中对代谢物进行富集,随后辅以ESI将富集得到的代谢物直接电离检测,灵敏度可提高近30倍。利用该方法可实现单个洋葱细胞中多种代谢物的测定(如6种果聚糖、4种脂质和8种黄酮类衍生物等)。还发现了不同细胞类型之间及同一细胞不同细胞器之间的代谢物差异显著,内表皮细胞相比外表皮细胞具有20倍含量更高的果聚糖,而外表皮细胞则含有较多的脂质成分。此外,Wei等[83-84]进一步将直流电压改成脉冲电压和阶梯升压形式,有助于快速移除细胞液中基体分子,还可延长分析时间,仅需pL级的单细胞液体便可同时获得一级谱图和串级谱图,从而实现单个洋葱细胞中162种代谢物和28种不同修饰多糖分子的精确鉴定。

图2 激光采样的空间分辨率对单细胞质谱成像的影响[85-88]
除了细胞间代谢物组成和含量的差异分析,我们更希望进一步探究细胞内分子的差异性分布,特别是内源性代谢物分布、外源性药物及其代谢产物的作用位点信息。然而相比于单细胞整体分析,要想实现单细胞质谱成像就要求其具有超高空间分辨率(采样的激光光斑或离子束斑小于1 μm)且绝对检出限应达到amol量级[85]。2012年,Schober等[86]将MALDI技术用于HeLa细胞成像中,对DIOC6荧光染料分子可实现空间分辨率为7 μm的成像分析,虽然也可以获得一些脂质分子的成像,但7 μm的分辨率对于单细胞来说仍然无法提供太多空间分布细节;2017年,Kompauer等[87]进一步优化质谱仪器系统,对单细胞中如甘油一/二酯、卵磷脂、神经酰胺和小肽等实现了1.4 μm的高空间分辨率成像,共检测到P. caudatum和Rotifera细胞中19个内源代谢物。为了进一步突破光学衍射极限,国内Yin等[88]研制了一台基于纳米有孔光纤的近场激光解吸后电离飞行时间质谱仪,并将其应用于单细胞的化学-形貌共成像分析。该仪器兼具高传输效率(高真空采样)、高电离效率(157 nm单光子后电离源)和高空间分辨率(~ 350 nm),可实现成像分辨率高达250 nm、绝对检出限低至亚amol的单细胞药物成像分析。首次在真空下将原子力显微镜和质谱仪合二为一,自带的原子力成像功能使其可同时获得单细胞表面三维形貌图,大大拓展了MSI技术在单细胞水平的综合表征能力。Cheng等[89]利用该仪器揭示了具有相似结构的两种吖啶类药物在HeLa细胞内分布规律完全不同,且荧光成像无法获得依沙吖啶药物的空间分布,进一步证明了质谱成像技术的无标记、广谱性等优势。同时,还实现了单细胞中金纳米粒子(AuNPs)和银纳米粒子(AgNPs)的分布成像[90]。最近,Meng等[91]成功研制出了微透镜光纤激光解吸/电离成像质谱仪,实现了对细胞内多种内/外源性的元素和分子在细胞器水平上的可视化定位。该方法在单细胞表面可得到低至350 nm直径的采样弹坑,且对2 μm起伏高度的实际样品可保持均匀剥蚀,避免了由于高度起伏造成的成像假象。将抗癌药物红霉素负载在叶酸信号分子修饰的超顺磁性氧化铁纳米颗粒表面,并与HeLa细胞共同培养,利用MSI技术对靶向药物从纳米颗粒表面释放进入细胞质,而后进入细胞核,并最终诱导癌细胞凋亡这一动态过程进行了直接可视化。
萜类吲哚类生物碱(Terpenoid indole alkaloid,TIA)是一类具有重要生物活性的化合物,为此,Yamamoto等[16]利用质谱成像技术和单细胞代谢组学技术,对长春花药用植物中TIA等抗肿瘤药物及其中间产物在单细胞水平进行了空间定位。结果表明,长春碱、Serpentine、Ajmalicine和Vindoline等TIA中间体,主要积累在异形细胞和乳管细胞中。以嘌呤小体为代表的代谢区室,是指由代谢途径的顺序酶组成的多蛋白复合物,亦被科学界广泛认为是细胞内生物合成的“热点”。最近,Pareek等[92]利用空间分辨代谢组学手段,直接可视化观测了嘌呤小体对功能最丰富的细胞代谢产物——嘌呤的从头生物合成过程。结果表明,嘌呤小体是由9种协同作用的酶组成,引导中间体合成嘌呤核苷酸,提高了整个通路的运行速率和通量,并影响一磷酸腺苷/鸟苷的比例。质谱成像结果揭示了嘌呤的产生聚集于细胞的嘌呤小体内,靠近线粒体的嘌呤小体可能是嘌呤从头合成的活性中心。该研究也是第一次整合单细胞质谱成像和代谢组学技术证明了嘌呤小体的存在,有助于更好地理解嘌呤小体这一代谢区室在癌症发病和治疗发挥的作用,并对开发新的癌症治疗策略具有重大意义。Geier等[93]以单个深海贻贝上皮宿主细胞与共生细菌(如甲烷氧化菌和硫氧化菌等)为研究对象,利用空间分辨代谢组学技术一共获得了约2500个代谢物信息,并通过聚类分析将其划分为7个簇,其中4个簇与宿主相关,3个簇与共生菌相关。同时,绘制了它们的空间代谢组图像,揭示了宿主细胞对共生体的代谢适应和细菌的代谢表型变化,并从宿主-微生物界面发现了新的代谢物。随着MSI空间分辨率的不断提高,使得空间分辨代谢组学有望实现单细菌分辨的分析。
3 空间分辨代谢组学技术的现有瓶颈
3.1 空间分辨率与检测灵敏度
要实现植物组织甚至单细胞的高分辨质谱成像分析,最重要的就是提高MSI的空间分辨率,即要求采样的激光光斑或离子束直径尽可能地小(图2)。但仅提高空间分辨率是远远不够的,因为采样面积的缩小会带来另一个制约问题,即质谱仪器的检测灵敏度和可采样的分子数。事实上,随着MSI中每个像素点的采样量降低,由此获得的分子离子数目会大幅降低。因此,相比于空间分辨率的提高,如何在有限的采样量前提下进一步提高质谱仪器的检测灵敏度更为重要。表2所示为常用质谱成像技术的空间分辨率、样品制备要求、最佳检出限和适用分子种类等信息。由于传统的激光光束和一次离子束等离子源电离效率较低(一般为10-5-10-3)[85],因此寻求可提高分子电离效率的手段就显得尤为重要。多种后电离技术的发展也为高空间分辨质谱成像分析提供了可能。通过将激光解吸采样过程和电离过程在时间和空间维度上分开,选择不同波长、能量、脉宽的激光作为后电离源,可大幅提高质谱方法的检测灵敏度。Soltwisch等[94]将波长可调谐的激光束引入到商品化MALDI仪器作为后电离源(MALDI-2),显著提高了电离效率、拓宽了可分析的分子种类。针对动物和植物组织中脂质分子、维他命、多糖等电离效率提高了1-2个数量级,空间分辨率可达5 μm。随后,Spivey等[95]和Niehaus等[96]将透射式质谱成像技术和激光后电离源整合一起,实现了小鼠脑部、肾脏切片以及Vero B4细胞中多种磷脂和糖脂的亚微米级质谱成像分析。最近,Yin等[97-98]采用第二束激光作为后电离源可以显著提高待测物的电离效率,首次实现了亚纳米级平均溅射率,对15种镧系元素混合残渣可获得~ng/mL的相对检出限和fg量级的绝对检出限。高空间分辨率和高检测灵敏度是质谱成像技术永恒的追求,尽管目前已有多种基于纳米粒子辅助[99-101]、激光电离[88,90,94]、电喷雾电离[4,102]等报道出来并取得了很大的进展,但仍需开发更多提高检测灵敏度的方法,才能满足高空间分辨成像的需求,并将MSI技术推向单细胞分析领域。

表2 常用质谱成像技术的空间分辨率、样品制备要求、最佳检出限、适用分子种类等信息汇总
3.2 空间分辨率、质量分辨率和分析时间
在MSI分析中,仅仅依靠高空间分辨率是不足以实现精准分析的。考虑到MSI技术常用于分析复杂的生物组织样品,缺少足够高的质量分辨本领势必会导致相邻m/z谱峰交叠,从而造成分子鉴定困难和假阳性结果。因此,高质量分辨率和高质量精度是实现化合物鉴定的必要条件,由此提供可靠和高置信度的质谱数据。同时,高空间分辨率即要求一张MSI图中具有更多的像素点(例如空间分辨率提高10倍,总像素点相应会提高100倍),此时分析时间会大大增加。因此,在MSI分析中必须兼顾空间分辨率、质量分辨率和分析时间三者之间的关系。由于飞行时间(Time-of-flight,TOF)质量分析器具有高灵敏度、高分析速度、多分子同时检测、理论上无质量检测上限等优势,目前大多数的质谱成像仪器都是与TOF质量分析器相结合。同时,考虑到脉冲激光离子源和TOF本身所具有的脉冲特性完美匹配,使它们二者的结合体成为了MSI技术中发展最为迅猛且应用领域最为广泛的质谱仪器。但由于高激光能量常常会造成较高的离子动能分散,因此TOF的质量分辨率和质量精度有限。随着日益增长的复杂生物样品的分析需求,越来越多的课题组也开始将MSI技术与具有更高质量分辨本领和质量精度的质量分析器结合,例如傅里叶变换离子回旋共振(Fourier transform ion cyclotron resonance,FTICR)和轨道阱(Orbitrap)等,可提供高于10万的质量分辨率和优于1 ppm的质量精度。但由于FTICR和Orbitrap都属于扫描类型的质量分析器,因此高质量分辨率的获取常常是以较长的扫描时间为代价,这无疑对高空间分辨MSI技术的分析通量造成了一定的困扰。为此,近年来有越来越多的研究者开始了新仪器的研制。例如,针对TOF质量分辨率有限的问题,Plaβ等[103]研制了多重反射飞行时间(Multiple-reflection TOF,MR-TOF)质谱,可将质谱分辨率提高至10万以上。尽管如此,不同的质量分析器往往具有不同的分析能力和局限性,因此将两种不同的质量分析器合二为一提供多种成像模式也是一种可行的方法。Passarelli等[104]结合了Orbitrap和TOF的优势,研制了一台OrbitrapSIMS仪器,当需要高通量的MSI分析时可选择TOF成像模式;当需要高质量分辨率的MSI分析时可切换为Orbitrap成像模式,很好地克服了空间分辨率、质量分辨率和分析时间三者的制约关系。因此,在实际MSI分析中,需要对空间分辨率、质量分辨率和分析时间三者进行综合考虑,以期获得高通量、高质量的成像数据。
3.3 串级质谱与分子鉴定
相比于以色质联用为基础的代谢组学分析技术,MSI的另一个不足之处在于分子的精确鉴定。由于缺少样品前处理和色谱分离过程,光靠MSI分析有时候很难对未知化合物进行准确鉴定。虽然直接进行MSI分析可大大简化样品处理步骤,但由此带来的严重离子信号抑制却不容小觑;另一方面,由于固体直接采样的电离效率有限且缺少色谱分离富集过程,可检测到的代谢物数量和区分同分异构体的能力都相对有限。目前,常用的一种互补方法是同时对整体组织进行提取和基于色质联用的代谢组学分析。但值得注意的是,MALDI-MSI仅采样非常薄的表层样品,所以代谢组学分析所获得的完整组织成分及含量可能与表面成像分析结果存在一定的差异。此外,植物组织中常常共存多种代谢物同分异构体,这也使得精准化学鉴定更加困难。虽然部分同分异构体可通过色谱进行分离,但在分辨率较低和缺少串级质谱功能的MSI仪器中则无能为力。为此,可通过以下3个方面来显著提高MSI技术对未知代谢物的鉴定能力。首先,第一种是通过提高MSI中提取质量数的质量精度来实现,这一策略常常要求质谱仪器具有较高的质量分辨率。例如,C29烷烃和C28醛类化合物间质量差仅为0.036 Da,此时可以结合高分辨质谱和较窄的质量窗(如±0.01 Da)来实现二者的差异成像[71,105]。第二种是采用串级质谱(MS/MS)成像,当采用单级质谱用于成像分析时,仅靠m/z信息常常无法对代谢物进行精确鉴定,而MS/MS可提供补充的碎片信息,从而结合数据库和文献报道数据来实现未知代谢物和同分异构体的鉴定[106]。第三种方法是结合离子淌度谱(Ion mobility spectrometry,IMS)技术,来提供另一维度的气相分离过程,在同分异构体鉴别中已被广泛使用[107-108]。例如,Mclean等[109]利用多肽离子和脂质离子在IMS气相分离中的些许差异,实现了二者的MSI分析。尽管IMS可在气相分离方面提高MSI的分子鉴定能力,但IMS分辨率较低和碰撞截面(Collision cross section,CCS)数据库缺失仍限制了其进一步发展。为此,Giles等[110]研制了环形IMS仪器,可将IMS的分辨率从~ 50提高到~ 750,大大拓展了该技术的分辨本领和应用领域。此外,由于串级质谱技术的引入会产生大量的数据集,因此针对空间信息和分子碎片信息开发自动谱图解析方法,对于实现高通量的MSI分析尤为重要[111]。
3.4 空间分辨率与单细胞组学分析
传统的单细胞整体分析(Single-cell profiling)已经无法满足科学家们的好奇心,我们需要深入洞悉代谢物或关键分子在细胞间,甚至是细胞器间的差异表达和空间分布,这也推动了对单细胞水平的空间分辨代谢组学方法的开发。虽然基因组学和转录组学发展迅猛,但单细胞水平的代谢组学进展则相对滞后,这主要是因为信号放大和分子标记策略不适合于动态变化的代谢物分子。同时,单细胞中代谢过程十分迅速,在采样分析过程中难以保证其代谢物含量不发生变化,因此对单细胞中代谢物进行定量分析仍然存在困难。此外,单细胞尺寸极小(哺乳动物细胞直径约为20 μm,植物细胞直径约为100 μm)、体积量极少(约为pL量级)、代谢物含量极低(fmol-amol)且浓度范围差异大(pmol/L-mmol/L),也对单细胞分析造成了极大的挑战。尽管目前最新质谱仪器的检出限可达amol量级,但考虑到单细胞内复杂的环境和含量差异极大的代谢物种类,单细胞质谱分析技术仍有待进一步开发。首先,应提高质谱技术对单细胞内代谢物的检测灵敏度,例如采用富集萃取方法[82,112]、纳米材料及纳米阵列基底[100]等。Ibáñez等[113]采用高密度微阵列基底靶对单个酵母细胞中ADP/ATP代谢过程进行了高通量监测。Walker等[114]利用纳米阵列图案作为样品基底靶,对单个酵母细胞中包括富马酸、吲哚、胞啶在内的24个代谢物进行了高灵敏检测。其次,要进一步提高质谱技术的空间分辨率(达到亚微米级),例如采用极紫外激光[115-116]、近场激光离子源[88-90,117]等。Kuznetsov等[115]采用46.9 nm极紫外激光对单个分支杆菌中两个代谢物碎片进行了三维成像,空间分辨率为75 nm,深度分辨率为20 nm。Yin等[88]利用近场激光离子源对单个HeLa细胞中原黄素药物进行了高分辨率成像,揭示了药物分子只富集在细胞质内未进入细胞核。
3.5 质谱成像定量分析
基于色质联用的代谢组学方法常用于动/植物组织中代谢物的定量分析,然而MSI技术更适合于代谢物的定性分析。虽然MSI在数据处理、代谢物信息提取以及精准分子鉴定方面都取得了长足的发展,但由于组织异质性、基质沉积均匀性、样品形貌起伏、基体效应、离子抑制效应以及不均一的离子化效率,都使得MSI的定量能力仍面临较大的挑战[118]。在发展定量MSI技术之前,传统的MSI定量分析常常是将感兴趣的目标区域从动/植物组织上切割出来,随后消融进行色质联用定量检测[119]。一旦得知目标化合物的绝对量后,再根据该区域的MSI信号强度进行数据换算。虽然该方法被广泛使用,但分析步骤较为繁琐。目前,定量MSI方法主要可分为相对定量和绝对定量,前者是通过直接比较不同组织切片上目标分子的信号强度,但这类方法常常由于组织样品中存在其他的干扰分子、较强的基体效应和离子抑制效应,导致在定量精度上存在较大的偏差。对此最常用的方法是对数据进行归一化处理,可降低由于基质沉积不均匀或者离子抑制效应导致的像素点间信号强度差异,这一策略目前已被用于核苷酸、脂质、酶切肽段及其他小分子等分析[120]。多种MSI数据处理软件都可提供归一化计算功能,例如SciLS软件可以在数据分析前先对各个感兴趣离子和总离子流进行归一化,从而更加真实地反映代谢物在不同组织上的含量信息。值得一提的是,不同组织部位间基体效应不同所导致的信号强度差异,可能会影响不同组织间测得的含量差异[118]。
相比于相对定量,准确测得MSI中某一特定分子的真实含量则困难得多,特别是考虑到不同种类分子常常具有不同的电离效率。与传统代谢组学定量分析类似,通过引入与待测分子理化性质相近的内标化合物有助于提高定量准确度[121]。由于具有相似结构的化合物常被认为具有较一致的电离效率,因此可根据目标分子的结构选择合适的内标物,进而实现更为准确的定量分析。Bergman等[122]通过在纳喷雾溶液中加入氘代试剂,对小鼠脑部组织切片中神经递质(如乙酰胆碱、氨基丁酸和谷氨酸等)进行了DESI-MSI定量分析。理想情况下,MALDIMSI分析也可通过绘制外标曲线来进行化合物的定量,然而由于缺少了样品基体及其自身可能存在的异质性常会导致定量失准。为此,Chumbley等[123]通过在肝脏组织上沉积不同量的氘代内标物来获得外标曲线,兼顾了组织的基体效应和不同部位的异质性。Maeno等[124]采用喷墨印刷技术将稳定同位素标记的内标物分子均匀地沉积在角质层样品上,实现对天然保湿因子的直接定量分析。尽管如此,考虑到组织样品间的复杂性和不均一性,定量MSI分析仍是目前的研究难点。此外,由于MSI技术大多属于固体采样,因此其灵敏度和检出限往往与传统代谢组学分析存在一定差异,因此二者的定量信息匹配仍是空间分辨代谢组学发展的重点和难点之一。
4 总结与展望
目前,质谱成像技术已成为动/植物组织甚至单细胞中代谢物分析的强有力工具,为传统代谢组学分析提供了全新的可视化视角和多维的信息深度,也为动物组织中外源性药物和植物组织中内源性代谢物的转运途径、代谢通路和积累规律提供了新技术和新方法。随着质谱成像技术空间分辨率和质谱仪器检测灵敏度的不断提升,使得空间分辨代谢组学逐渐朝单细胞代谢组学分析方向发展。单细胞代谢组学因其种类丰富多样、代谢过程快速、含量极低且无法对其进行信号放大和荧光标记,仍然是当前研究的热点和难点。随着高空间分辨质谱成像技术的不断发展和完善,相信该技术将会在植物细胞研究中展现更广阔的应用前景。
