一株红孢囊藻(Rhodosorus sp. SCSIO-45730)总糖和β-葡聚糖的积累特性研究
2021-01-22代禄梅李涛吴华莲吴后波向文洲
代禄梅 李涛 吴华莲 吴后波 向文洲
(1. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室,广州 510301;2. 中国科学院大学,北京 100049;3. 南方海洋科学与工程广东省实验室(广州),广州 511458;4. 中国科学院南海生态环境工程创新研究院,广州 510301)
微藻是一种分布广泛、种类繁多的光合生物,具有生长速度快、能吸收CO2、光合效率高,不与粮食作物竞争土地等特点[1-3];同时,能够合成蛋白质、糖类、油脂、色素等活性物质,在医药、食品、饲料、化妆品、可再生能源等领域具有很好的开发利用价值[4-5]。富含多糖的微藻是生产生物乙醇和β-葡聚糖的理想原料[6-7]。β-葡聚糖是D-葡萄糖通过β-糖苷键连接而成的多糖[8],主要分布在酵母、真菌、植物和藻类中[9]。β-葡聚糖具有抗辐射、抗癌和抗肿瘤活性,以及调节机体免疫、调节血糖和降低胆固醇等功能[10-11]。目前,研究发现微拟球藻和紫球藻是β-葡聚糖的重要来源[7,12]。
营养盐和环境因素(如盐度、温度、光照等)可以影响微藻生长和生物质组成[13]。研究表明,高盐条件可诱导微藻细胞中糖类化合物的积累,如在咸水中培养的螺旋藻(Spirulinasp. LEB 18),其多糖含量是使用Zarrouk培养基时的3.3倍[14]。淡水资源的日益匮乏和可耕地面积的逐年递减正威胁着人类社会的生存与发展,因此,利用海水资源以及大面积待开发利用的盐碱滩涂地对微藻进行规模化培养是一种理想的途径。
本研究以一株新分离鉴定的、含糖量较高的红孢囊藻(Rhodosorussp. SCSIO-45730)为实验对象,从4种培养基中筛选出适合其生长的培养基,在此基础上研究了不同盐度对该藻生长、胞内多糖及β-葡聚糖积累的影响,利用平板光生物反应器进一步评价红孢囊藻(Rhodosorussp. SCSIO-45730)户外生产潜力,以期为红孢囊藻多糖的高值化开发利用提供理论依据。
1 材料与方法
1.1 材料
单细胞红藻(Rhodosorussp. SCSIO-45730)分离自 中 国 南 海 西 沙 海 域 水 体(111°45.000' E,16°28.471'N),现保藏于中国科学院南海海洋研究所海藻资源与生物技术实验室。
1.2 方法
1.2.1 培养条件 微藻于300 mL(Ø 3.0 cm × 60 cm)柱式光生物反应器中进行培养,单侧荧光灯持续24 h照明提供光源,在培养前4 d,光强逐渐从30 μmol photons/m2s增 加 至180 μmol photons/m2s,之后保持在180 μmol photons/m2s,培养温度为(25±1)oC,培养周期16 d,连续鼔入CO2加富的压缩空气(1% CO2,V/V)提供碳源。
1.2.2 实验设计
1.2.2.1 培养基优化实验 以不同盐度的4种培养基(改良后的f/2培养基、Conway培养基、Erdschreiber培养基和ASW培养基)对微藻进行培养。各培养基的组成如表1所示,以南海海域上层海水进行配制(盐度为36‰左右)。在1.2.1条件下进行培养,每组设置3个平行,每2 d测定生物量,培养结束,离心收集藻泥,冷冻干燥并测定总糖和β-葡聚糖含量。
1.2.2.2 盐度适应性实验 以适合红孢囊藻(Rhodosorussp. SCSIO-45730)生长的培养基为基础培养基,分别通过补充去离子水或NaCl进行盐度调节,设置不同的盐度水平(10‰、18‰、28‰、38‰、48‰、58‰和68‰),研究其对该藻生长、胞内总糖及β-葡聚糖积累的影响。在1.2.1条件下进行培养,每组设置3个平行,每2 d测定生物量,离心收集藻泥,冷冻干燥并测定总糖含量和β-葡聚糖含量。
1.2.2.3 户外培养实验 于广州非雨季对微藻进行户外培养评价小试,藻细胞经室内扩种后直接接入户外光径为6 cm的平板式光生物反应器(长120 cm× 高120 cm,有效体积为72 L),培养时间为18 d,连续鼔入含1% CO2的压缩空气提供碳源和搅拌,培养前期采用遮阳布遮挡反应器,随着藻细胞浓度增加,逐渐增加光照面积,培养周期内,白天平均气温为17.7±1.8℃,每2 d测定生物量,每4 d离心收集藻泥,冷冻干燥并测定总糖和β-葡聚糖含量,每天镜检观察杂藻和原生动物情况。
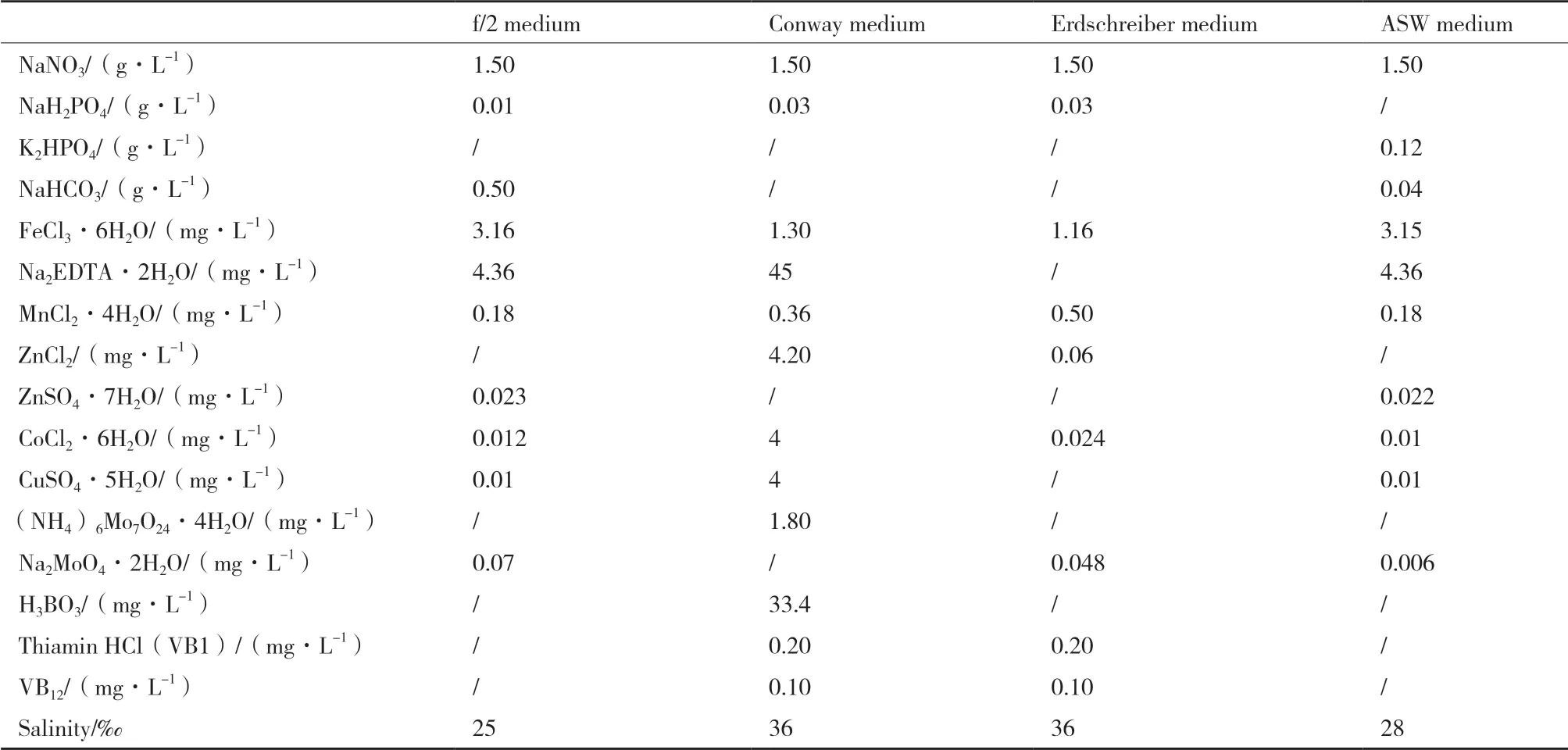
表1 四种不同培养基成分
1.2.3 生物量测定 采用干重法进行测定。取5-10 mL藻液,通过预先称量好的混合纤维过滤膜(0.45 μm)进行过滤,并用去离子水清洗,再将有藻细胞的滤膜放置在80℃烘箱烘至恒重,用减差法得到微藻生物量干重(Dry weight,DW)。
1.2.4 总糖含量测定 取10 mg藻粉,加入5 mL 1 N H2SO4,在80oC水浴搅拌提取0.5 h,8000 r/min离心8 min,收集上清液。反复提取3-5次,合并上清液并定容至50 mL。利用硫酸苯酚法测定微藻总糖含量[15]。
1.2.5 β-葡聚糖含量测定 采用酶试剂盒“Mushroom and Yeast Beta-Glucan Assay Procedure”(K-YBGL 12/16,Megazyme,Bray,Ireland)并按照其说明书中的步骤测定β-葡聚糖含量。具体步骤如下:
1.2.5.1 总葡聚糖含量测定 称取约90 mg藻粉于带盖玻璃螺口试管,加入2 mL冰浴后的12 mol/L H2SO4,冰浴2 h后,加入10 mL H2O,振荡10 s,沸水浴2 h,冷却至室温后转移至100 mL容量瓶,加入6 mL 10 mol/L KOH溶液,并用200 mmol/L NaAc缓冲液(pH5)定容至100 mL。取适量溶液于5000 r/min离心10 min,吸取0.1 mL上清液于另一干净玻璃螺口试管中,加入0.1 mL处理过的bottle 1中溶液(含1,3-β-葡聚糖外切酶和β-葡萄糖苷酶,已按试剂盒说明处理),40oC水浴60 min,加入3 mL GOPOD试剂(按试剂盒说明配制),继续于40oC水浴20 min,在510 nm测定其吸光值。
1.2.5.2 α-葡聚糖含量测定 称取约100 mg藻粉于带盖玻璃螺口试管中,加入2 mL 2 mol/L KOH溶液并于冰浴搅拌20 min,加入8 mL 1.2 mol/L NaAc缓冲液(pH3.8)后,立即加入0.2 mL bottle 2(含淀粉转葡糖苷酶和转化酶),振荡混匀,于40oC水浴30 min,5000 r/min离心10 min。取0.1 mL样品液于另一干净玻璃螺口试管中,加入0.1 mL 200 mmol/L NaAc缓冲液,加入3 mL GOPOD试剂,40oC水浴20 min,在510 nm测定其吸光值。
1.2.5.3 β-葡聚糖含量计算 利用Megazyme网站(www.megazyme.com)下载的Mega-CalcTM计算藻粉中总葡聚糖含量和α-葡聚糖含量,β-葡聚糖含量(%DW)=总葡聚糖含量(% DW)-α-葡聚糖含量(%DW)。
1.2.6 产量和产率计算
总糖产量(g/L)=Mt× Ct
总糖产率(mg/L·d)=(Mt× Ct- M0× C0)/d
β-葡聚糖产量(g/L)=Mt× Gt
β-葡聚糖产率(mg/L·d)=(Mt× Gt- M0×G0)/d
其中,Mt为收藻时微藻的生物质浓度(g/L),Ct为相对应的总糖含量(DW%),Gt为相对应的β-葡聚糖含量(% DW);M0为接种时微藻的生物质浓度(g/L),Ct为相对应的总糖含量(% DW),Gt为相对应的β-葡聚糖含量(% DW),d为微藻培养天数。
1.2.7 统计分析 本论文中所有图表所示的平均值和标准偏差均由3个生物学重复和3个测定重复计算获得;采用SPSS13.0进行方差分析(ANOVA)和t检验;检验水平α=0.05,P<0.05差异有统计学意义;数据处理和图表制作使用Origin 8.1。
2 结果
2.1 不同培养基对红孢囊藻(Rhodosorus sp.SCSIO-45730)生长的影响
如图1所示,培养周期0-4 d,红孢囊藻(Rhodosorussp. SCSIO-45730)在4种培养基中的生长无明显差异(P>0.05),而在第4天后,逐渐出现差异。至培养结束(第16天),ASW培养基中的微藻获得最大生物量,为(9.50 ± 0.13)g/L,显著高于其他3个处理组(P<0.01);微藻在Conway培养基和Erdschreiber培养基中生物量分别为(7.15 ±0.07)g/L和(6.29 ± 0.12)g/L;而其在f/2培养基中生长速度最慢,最终生物量为(3.35 ± 0.10)g/L。由此可见,ASW培养基更适合红孢囊藻(Rhodosorussp. SCSIO-45730)的生长。
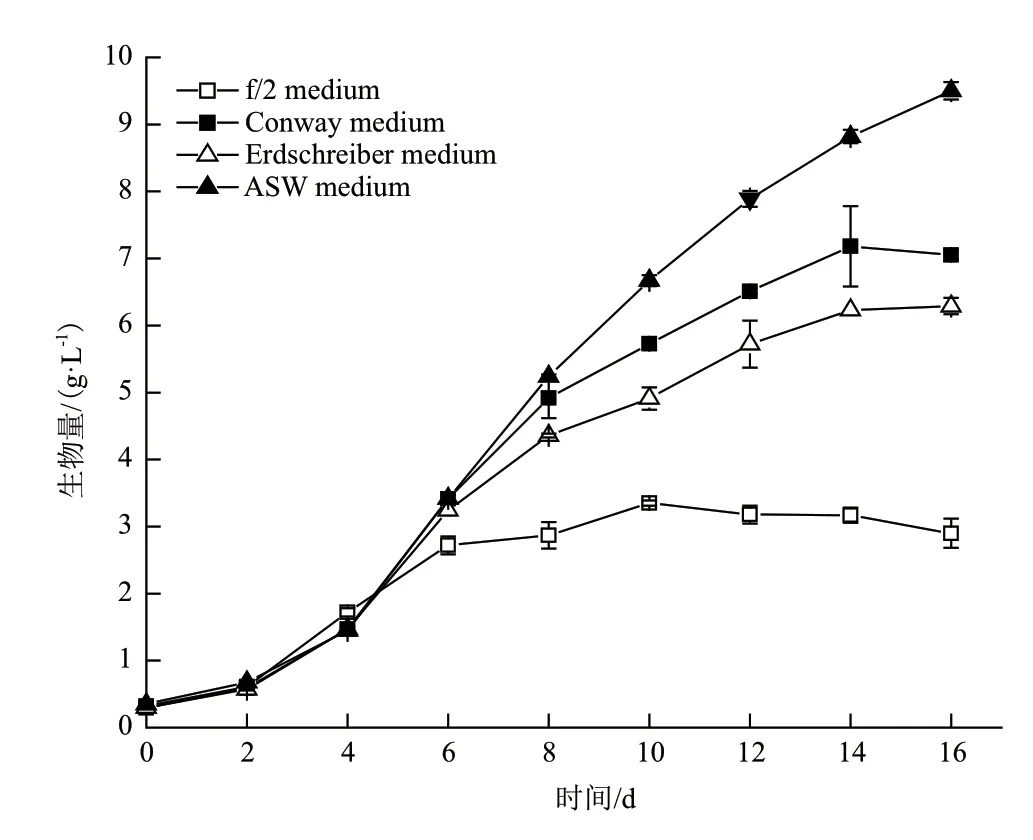
图1 4种不同培养基对红孢囊藻(Rhodosorus sp.SCSIO-45730)生长的影响
2.2 不同培养基对红孢囊藻(Rhodosorus sp.SCSIO-45730)总糖和β-葡聚糖积累的影响
对4种培养基中微藻总糖和β-葡聚糖含量进行测定,结果表明:培养至第16天,除Erdschreiber培养基外,其余3种培养基中微藻的总糖含量均在47.80% DW以上,其中,ASW培养基中微藻总糖产率显著高于其他3种培养基,达(286.48 ± 1.67)mg/L·d(图2-A)。β-葡聚糖含量在4种培养基中的积累情况如图2-B所示。Erdschreiber培养基中微藻β-葡聚糖含量显著低于其他3种培养基,f/2培养基中微藻的β-葡聚糖含量最高,可占细胞干重的(23.42 ± 0.12)%,ASW培养基中微藻β-葡聚糖含量为(21.38 ± 0.10)% DW,但其产率显著高于其他3种培养基,达(126.94 ± 1.21)mg/L·d。综上所述,4种培养基中,ASW培养基最有利于红孢囊藻SCSIO-45730总糖和β-葡聚糖的积累。
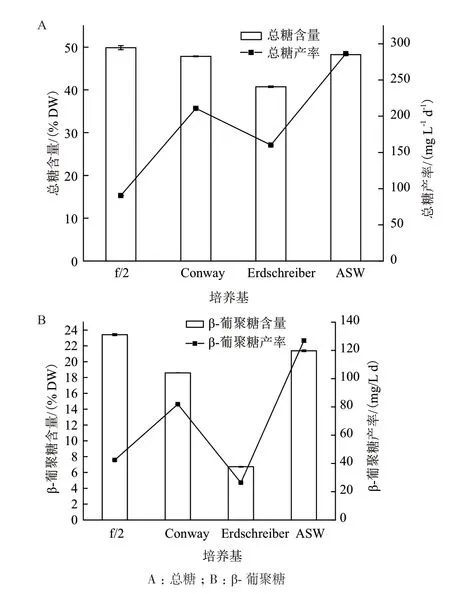
图2 4种不同培养基对红孢囊藻(Rhodosorus sp.SCSIO-45730)总糖和β-葡聚糖积累的影响
2.3 不同盐度对红孢囊藻(Rhodosorus sp. SCSIO-45730)生长及细胞的影响
红孢囊藻(Rhodosorussp. SCSIO-45730)在不同盐度ASW培养基中的生长情况,如图3所示。该藻在低盐(10‰)或高盐(68‰)环境中生长被严重抑制,藻细胞已经凋亡甚至是裂解(图4-A和4-G);在其它5个盐度条件下(18‰、28‰、38‰、48‰和58‰),其均能正常生长,但生长速度存在明显差异。随着盐度从18‰增加到38‰,微藻生长速度变快,生物量显著增加(P<0.01);至培养结束(第16天),38‰盐度下微藻生物量为(13.70 ± 0.21)g/L,较18‰盐度下的生物量(7.10 ± 0.01)g/L)增加了93.0%(P<0.01)。随着盐度继续增加至58‰,微藻生长受到抑制,生物量明显降低,至第16天时,58‰盐度下的微藻生物量降至(4.03 ± 0.16)g/L(P<0.01)。此外,红孢囊藻SCSIO-45730细胞形态也随着盐度的增加而变化,如图4所示,在培养至第8天,随着盐度的增加,微藻细胞逐渐变大,颜色逐渐变浅,细胞呈现聚团现象。盐度为18‰时,微藻主要呈单细胞状态,而盐度为48‰和58‰时细胞明显增大(图4-E和图4-F)且聚集成团。
综合不同盐度下红孢囊藻(Rhodosorussp.SCSIO-45730)生长及细胞形态结果,可认为该藻在18‰-58‰盐度范围内能正常生长且生物量高。其中,38‰盐度最利于微藻生长,盐度低于或高于38‰均会对微藻生长造成一定程度的抑制。

图3 不同盐度对红孢囊藻(Rhodosorus sp. SCSIO-45730)生长的影响

图4 不同盐度下红孢囊藻(Rhodosorus sp. SCSIO-45730)细胞形态(第8天)
2.4 不同盐度对红孢囊藻(Rhodosorus sp. SCSIO-45730)总糖和β-葡聚糖积累的影响
对不同盐度下微藻总糖进行提取和测定发现(图5-A),在培养结束(第16天),微藻的总糖含量和产率,在18‰-38‰盐度范围内呈现增加趋势,在38‰-58‰盐度范围内呈下降趋势。38‰盐度组微藻的总糖含量最高,达(48.52±0.07)% DW,其产率可达(412.58±2.88)mg/L·d,显著高于其它盐度组(P<0.01)。此外,β-葡聚糖测定结果表明(图5-B),微藻中β-葡聚糖含量和产率随着盐度增加呈现下降趋势;在盐度为18‰时,微藻中β-葡聚糖含量最高,达(22.76±0.08)% DW,而β-葡聚糖产率在盐度为28‰和38‰时无明显差别,分别为(120.22±1.67)mg/L·d和(119.70±0.59)mg/L·d,显著高于其它盐度组(P<0.01)。

图5 不同盐度对红孢囊藻(Rhodosorus sp. SCSIO-45730)总糖含量和产率的影响
2.5 户外生长及总糖和β-葡聚糖积累情况
红孢囊藻(Rhodosorussp. SCSIO-45730)在户外6 cm光径平板光生物反应器中的生长情况如图6所示,培养至第18天,微藻生物量达1.34 g/L,产率为74.44 mg/L·d,藻液颜色由暗红色(图6-B)变成黄褐色(图6-C)。微藻前后颜色差异说明,微藻细胞色素及藻胆蛋白含量和组成可能发生变化。
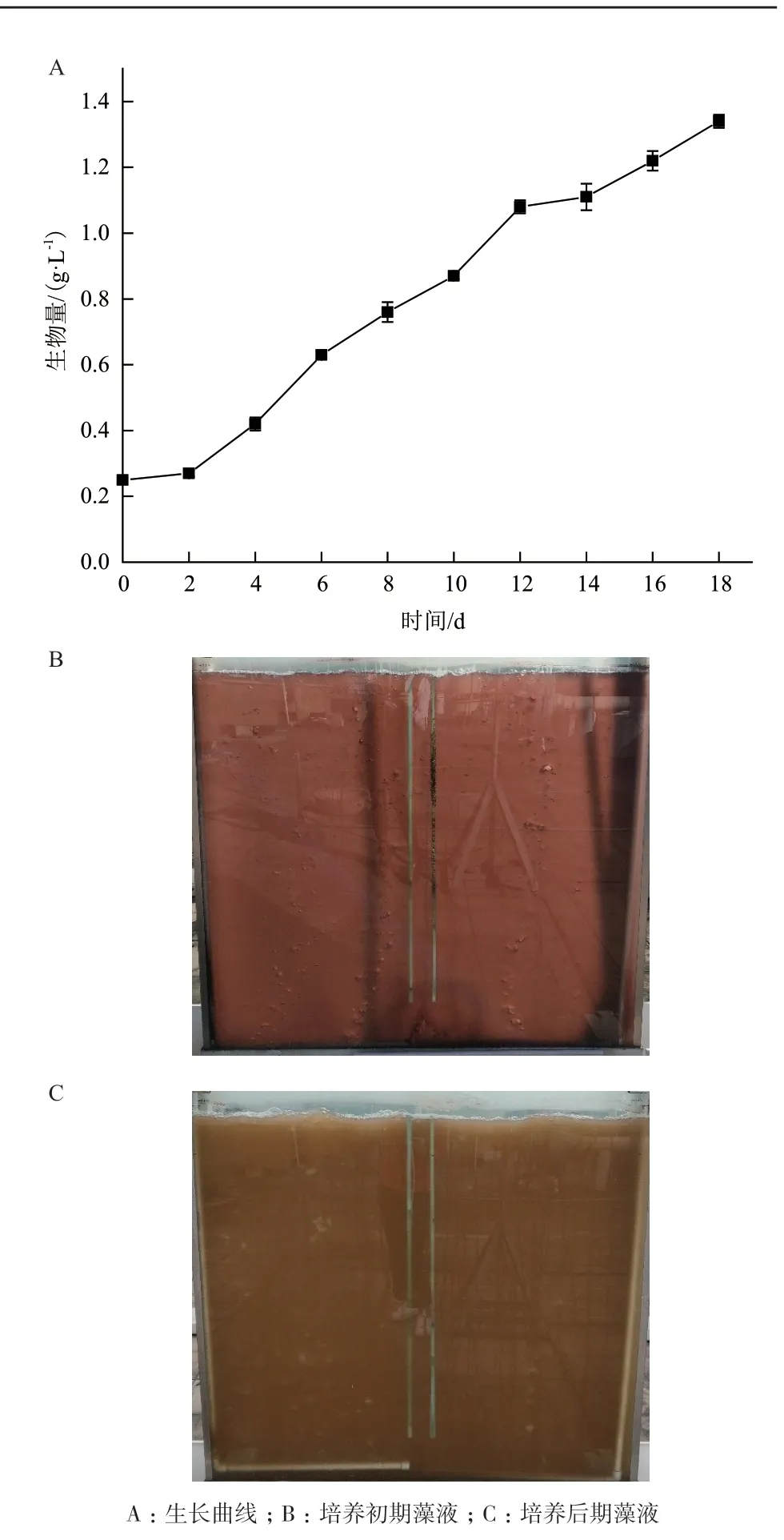
图6 红孢囊藻(Rhodosorus sp. SCSIO-45730)在户外平板光生物反应器中的生长情况
总糖和β-葡聚糖测定结果表明(图7),随着培养时间的延长,红孢囊藻SCSIO-45730细胞内总糖和β-葡聚糖含量呈增加趋势,在第16天,藻细胞内总糖和β-葡聚糖显著增加,分别占干重的(52.78± 0.27)%和(16.39 ± 0.15)%,至培养结束(第18天),藻细胞内总糖和β-葡聚糖含量分别为干重的(54.47 ± 0.33)%和(17.46 ± 0.27)%,其单位体积产量分别为0.73 g/L和0.23 g/L。
3 讨论
3.1 不同培养基中红孢囊藻(Rhodosorus sp. SCSIO-45730)生长、总糖和β-葡聚糖积累情况
培养条件如培养基、盐度、光照、温度等对微藻的生长和生化组成有重要影响,进而会影响微藻的开发利用[16]。培养基优化实验表明,ASW培养基最有利于红孢囊藻(Rhodosorussp. SCSIO-45730)生物量、总糖和β-葡聚糖的积累。在该条件下,微藻生物量、总糖和β-葡聚糖产率分别为(9.50 ± 0.13)g/L、(286.48 ± 1.67)mg/L·d和(126.94 ± 1.21)mg/L·d。Li等[17]利用同样的ASW培养基培养紫球藻(Porphyridium purpureumSCS-02),生物量为5.54 g/L,其总糖产率为133.75 mg/L·d,表明ASW培养基有利于单细胞红藻的培养,可以选择其为基础培养基对红孢囊藻(Rhodosorussp. SCSIO-45730)进行进一步培养研究。此外,红孢囊藻SCSIO-45730较高的生物量表明其有较大的开发利用潜力。
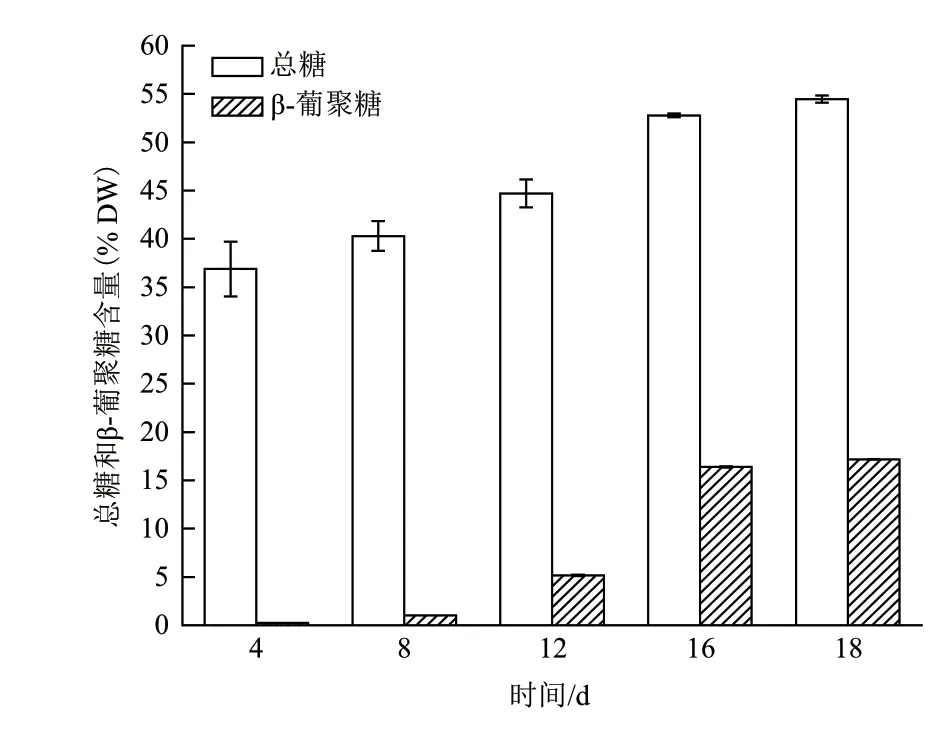
图7 红孢囊藻(Rhodosorus sp. SCSIO-45730)在户外培养过程中总糖和β-葡聚糖含量的变化
3.2 不同盐度下红孢囊藻(Rhodosorus sp. SCSIO-45730)生长、总糖和β-葡聚糖积累情况
盐度是影响海洋微藻生长的一个重要环境因子,过低或过高都会引起微藻生长及生化组成变化。如盐藻(Dunaliella salina)在20‰-100‰盐度范围内均能正常生长,其生物量在40‰盐度时达到最高值1.19 g/L[18];三角褐指藻(Phaeodactylum tricornutum)的生长在低盐度或者高盐度下均受到一定程度抑制,且高盐度对藻细胞生长的抑制作用更明显[19],与本研究结果一致。盐度偏低或偏高会引起微藻细胞内某些酶,如1,5-二磷酸核酮糖羧化酶(Rubisco,光合作用限速酶)等,以及离子转运体(如Na+/H+转运体等)活性的降低,从而使微藻生长受到抑制[20]。本研究中,红孢囊藻(Rhodosorussp.SCSIO-45730)具有广泛的盐度适应性,可在18‰-58‰盐度范围内正常生长,在盐度为38‰时可获得最大生物量,为13.70 g/L,显著高于同等培养条件下紫球藻(Porphyridium purpureumSCS-02)的生物量[17]。而随着盐度变化,微藻细胞大小的变化及聚团现象与细胞内外渗透压的变化以及胞外多糖的分泌有关[19]。
多数研究表明,在一定范围内适当增加盐度可促进微藻糖类物质积累,但是不同微藻盐度耐受性不同[16],如在35‰盐度下,硅藻(Chaetoceroscf.wighamii)细胞内糖含量较其在25‰盐度下高[13];在盐度10‰-60‰范围内,四爿藻(Tetraselmis suecica)糖含量呈现增加的趋势,在盐度为50‰时获最大含量,为53.0% DW[21]。本研究中,红孢囊藻(Rhodosorussp. SCSIO-45730)细胞内总糖含量和产率在38‰盐度时达到最大值,而在盐度低于或高于38‰时均呈现不同程度的降低。据报道,微藻在高盐条件下能积累小分子糖类以调节细胞内外渗透压,从而降低细胞损伤及死亡,使微藻适应高盐环境[19]。随着盐度进一步增加,细胞内积累的糖类物质不足以平衡细胞内外渗透压,为维持正常生长,微藻会消耗积累的糖类物质为细胞生长提供能量,从而导致细胞中糖含量的降低[20]。
随着全球能源需求和消耗增加,以及化石燃料带来的一系列环境问题,人们越来越重视生物质能源的开发。其中,生物乙醇由于辛烷值和蒸发热较传统化石燃料高、燃烧完全、无污染等特点而备受关注[22]。微藻具有生长快、种类多,固碳效率高,不占用农用耕地等特点,被认为是生产第3代生物乙醇的理想原料[23]。微藻中糖类物质由于不含木质纤维素,因而无需进行前处理便可轻易转化成可发酵糖用于生物乙醇生产。在氮饥饿条件下,小球藻(C. vulgarisFSP-E)能积累51% DW的糖类物质,每克底物可生产生物乙醇0.23 g[24]。Chen等报道[25]四爿藻(Tetraselmissp. CS-362)、紫菜(Porphyra)、斜生栅藻(S. ObliquusCNW-N)、绿球藻(Chlorococumsp.)和莱茵衣藻(Chlamydomonas reinhardtiiUTEX90)等,含糖量为26%-60%,可用于生产生物乙醇。本研究中,红孢囊藻(Rhodosorussp. SCSIO-45730)在盐度为38‰时具有较高的生物量、总糖含量及产率,表明其是生产生物乙醇的潜在原料。
β-葡聚糖具有较高的营养价值和重要的生物功能,目前已被许多国家如中国、美国、日本及澳大利亚等国批准作为免疫调节剂和食品添加剂等功能性成分,应用于医药、食品和化妆品等行业[9]。据报道,微藻β-葡聚糖主要以β-1,3-键连接,具有低分子量和高支化度,因而可以产生比市售酵母β-葡聚糖更好的免疫反应[26-27]。因此,对微藻β-葡聚糖进行开发研究具有较大的开发应用潜力。牟氏角毛藻(Chaetoceros mulleri)中β-葡聚单位体积产量为71.57 mg/L,微拟球藻(NannochloropsisNpUNAM)中β-葡聚单位体积产量为81.55 mg/L,它们是生产β-葡聚的重要来源[7,28]。红孢囊藻(Rhodosorussp.SCSIO-45730)β-葡聚糖产率在38‰盐度时达最大值119.70 mg/L·d,单位体积产量为1.92 g/L,因此,可作为生产β-葡聚糖的潜在来源。该藻细胞中β-葡聚糖含量随着盐度增加而降低,这一机理尚不明确,有待进一步研究。Jia等[29]报道在氮充足条件下,β-葡聚糖可与三酰甘油竞争碳源,成为微拟球藻(Nannochloropsis oceanica)细胞内主要临时碳储存形式,在氮耗尽后,β-葡聚糖代谢调节将有利于促进三酰甘油的合成。另有研究表明,盐度对紫球藻氮利用有一定影响[20],紫球藻细胞对NaNO3的消耗能力随着盐度增加而呈梯度性增加。因此,我们推测,高盐度下红孢囊藻(Rhodosorussp. SCSIO-45730)对NaNO3的消耗增加,导致培养基中NaNO3浓度降低,从而引起藻细胞内β-葡聚糖含量降低。
3.3 户外试验下红孢囊藻(Rhodosorus sp. SCSIO-45730)生长、总糖和β-葡聚糖积累情况
红孢囊藻(Rhodosorussp. SCSIO-45730)户外初步培养实验研究表明,微藻可以在户外正常生长,在6 cm光径平板光生物反应器中,其生物量可达到1.34 g/L,细胞内总糖和β-葡聚糖单位体积产量分别为0.73 g/L和0.23 g/L,而单位体积产量是确定微藻生产潜力的重要指标[7]。Onay[30]报道了微藻(HindakiatetrachotomaME03)在不含市政污水的平板光生物反应器获得最大生物量0.89 g/L,而其在含50%市政污水的平板光生物反应器中碳水化合物体积产量最高,为0.17 g/L,是生产生物乙醇的潜在候选物种。Rojo-Cebreros等[7]研究表明,微拟球藻(NannochloropsisNpUNAM)可产生81.55 mg/L β-葡聚糖,且具有在平板光生物反应器中生产高产量β-葡聚糖的潜能,可作为β-葡聚糖的潜在来源。在户外培养初步实验中,红孢囊藻(Rhodosorussp.SCSIO-45730)可获得较高的总糖和β-葡聚糖产量,表明其具有规模培养,特别是开放系统培养以生产生物乙醇和β-葡聚糖的潜力,但还需要进一步对微藻户外培养性能进行长期更详尽及系统的研究。
4 结论
红 孢 囊 藻(Rhodosorussp. SCSIO-45730)在ASW培养基中生长速度快,总糖和β-葡聚糖含量高,且具有较广泛的盐度适应性,可在18‰-58‰盐度范围内正常生长,当盐度为38‰时,可获得较高产率的生物质、总糖及β-葡聚糖;该藻可利用户外平板光生物反应器进行培养,红孢囊藻(Rhodosorussp. SCSIO-45730)具有规模化生产生物乙醇和β-葡聚糖的潜力。
