苦荞NAC转录因子FtNAC17的鉴定及表达分析
2021-01-22荣玉萍唐彬李鹏章洁琼陈庆富朱丽伟邓娇黄娟
荣玉萍 唐彬 李鹏 章洁琼 陈庆富 朱丽伟 邓娇 黄娟
(1. 贵州师范大学荞麦产业技术研究中心,贵阳 550001;2. 贵州省农作物技术推广总站,贵阳 550001)
植物在生长发育过程中受环境因素的影响较大[1]。这些环境因素包括生物胁迫(如病虫害)和非生物胁迫(如干旱、低温、盐胁迫、水涝、机械损伤)。转录因子在植物应对逆境胁迫过程中具有重要作用[2]。其中,NAC(NAM/ATAF/CUC)是植物特异的转录调控因子,是植物中数量最多的转录因子家族之一[3],其N端含有约150个氨基酸的保守结构域,由A、B、C、D、E 5个亚结构域组成,其中A、C、D高度保守,B、E较为多变;NAC转录因子C端为高度变异的转录调控区,在植物生长发育及应对生物及非生物胁迫具有重要作用[4]。根据NAC转录因子中保守的NAM结构,可将植物中NAC转录因 子 分 为ONAC4、ANAC034、SNAC、TIP、SND、NAM/CUC3六大类,同一大类的NAC基因具有相近的功能[5],其中,响应非生物胁迫的NAC基因都归属于SNAC大类。干旱、低温和盐胁迫是较为普遍的非生物胁迫。干旱对于植物生长的影响显著,尤其叶片面积和叶片数量都会显著减少[6]。过表达OsNAC52增强了转基因拟南芥对干旱胁迫的耐受性[7]。低温可引起细胞膜冻结,并通过渗透、氧化和其他胁迫抑制植物的生长,造成不可逆转的损害,严重影响作物产量和质量[8-9]。盐胁迫除了引起植物失水,还会引起植物内蛋白质和脂类破坏和水解,导致代谢紊乱,甚至引起植物体死亡。此外,盐胁迫下活性氧的过度积累加速了植物萎蔫[10]。过表达LpNAC13的转基因烟草具有较强的耐盐性[11]。荞麦属于蓼科(Polygonaceae)荞麦属(Fagopyrum),是一年生草本双子叶植物[12],其栽培种有甜荞(F.esculentum)和苦荞(F.tataricum)两种。苦荞作为一种药食同源的作物,不仅富含蛋白质、淀粉等营养物质,还含有膳食纤维、维生素等微量物质以及黄酮类化合物、多酚类化合物等活性成分,具有降三高、抗肿瘤、增强免疫力等功效[13]。除此之外,苦荞还具有耐瘠薄的特性[14]。因此,通过分析苦荞NAC基因在干旱、低温、盐和激素胁迫下的响应情况,进而明确其响应非生物胁迫机制。这对于挖掘优异基因具有重要意义。
目前,对苦荞的研究主要集中在营养保健和食品加工方面,在分子生物学方面的研究尚处于起步阶段。在分子方面的研究主要集中在黄酮类化合物的合成及代谢途径中关键酶和转录因子的研究[15]。随着苦荞基因组数据库的构建[16],NAC家族转录因子在苦荞全基因组水平上得到分析和鉴定[17-18]。且对苦荞FtNAC15进行了系统性分析,结果表明,FtNAC15参与种子发育及响应干旱胁迫[19]。Deng等[20]通过对苦荞的8个与胁迫相关NAC基因进行研究发现,所有的FtNAC基因对一个或多个处理都有反应,其中FtNAC4和FtNAC7在盐、干旱、脱落酸和水杨酸处理后上调超过20倍。
虽然有部分的NAC转录因子在苦荞中的研究有了初步的结果,但大部分NAC转录因子具体功能尚不清晰。本研究根据已有的转录组数据挑选并克隆了一个NAC家族基因,命名为FtNAC17,对其编码区序列、氨基酸序列等进行生物信息学分析以及其对干旱、低温、盐和激素胁迫的响应进行分析,为阐明基因功能提供理论依据。
1 材料与方法
1.1 材料
采用标准发芽法将苦荞(贵米苦11号)种子培养14 d,待长出一片真叶后,进行6种处理。选饱满一致的种子36粒,按照6行6列的方式整齐地摆放到铺有滤纸的发芽盒(12 cm×12 cm×6 cm)内,25℃光照培养箱中培养(光照16 h/黑暗8 h)至长出一片真叶后进行统一处理。
干旱处理:采用20%聚乙二醇(PEG-6000)溶液处理[21]。低温处理:将培养后的幼苗在4℃处理[22]。盐处理:用3 mg/L NaCl处理幼苗[23]。激素处理:激素处理又分为3种,分别为22.43 mg/L茉莉酸甲酯处理[24]、20 mg/L脱落酸处理[25]和150 mg/L赤霉素处理[26]。分别在处理后0、3、6、12和24 h取整株幼苗,液氮速冻后立即-80℃保存,以备提取RNA。每种处理设置2组生物学重复。
另取苦荞幼苗用于DNA的提取,采样地点为贵州师范大学荞麦产业技术中心百宜基地。将采集的样品置于液氮中,-80℃保存备用。
1.2 方法
1.2.1 DNA的提取与检测 苦荞总DNA的提取用改良的CTAB法。将大约0.1 g苦荞幼苗于研钵中加入液氮充分研磨后转入离心管中,加入1000 μL CTAB提取液混合均匀,65℃水浴30 min。离心取上清,加入800 μL氯仿/异戊醇抽提。离心取上清,加入500 μL预冷的异丙醇,混合均匀。离心去上清,加入500 μL预冷的无水乙醇清洗沉淀2次。离心后晾干乙醇溶液,溶于100 μL ddH2O中。将提取的DNA经1%的琼脂糖凝胶电泳检测,质量合格后用于下一步的克隆。
1.2.2 RNA提取与cDNA合成 利用天根生化科技(北京)有限公司的植物总RNA提取试剂盒提取处理样品中总RNA。取1 μg RNA用宝日医生物技术(北京)有限公司的反转录试剂盒合成cDNA第一链,-20℃保存备用。
1.2.3 苦荞FtNAC17的克隆 根据苦荞基因组数据库中苦荞基因组序列及预测的编码区序列,利用Oligo7引物设计软件设计1对特异性引物扩增苦荞NAC17序列(FtNAC17F:5'-AAATGTCGTCGGAAGACTTGCA-3',FtNAC17R:5'-CTAGCTCAGATACATGAACATATCC-3'),于生工生物工程(上海)股份有限公司合成引物。以苦荞DNA和cDNA为模板,FtNAC17F和FtNAC17R为引物,利用宝日医生物技术(北京)有限公司的热启动型TaKaRa Ex Taq酶进行PCR扩增。PCR反应体系为DNA或cDNA 2 μL、10×PCR Buffer 5 μL、dNTP Mixture 4 μL、上下游引物各2 μL、Taq DNA聚合酶0.25 μL和ddH2O 34.75 μL。PCR反应程序为98℃ 3 min;98℃ 10 s,42℃ 30 s,72℃ 1 min,30个循环。将扩增产物进行1%琼脂糖凝胶电泳,在凝胶成像仪上检测,片段大小正确后利用天根生化科技(北京)有限公司的DNA胶回收试剂盒进行胶回收。回收产物连接于天根生化科技(北京)有限公司的pGM-T载体上,转化到大肠杆菌TOP 10感受态细胞中,挑取阳性单克隆,经菌液PCR鉴定后送至生工生物工程(上海)股份有限公司进行测序。
1.2.4 苦荞FtNAC17的生物信息学分析 将经测序验证正确的序列进行生物信息学分析。利用GSDS(http://gsds.cbi.pku.edu.cn/)对FtNAC17的基因结构进行分析。用DNAMAN软件分析其开放阅读框,预测其编码的氨基酸序列;利用SMART(http://smart.embl-heidelberg.de/)分析蛋白质保守结构域。利用EXPASY(https://web.expasy.org/)预测蛋白质的理化性质。利用PSORT Ⅱ Prediction(https://psort.hgc.jp/cgi-bin/runpsort.pl)软件预测蛋白亚细胞定位。使用GOR IV SECONDARY STRUCTURE PREDICTION METHOD(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_gor4.html)预测蛋白的二级结构。利用BLASTP将蛋白序列与NCBI非冗余蛋白库(NR)进行比对,然后利用BankIt(https://www.ncbi.nlm.nih.gov/WebSub/)将FtNAC17序列提交到GenBank。利用DNAMAN将与FtNAC17同源的NAC蛋白进行氨基酸多重序列比对。利用MEGA 6.0软件构建进化树,使用邻接法,设置重复次数(bootstrap)为1000次。
1.2.5 实时荧光定量PCR 利用Primer 6设计荧光定量PCR引物qNAC17-F:5'-GAATCGGTGCCACGGTGTCA-3'和qNAC17-R:5'-ACCTTGTGCAGACGGCTGATTA-3'。将1.2.2中合成的cDNA稀释10倍为模板,以Actin作为内参基因,以qNAC17-F和qNAC17-R作为引物进行PCR扩增。利用宝日医生物技术(北京)有限公司的TB Green Premix Ex Taq II进行荧光定量PCR[27]。反应体系为cDNA 2 μL、TB Green Premix Ex Taq II 10 μL、上下游引物各0.8 μL和ddH2O 6.4 μL。反应程序为95℃ 30 s;95℃ 5 s,55℃ 34 s,40个循环。2次生物学重复,2次技术重复。采用2-△△Ct法进行相对表达量的处理。
2 结果
2.1 苦荞FtNAC17的克隆
以苦荞DNA和cDNA为模板,利用特异性引物进行PCR扩增,得到大小约为1000 bp的序列(图1)。经测序,该片段大小为903 bp。利用GSDS分析基因结构,结果显示,在该基因中存在2个外显子(1-438 bp和523-903 bp),其中包含一个内含子(439-522 bp)(图2)。将该基因命名为FtNAC17,GenBank登录号为MT641452。
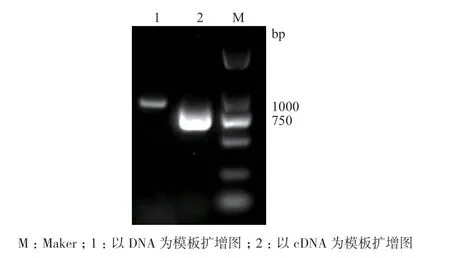
图1 苦荞FtNAC17的扩增
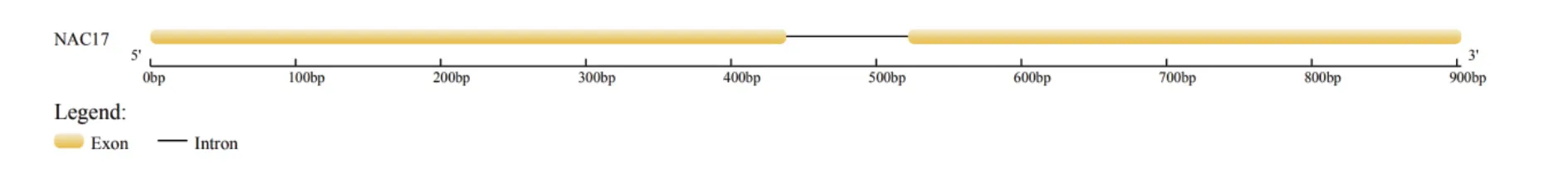
图2 FtNAC17的结构
2.2 苦荞FtNAC17蛋白生物信息学分析
利用DNAMAN对该序列进行分析发现,其含有819 bp的开放阅读框,编码272个氨基酸(图3)。利用SMART分析蛋白质结构域,显示在其9-132位氨基酸序列是NAC蛋白特有的NAM结构域,其E-value值为1.5e-37,说明其属于NAC转录因子。利用EXPASY预测蛋白质的理化性质,结果表明,FtNAC17蛋白的分子质量为30.77 kD,等电点为7.05,疏水性平均值为-0.584,推测该蛋白可能为亲水性蛋白(表1)。利用PSORT Ⅱ Prediction对FtNAC17蛋白进行亚细胞定位预测,结果表明FtNAC17蛋白有45%的可能性在细胞质中(表2)。综上所述,FtNAC17蛋白很可能存在于细胞质中。

图3 FtNAC17的核酸及其编码的氨基酸序列

表1 FtNAC17蛋白的理化性质

表2 FtNAC17蛋白亚细胞定位
利用GOR IV SECONDARY STRUCTURE PRE-DI CTION METHOD对FtNAC17蛋白进行二级结构预测,结果表明FtNAC17蛋白的二级结构由α-螺旋、β-折叠和无规则卷曲构成。二级结构中α-螺旋有32个氨基酸,占序列的11.76%;β-折叠有70个氨基酸,占序列的25.74%;无规则卷曲有170个氨基酸,占序列的62.5%(图4)。上述数据表明FtNAC17蛋白的二级结构以无规则卷曲为主,β-折叠其次,α-螺旋数量最少。
2.3 FtNAC17蛋白同源进化分析
将FtNAC17序列与拟南芥TAIR11蛋白库比对发现,该基因与拟南芥中SNAC类中ANAC002最为相近。为推测FtNAC17的功能,从植物NAC转录因子家族6大类中挑选具代表性的蛋白,分别为ONAC4、ANAC034、ANAC002(SNAC)、ANAC078(TIP)、ANAC012(SND)、NAM/CUC3(ANAC018、ANAC031)。将FtNAC17与这7条蛋白NAM保守结构域序列进行多重序列比对,结果表明,NAC蛋白N端的氨基酸序列较为保守,由A、B、C、D、E 5个亚结构域组成(图5)。将以上氨基酸序列构建系统进化树,结果表明,FtNAC17与拟南芥ANAC002(ATAF1)亲缘关系最近(图6)。
2.4 FtNAC17的表达分析
为揭示FtNAC17响应干旱、低温、盐和激素胁迫情况,采用荧光定量PCR方法来探究FtNAC17在干旱、低温、盐、茉莉酸甲酯、脱落酸和赤霉素处理苦荞幼苗0、3、6、12和24 h的表达模式(图7)。结果表明,6种非生物胁迫均有显著影响(P<0.05)。尤其是赤霉素处理下,FtNAC17的表达水平最高(达10.27倍)。

图4 FtNAC17蛋白二级结构预测

图5 NAM保守结构域氨基酸多重序列比对
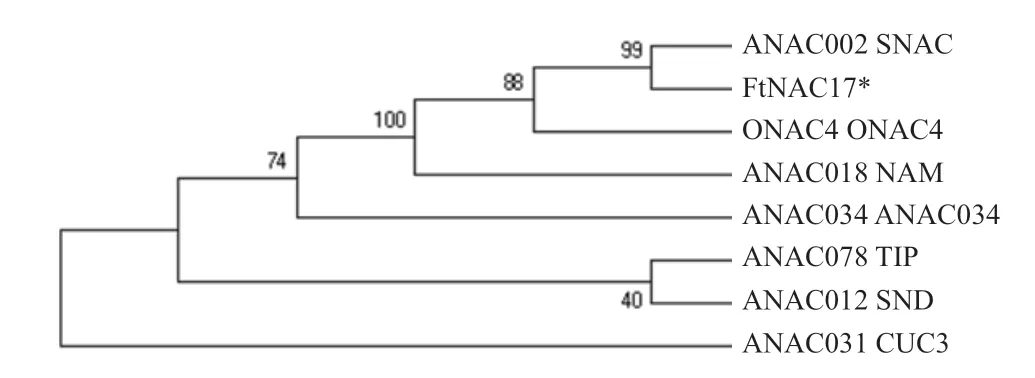
图6 FtNAC17与6类NAC蛋白的系统进化分析
干旱处理后,FtNAC17的表达量呈波浪型变化。推测在响应干旱胁迫时,FtNAC17可能与多个基因协同响应该胁迫。低温处理后,FtNAC17的表达量上调。盐胁迫处理后,FtNAC17显著上调表达。茉莉酸甲酯处理后,FtNAC17呈上调表达。脱落酸处理后,FtNAC17呈显著上调表达。赤霉素处理后,FtNAC17呈显著上调表达。
3 讨论
转录因子在植物生长过程中具有重要调控的作用,分析鉴定相关的转录因子,并揭示其分子机制一直是分子生物学领域的焦点。NAC转录因子是植物特异的转录因子,也是植物中数量最大的转录因子,所以研究其家族成员的结构与功能具有重要意义。本研究鉴定了苦荞FtNAC17,并对其进行了生物信息学分析。通过对FtNAC17编码的蛋白分析可知,该蛋白为亲水蛋白,与王洋等[28]结果一致。蛋白质的二级结构是其整个空间结构的基础,在蛋白质折叠过程的早期形成,为蛋白质三级结构的形成奠定基础,对亚细胞定位有一定作用。预测FtNAC17蛋白的二级结构发现,无规卷曲在蛋白质二级结构中占据最大比例,使蛋白质构型多样化,这一点与黎帮勇等[29]研究结果相一致。根据NAC转录因子保守NAM结构域,可将植物中NAC转录因子分为6个大类,同一大类的NAC基因具有相近的功能,其中响应非生物胁迫的NAC基因都归属于SNAC大类。本文克隆的FtNAC17,经与拟南芥TAIR蛋白库比对,与拟南芥中SNAC类中ANAC002(ATAF1)最为相近。过表达ANAC002(ATAF1)的植物敏感性增强,表明ANAC002(ATAF1)响应病原和非生物胁迫有关[30]。因此,推测亲缘关系较近的FtNAC17参与响应非生物胁迫。通过研究干旱、低温、盐和激素等非生物胁迫下FtNAC17的表达情况发现,该基因对干旱、低温、盐、茉莉酸甲酯、脱落酸和赤霉素胁迫处理均有不同程度的响应,这表明FtNAC17确实参与响应非生物胁迫。干旱处理时,FtNAC17的表达量呈先到达峰值后下降后再上升的一个趋势,推测该基因在响应这些胁迫时并非独自发挥作用,很可能与其他基因共同发挥作用。目前,本研究仅就单一胁迫影响FtNAC17表达进行研究,未在多胁迫层面上研究该基因的响应情况。因此,后续可以将FtNAC17响应多胁迫情况进行量化,更深层次的挖掘FtNAC17的功能。

图7 FtNAC17在不同胁迫下的表达情况
4 结论
初步明确FtNAC17参与应对部分非生物胁迫反应。并且FtNAC17可能通过ABA和MeJA信号通路响应非生物胁迫。
