黑龙江与吉林的部分地区蜱传黄病毒的检测与鉴定
2021-01-22蔡祥龙闫晓敏
蔡祥龙,闫晓敏,董 馨,何 彪,朱 妍
(1.东北农业大学动物医学学院,黑龙江 哈尔滨 150030;2.军事科学院军事医学研究院/军事兽医研究所/吉林省人兽共患病防控重点实验室,吉林 长春 130122)
蜱是一种专性吸血的体表寄生虫,可以传播包括病毒在内的多种病原体。已发现的蜱传病毒(Tick-borne virus,TBV)多达6 科80 多种[1],目前全球范围内能引起人类疾病的TBV 主要有内罗病毒科(Nairoviridae)、白蛉病毒科(Phenuiviridae)、黄病毒科(Flaviviridae)、正粘病毒科(Orthomyxoviridae)和呼肠孤病毒科(Reoviridae)5 科14 种病毒。其中的黄病毒(Flavivirus)是一大类具有囊膜的单股正链RNA病毒,多通过蚊、蜱进行传播[2]。蜱作为黄病毒的重要传播媒介,已发现的蜱传黄病毒至少有12 种,其中蜱传脑炎病毒(Tick-borne encephalitis virus,TBEV)、卡萨努尔森林病病毒(Kyasanur forest dis⁃ease virus,KFDV)、鄂木斯克出血热病毒(Omsk hemorrhagic fever virus,OHFV)、波瓦生病毒(Powas⁃san virus,POWV)和跳跃病病毒(Louping-ill virus,LIV)等对人或动物均有致病性[3-5]。TBEV 是全球分布最为广泛的一种自然疫源性病原,感染后可对人神经系统造成严重损伤,每年约有10 000~12 000 人感染[6-7]。近年来陆续发现一些新的蜱传黄病毒,2002年Grard在非洲西部塞内加尔羊体表寄生的伊文斯扇头蜱中发现恩格耶病毒(Ngoye virus,NGOV)[8]。2017年刘全在内蒙古呼伦贝尔市阿龙山镇发现阿龙山病毒(Alongshan virus,ALSV),这不仅是一株新的黄病毒,而且与人的发病临床症状相结合,清晰的展现病毒感染传播及致病的完整链条[9]。随后在羊、牛体内也检测到该病毒的核酸和抗体[10]。
我国黑龙江、吉林地区与蒙古、俄罗斯和朝鲜接壤,地理位置特殊,森林资源丰富,适合蜱生存,是TBEV 的自然疫源地。社会经济快速发展,生态环境不断变化,人与蜱接触的机会增多,同时该地区新蜱传病毒的出现,提示在这一地区开展蜱传黄病毒的研究具有重要的公共卫生学意义。本研究采集这一地区的蜱,经病毒宏基因组学研究结果提示所采集的蜱样品中含有TBEV、NGOV 和ALSV 3 种黄病毒,对这3 种黄病毒进行检测和基因组全长的扩增,对所获得的病毒株基因序列进行遗传进化分析,以期为这3 种蜱传黄病毒病的预防与控制提供科学依据。
1 材料与方法
1.1 主要实验材料RNA 核酸提取试剂盒购自凯杰(德国)科技有限公司;反转录试剂和5'-Full RACE Kit 购自宝生物工程(大连)有限公司;2×PCR Master Mix 购自天根生化科技(北京)有限公司;MEM 购自康宁生命科学(吴江)有限公司。
1.2 蜱样品采集2018 年~2019 年在黑龙江省和吉林省9 个地点,采用布旗法和动物体表摘取法采集蜱[11],共采集到2 402 只蜱,并对其进行种形态学[12]鉴定,进一步参照文献[13]进行16S rRNA 基因的PCR扩增测序和鉴定。
1.3 蜱传病毒宏基因组分析采用75%酒精清洗蜱,无菌PBS 冲洗,擦干后按采集地和种类进行分类,同一地区的同种蜱,每10 只作为一个样品放入1.5 mL 离心管,部分地区采集样品少或者饱血蜱个头较大适量少放,加入400 μL MEM 研磨后,4 ℃、12 000 r/min 离心10 min,每份取50 μL 上清由深圳华大基因科技有限公司进行病毒宏基因组学分析。每份研磨上清取100 μL 用于黄病毒检测,余下上清-80℃冻存备用。参照RNA 提取试剂盒说明书提取RNA,反转录为cDNA 备用。
1.4 引物的设计与合成根据1.3 病毒宏基因组结果获得黄病毒的读长(reads),用SeqMan(DNAStar)拼接后进行Blastn 和Blastx 比对分析,下载同源性和覆盖率最高的参考序列,根据重叠序列和参考序列,利用Primer 5.0和Oligo 6.0软件设计分析所得病毒检测和全长扩增引物(表1),由上海生工生物工程技术服务有限公司合成。
1.5 病毒检测以1.3 中各地区蜱样品cDNA 为模板,采用半套式RT-PCR 检测宏基因组分析所得的黄病毒。体系如下:2×Master Mix 12.5 μL、ddH2O 8.5 μL、上下游引物(10 μmol/L)各1 μL、1.3 中的cD⁃NA 模板2 μL,共25 μL 体系。外套RT-PCR 扩增:94 ℃3 min;94 ℃30 s、55 ℃~60 ℃30 s、72 ℃1 min,35个循环;72 ℃10 min,内套RT-PCR扩增体系和反应条件与外套一致。采用1.4引物:ALSV外套(上游:ALSV-F14,下游:ALSV-R275)、内套(上游:ALSVF14,下游:ALSV-R253),TBEV外套(上游:TBEVF1,下游:TBEV-R358)、内套(上游:TBEV-F24,下游:TBEV-R358),NGOV 外套(上游:NGOV-F1,下游:NGOV-R2)、内套(上游:NGOV-F1,下游:NGOV-R1),产物经1%琼脂糖凝胶电泳检测。
1.6 ALSV、NGOV 和TBEV 基因序列扩增同1.5方法扩增ALSV,引物:外套(上游:ALSV-F2476,下游:ALSV-R1002)、内套(上游:ALSV-F2476,下游:ALSV-R1094),产物与1.5 ALSV检测片段序列用MEGA6 进行拼接。NGOV 采用RACE 法扩增序列,RACE 法参照TaKaRa 5'-Full RACE Kit 说明书进行,第一个反应用5'RACE-F2,第二个反应用5'RACEF1,扩增产物与1.5 NGOV 检测片段序列用MEGA6 进行拼接。将1.5中RT-PCR 检测为TBEV 阳性的蜱研磨液,由北京诺和致源公司做高通量测序,对获得的fasta 基因序列采用Megahit 软件拼接成全基因组。

表1 ALSV、NGOV 和TBEV 检测引物Table 1 Detection primers for ALSV, NGOV and TBEV
1.7 ALSV、NGOV 和TBEV 的同源性及遗传进化分析将1.6 中所得各病毒基因序列进行测序,对测序结果经Blastn 比对分析同源性,确定分别为ALSV、NGOV 和TBEV 3 种病毒的目的基因后,选择MEGA 6 软件Clustal W 分别进行ALSV、NGOV 和TBEV 3 种病毒与相应同源性最高的参考株及经典株核苷酸序列比对剪切,寻找最佳进化模型,采用最大似然法(Maximum Likelihood),bootstrap 设置为1 000 构 建ALSV NS3-Like 基 因、NGOV NS5 基 因 和TBEV 全基因组遗传进化树[14]。
1.8 黄病毒基因结构与氨基酸分析经1.6 扩增得到的ALSV、NGOV 和TBEV 3 种病毒的基因序列,分别与1.7 中核苷酸同源性最高的参考株基因比对并分析基因结构,利用https://web.expasy.org/translate/在线进行开放阅读框分析及核苷酸序列翻译,将翻译得到的氨基酸序列分别与相应病毒的流行株和经典株进行比对分析。
2 结 果
2.1 样品信息2018 年~2019 年在黑龙江省佳木斯市(同江)、鹤岗市(奋斗、金满屯)和伊春市(嘉荫、育林林场、友好和三股流),吉林省长春市(九台区)和蛟河市(太阳村)9 个采集点共采集蜱2 402只,经形态学鉴定为硬蜱科,分属于3 个属:革蜱属、血蜱属和硬蜱属,通过16S rRNA 基因(同源性在95%以上)进一步鉴定显示其中森林革蜱60.3%(1 449/2 402)、日本血蜱14.1%(339/2 402)、嗜群血蜱8.0%(192/2 402)和全沟硬蜱17.6%(422/2 402)。布旗法采集到环境中游离蜱257 只,优势蜱种为全沟硬蜱,从动物体表采集到蜱2 145 只,优势蜱种为森林革蜱(表2)。表明森林革蜱为本次采样的优势种。
2.2 病毒宏基因组学与PCR 检测结果通过病毒宏基因组学分析,141 条读长(reads)注释到黄病毒,平均读长147 bp,通过组装拼接成10个重叠序列(con⁃tig),最长长度分别为400 bp、356 bp 和319 bp,经Blast 比对,分别匹配TBEV、NGOV 和ALSV,同源性为95%~75%。从黑龙江伊春友好区、三股流和育林林场的全沟硬蜱中检测到ALSV,阳性率为23%(3/13);首次在吉林九台牛体表的日本血蜱中检测到NGOV,阳性率为13%(1/8);在吉林蛟河前进林场牛体表的森林革蜱中检测到TBEV,阳性率为3%(1/35),3 种黄病毒的检测结果见表2。结果表明:采集地区蜱传黄病毒为以上3 种病毒。
2.3 同源性分析及遗传进化分析结果对ALSV 阳性样品进行RT-PCR 扩增,获得友好区和育林林场两个样品的ALSV 片段(1 531 nt),将其命名为ALSV HLJ Sequence 1 和ALSV HLJ Sequence 2,两个ALSV 片段之间的核苷酸同源性为100%,与全部ALSV 株同源性为93.08%~90.20%,与黑龙江ALSV H3 株同源性最高达93.08%,与芬兰Kuutsalo-23 株同源性最低为90.20%。与处于另一进化分支的法国荆门蜱传病毒JMTV/I.ricinus/France 代表株同源性为90.59%。以荆门蜱传黄病毒作外群,构建NS3-like基因的遗传进化树,结果显示本研究获得的ALSV独立成支,与ALSV H3 亲缘关系较近,与其他荆门蜱传黄病毒亲缘关系较远(图1A)。上述结果表明:本研究获得的ALSV sequence 1/2 片段与ALSV H3 株亲缘关系比较近,但存在一定的进化差异。
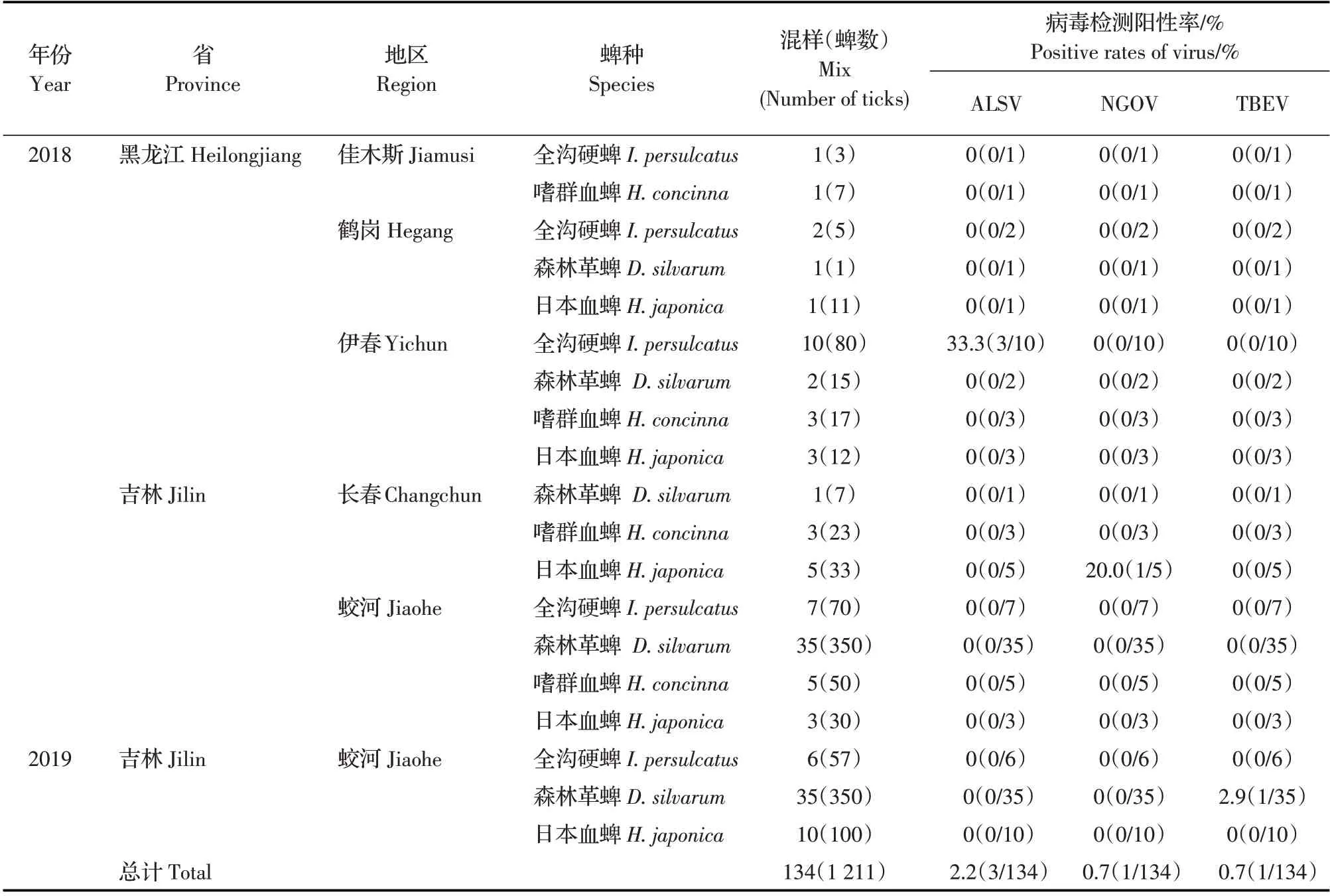
表2 蜱样品采集信息及ALSV、NGOV 和TBEV 检测结果Table 2 Positive rates of ALSV, NGOV and TBEV
对1.6 获得的基因片段拼接后显示得到的NGOV 916 nt 的NS5 基因,命名为JiutaiV-JL。Blastn 比对结果显示JiutaiV-JL NS5 基因与塞内加尔NGOV 株相应基因的核苷酸同源性为69.26%,与蚊传黄热病毒和登革热病毒核苷酸同源性为78.82%~68.79%。以蚊传黄病毒作为外群,以黄病毒NS5 基因构建遗传进化树,JiutaiV-JL 株与NGOV 株形成了一个独立的分支,证实JiutaiV-JL 与NGOV 同属于蜱传黄病毒的成员,遗传关系较近,与蚊传黄病毒亲缘关系较远(图1B),同源性及其独立的进化分支显示:JiutaiVJL 是一种新发现的蜱传新型NGOV。
RT-PCR 检测TBEV 阳性样品后经高通量测序,对测序获得的reads 进行拼接,结果显示获得TBEV全长基因组为11 051 nt,将其命名为TBEV JL Jiao⁃he。基因序列分析发现该病毒基因组A、T、C 和G的含量分别为25.25%、20.79%、22.65%和31.32%。TBEV JL Jiaohe 株与其流行株、疫苗株全基因组的核苷酸同源性为95.53%~93.86%,与俄罗斯rimorye-87流行株同源性最高为95.53%,与中国疫苗Senzhang株同源性最低为93.86%。以鄂木斯克出血热病毒为外群建树,显示JL Jiaohe 属远东亚型,并与疫苗株处于不同进化分支(图1 C)。基因层面分析表明:TBEV 具有很高的遗传稳定性。

图1 ALSV NS3-like 和NGOV NS5 基因片段与TBEV全基因组的基因结构图以及进化分析Fig. 1 Gene structure map and phylogenetic analysis of ALSV NS3-like and NGOV NS5 genome and TBEV complete genome
2.4 基因结构及氨基酸分析以黑龙江ALSV H3 经典株2 811 nt(MH158417)作为参考株,ALSV HLJ Sequence 1 和ALSV HLJ Sequence 2 位 于H3 株NS3-like 基因编码框内(934 nt~2 463 nt)(图1A)。所扩增片段与其他ALSV 株基因推导氨基酸同源性为99.21%~98.43%,与俄罗斯Miass519 株同源性最高,与H3 株同源性最低,与JMTV/I.ricinus/France 株同源性为98.86%。H3 株NS3-like 编码810 个氨基酸,HLJ Sequence 1/2 编 码509 个 氨 基 酸 位 于H3 株aa273~aa781 区域,无氨基酸的缺失或插入,与H3株相比有8 个氨基酸发生变异,分别为R494H、T544A、R565K、G628E、V642A、R678K、P743L 和V759I,其中第494 氨基酸位点与法国JMTV/I.ricinus/France 经典株氨基酸一致,第565 位点与黑龙江JMTV HLJ/2015 流行株氨基酸一致。分析表明:ALSV se⁃quence 1/2 与JMTV 氨基酸水平上亲缘关系较近。
JiutaiV-JL 与2006 年 非 洲 塞 内 加 尔NGOV 株(DQ400858)相比,本研究扩增到的片段位于其NS5编码框内,分布于NGOV 株3 171 nt~4 079 nt(图1B)。JiutaiV-JL 与NGOV 氨基酸同源性为77.42%,与俄罗斯的西尼罗河热病毒株Reb VLG 07 H 同源性为58.22%,JiutaiV-JL 位于NGOV(aa1114~aa1362)氨基酸区域内,有57 个氨基酸位点变异。分析表明:JiutaiV-JL 与NGOV 株NS5 编码框内氨基酸存在较大的进化差异。
TBEV JL Jiaohe 与TBEV 参考株Primorye-8 基因(JQ825149)比对分析,发现JL Jiaohe 株编码多聚蛋白的ORF 位于该基因组116 nt~10 360 nt 的位置,非编码区域5'UTR 有115 nt,3'UTR 有691 nt(图1C)。JL Jiaohe 株与流行株和疫苗株的氨基酸同源性为99.15%~94.96%,与俄罗斯Primorye-92 株同源性最高为99.15%,与中国疫苗Senzhang 株氨基酸同源性为98.65%。JL Jiaohe 株多聚蛋白共编码3 414 个氨基酸,其结构蛋白与非结构蛋白编码框位置与Primor⁃ye-8 株一致,JL Jiaohe 株与Primorye-8 株比较发现,JL Jiaohe 株有24 个氨基酸位点变异,无缺失或插入。与Senzhang 疫苗株(AY182009)相比,共有45个氨基酸位点变异,其中结构蛋白区域有13 个氨基酸位点变异,非结构蛋白有32 个氨基酸位点变异,NS5 编码框有12 个氨基酸位点发生变异。JL Jiaohe株与牡丹江分离株(JF316707)比较,全部氨基酸有44 个发生变异,NS5 编码区有11 个氨基酸位点变异。分析结果表明近些年TBEV 的氨基酸变异多集中在非结构蛋白NS5 上。
3 讨 论
当前蜱传黄病毒防控存在两个重点:一是监测传统蜱传黄病毒(如TBEV、LIV、POWV、OHFV、KFDV、兰加特病毒)的发病与流行株遗传变异情况[1];二是监测新型蜱传黄病毒的出现,其中新型蜱传黄病毒是近年来的研究热点,陆续发现一些新蜱传黄病毒,例如ALSV[9],此外在蜱中还发现肝炎病毒和瘟病毒相关序列[15-16]。随着研究的不断深入,蜱传黄病毒所涵盖的范围更广,新发现蜱传黄病毒的数目会更多。
本研究根据蜱病毒宏基因组的分析结果,对黑龙江、吉林省采集的蜱进行了黄病毒的检测与鉴定,发现ALSV、NGOV 和TBEV 3 种黄病毒。在黑龙江省伊春友好区、三股流和育林林场3 个地点的游离全沟硬蜱中检测到ALSV 核酸,与该病毒首次报道发现的地区、蜱种一致[9]。本研究发现ALSV 核酸阳性的这3 个采集地点比较分散,彼此间相距100 公里左右,结合刘全等人的研究结果显示该病毒在伊春地区较大范围内广泛存在,同时证实全沟硬蜱是ALSV 的主要传播媒介。该病毒在我国的内蒙古呼伦贝尔、芬兰东南部[17]和俄罗斯均有发现,流行株间氨基酸同源性为99.88%~98.52%。ALSV 是一种全新的病毒,其遗传多样与变异目前不清楚,但鉴于分节段RNA 病毒易于发生的重组事件,极有必要对该病毒进行长期系统的监测。
本研究在吉林九台地区的牛体表采集的日本血蜱中,首次发现新蜱传黄病毒JiutaiV-JL,该病毒株与2002 年在非洲西部塞内加尔的羊体表所采集的伊文斯扇头蜱的NGOV 比较相近,这两种黄病毒数量少,可供参考的基因序列不多,对NGOV 的研究有限,国际病毒分类委员会对黄病毒新种的认定无明确标准,JiutaiV-JL 与NGOV 在不同蜱中发现,彼此间核苷酸同源性较低(69.26%),遗传进化独立成支,推测JiutaiV-JL 是一种新型蜱传黄病毒。与NGOV 相比,这两株病毒发现的时间、地点跨度较大,二者所处的生态环境不同,彼此同源性低,蜱所寄生的宿主、蜱种均不同,提示此类病毒在自然界较为广泛的存在。本研究在该样品的采集过程中观察到蜱所寄生的牛群在林区散养,该牛群活动范围较广(从林区到村庄),与人有密切接触,牛群精神状态较好,采食正常,运动机能正常,无神经症状,由于没有采集牛畜主、牛的血清样品,也无相关文献报道,因此没有证据表明该病毒对人及动物具有致病性。
根据地理分布和基因差异将TBEV 分为3 个亚型:欧洲型(TBEV-Eu)、西伯利亚型(TBEV-Sib)和远东型(TBEV-FE),黑龙江、吉林地区是TBEV 的自然疫源地,当地主要流行株属于远东亚型[6-7],对当地的流行株进行长期监测、对掌握其遗传变异情况以及评估现行疫苗免疫效果具有重要意义。本研究发现的JL Jiaohe 株与东北分离株和疫苗株氨基酸比较,在氨基酸位点的变异多集中在NS5 上。NS5蛋白是黄病毒基因组编码的最大非结构蛋白,同时具有RNA 依赖性RNA 聚合酶和甲基转移酶等活性,其在病毒基因组复制和调控宿主抗病毒过程中发挥重要作用[18]。本研究发现的TBEV 从基因角度来说不同地区发现的TBEV 存在差异,从氨基酸层面来说可能存在一些有意义的氨基酸位点,这可能会影响NS5 蛋白的活性,为以后的疫苗和诊断试剂的研制提供数据参考。
本研究后期曾利用PK-15、MDBK、BHK、C6/36、VERO 和VERO-E6 等细胞分别对ALSV 和NGOV进行病毒分离,所有细胞传至3 代后,未发生病变。随后对3 代细胞培养上清反复冻融,但电镜观察未观察到病毒。提取ALSV 和NGOV 前3 代细胞培养上清的RNA,进行特异性RT-PCR 检测,也未检测到这两种病毒,病毒分离未成功。可能是由于样本中病毒含量较低以及反复冻融对病毒滴度的影响,或者是这6种细胞对ALSV和NGOV敏感度不高。
蜱在自然环境中有较强的适应能力,可以长期保存和传播病毒,使得病毒在自然界长期存在,且对大部分蜱传病毒病缺乏有效的预防和治疗手段,面临旧病未除新病又发的紧迫现状,因此在蜱传病毒自然疫源地开展相关监测,掌握该地区新发、既往蜱传病毒的分布、流行和变异情况,提前做好预防控制,对保护人类与动物健康具有重要的公共卫生意义。本研究进一步揭示黑龙江、吉林蜱传黄病毒的多样性,对该病的预防控措施制定提供科学数据。
