鉴别检测裂谷热病毒NSs 缺失型疫苗株与野生株模拟物的双重荧光定量RT-PCR 方法的建立
2021-01-22杨蕾蕾李基棕江杰元刘茂军张纹纹李文良
杨蕾蕾,毛 立,李基棕,江杰元,刘茂军,张纹纹,孙 敏,李文良
(江苏省农业科学院兽医研究所农业部兽用生物制品工程技术重点实验室/江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏 南京 210014)
裂谷热(Rift valley fever,RVF)是由RFV 病毒(RVFV)引起的急性出血性人兽共患病,该病主要发生于绵羊、山羊、牛和骆驼,也可以传染给啮齿动物和人。RVFV 主要经蚊虫传播,也可通过接触感染或者发病动物的血液、体液、分泌排泄物等被感染。动物感染RVFV 的重症症状为发热、厌食、流涕、急性腹泻、黄疸,羔羊和犊牛,死亡率高达90%,怀孕母羊和母牛流产率高达80%~100%[1]。人感染后通常无症状或者症状较轻,少于5%的病人发展为综合征,如急性肝炎、出血热或者脑炎[2]。世界动物卫生组织(OIE)将RVF 列为A 类疾病,我国将其列为一类传染病。RVFV 属于布尼病毒科(Bunyaviridae)白蛉病毒属(Phlebovirus),为单股负链RNA 病毒,基因组可分为L(大)、M(中)、S(小)3 个节段。其中S 节段以双义编码的方式,编码核蛋白N 和非结构蛋白NSs。M 节段编码两种囊膜糖蛋白(Gc 和Gn),以及NSm 和未知功能的结构蛋白。L 节段序列高度保守,编码RNA 依赖的病毒聚合酶[3-4]。
RVF 最初主要在非洲撒哈拉以南地区周期性流行,2000 年向北蔓延到阿拉伯半岛,引起也门和沙特阿拉伯的疫情大暴发[5]。2016 年,我国发现首例输入性RVF 病例,警示该输入性传染病已对我国的公共卫生安全构成了现实威胁[6]。目前,国际上还没有人用的RVF 商品化疫苗,仅有兽用疫苗被批准,包括灭活疫苗和弱毒活疫苗[7-8]。灭活疫苗虽然安全有效且可用于怀孕动物,但须重复免疫以提高免疫效果;目前主要有3 个弱毒疫苗株:Clone 13、Smithburn 和MP-12,免疫效果良好,可提供较长的保护,但存在安全性风险[8]。其中,Clone 13 弱毒活疫苗已在南非、纳米比亚等国获批,该疫苗安全有效,正常剂量免疫对怀孕动物也安全,其主要毒力因子NSs 基因约70%缺失[9]。Smithburn 有引起流产和畸胎的风险,不能用于怀孕动物;MP-12 在美国用于动物的免疫,且已进入人用疫苗的临床试验,但动物试验仍发现其对怀孕动物有一定的毒力。因此,许多研究者在MP-12 的基础上,进一步缺失NSs 和NSm 基因构建疫苗候选株,它们的毒力比MP-12 更弱,且和Clone 13 一样可以同野毒株区分,实现免疫动物与感染动物的鉴别(Differentiation of infected from vaccinated animals,DIVA),因此这类缺失型疫苗株将是新型疫苗研发的方向,具有的巨大的开发应用潜力[8,10-11]。
因此,建立一种快速准确的针对RVFV 的鉴别诊断技术方法,对于加强我国对RVFV 的检测、严格控制RVF 的输入以及新型疫苗的研发具有现实意义。本研究选择病毒L 基因保守区域以及缺失型疫苗株NSs 基因缺失部位设计相应的引物和探针,建立双重荧光定量RT-PCR 方法,有望在快速检测RVFV 感染的同时实现基因缺失的疫苗株和野毒株的鉴别检测。
1 材料与方法
1.1 主要试剂Transzol UP 试剂、Taq 酶和一步法RT-PCR 试剂盒购自北京全式金生物技术有限公司;大肠杆菌DH5α 感受态细胞购自南京擎科生物科技有限公司;病毒DNA/RNA 提取试剂盒、质粒提取试剂盒和琼脂糖凝胶回收试剂盒购自Axygen 公司;One Step PrimeScript RT-PCR 试剂盒和pMD18-T载体购自TaKaRa 公司。
1.2 疫苗及相关病原小反刍兽疫Nigeria 75/1 疫苗株购自新疆天康畜牧生物技术股份有限公司;绵羊肺炎支原体Y98 株购自中国兽医药品监察所;山羊副流感病毒3型JS2013株、蓝舌病病毒75-1株和山羊疱疹病毒I型JSHA1405株由本实验室分离保存[12-14]。
1.3 引物和探针的设计通过对RVFV基因组序列进行比对分析,选择NSs基因缺失部分(HE687307.1)和L基因(HE687305)的保守区,利用Primer Express 3.0软件和多重PCR 引物设计系统MPprimer 评估引物和探针,进而通过试验确定一个引物探针组合可实现两个基因的良好扩增(表1),引物和探针均由南京擎科生物科技有限公司合成。

表1 荧光定量RT-PCR 所用引物与探针Table 1 Primers and probes for real-time RT-PCR
1.4 重组质粒标准品的构建合成RVFV NSs基因和L基因片段,并克隆至载体pMD19-T中制备质粒作为标准品。基因合成由南京擎科生物科技有限公司完成。将重组质粒标准品测定浓度后,计算拷贝数,并将其10 倍倍比稀释至:1×108拷贝/μL~1×101拷贝/μL,储存于-20 ℃备用。
1.5 双重荧光定量RT-PCR 方法反应体系的优化及标准曲线的建立反应体系为20.0 μL,其中2×一步法RT-PCR 缓冲液10.0 μL,ExTaq HS 酶0.4 μL,50×ROX染料0.4 μL,采用方阵法对L和NSs的引物浓度(0.2 μmol/L、0.4 μmol/L、0.6 μmol/L、0.8 μmol/L、1.0 μmol/L)和探针浓度(0.2 μmol/L、0.4 μmol/L、0.6 μmol/L、0.8 μmol/L、1.0 μmol/L),反应退火温度(52 ℃~62 ℃)分别进行优化。
以1×108拷贝/μL~1×101拷贝/μL 稀释的两种重组质粒标准品为模板进行反应,以起始模板数的对数为X 轴,循环数(Ct 值)为Y 轴做回归曲线,分别建立质粒拷贝浓度与Ct 值对应的定量标准曲线。
1.6 特异性试验将NSs 和L 基因克隆入pcDNA3.1中,转染至293T 细胞,24 h 后收获细胞,按照Transzol UP 试剂说明书提取RNA 作为阳性样品,同时提取其他病原(小反刍兽疫病毒、山羊副流感病毒3 型、蓝舌病病毒、山羊疱疹病毒I 型、绵羊肺炎支原体)的核酸,按上述建立的方法分别进行荧光定量RT-PCR 检测,评估该方法的特异性。
1.7 敏感性试验将构建的两种重组质粒标准品10倍倍比稀释后(1 μL 1.0×108拷贝/μL~1.0×101拷贝/μL)作为模板,利用本研究建立的双重荧光定量RTPCR 方法进行检测,评价该方法的敏感性。同时分别使用引物L-F/L-R 和S-F/S-R 进行普通RT-PCR 检测,比较两种方法敏感性的差异。
1.8 重复性试验选取两种重组质粒标准品的104拷贝/μL、105拷贝/μL、106拷贝/μL 3 个稀释度作为模板分别进行4 次重复扩增,进行组内和组间重复性试验。同时设立阴性对照。
1.9 对野生型和缺失型病毒核酸样品的检测合成缺失型疫苗株的NSs基因(DQ380182),克隆入真核表达质粒pcDNA3.1。将缺失型和NSs 基因表达质粒+L 基因表达质粒分别转染293T 细胞,模拟野生型和缺失型病毒基因mRNA。分别提取核酸后进行双重荧光定量RT-PCR 扩增,检测该方法的鉴别检测效果。
1.10 临床样品的检测采取江苏和安徽4 个羊场的10 份血清样品和12 份鼻拭子样品(用2 mL PBS 缓冲液冲洗,2 000 r/min 离心取上清)各200 μL 加入裂解液,按照DNA/RNA 提取试剂盒说明书提取样品核酸,采用本研究建立的双重荧光定量RT-PCR的方法进行检测,同时与已报道的常规荧光定量PCR 方法[15]检测结果进行比较。
2 结 果
2.1 双重荧光定量方法的建立和优化以10 倍梯度稀释的NSs 和L 重组质粒标准品的混合物为模板进行双重荧光定量PCR 扩增。通过优化,确定双重荧光定量PCR 反应体系引物、探针的最佳配比:L-F/L-R、S-F/S-R 引物(20 μmol/L)各0.4 μL,探针(10 μmol/L)L-P 0.8 μL,探针S-P 0.4 μL(10 μmol/L),模板2 μL,补水至20 μL。优化的反应条件为:42 ℃5 min;95 ℃10 s;95 ℃5 s、60 ℃34 s,40 个循环。
2.2 标准曲线的建立将NSs 和L 的重组质粒标准品10 倍倍比稀释(1.0×108拷贝/μL~1.0×101拷贝/μL)混合作为模板,进行双重荧光定量RT-PCR,以质粒起始模板数的对数为X轴,循环阈值(Ct值)为Y轴做回归曲线,分别建立质粒拷贝浓度与Ct值对应的标准曲线(图1)。NSs的标准曲线方程为:Y=-3.548lgX+43.002,相关系数R2为0.994;L 的标准曲线方程为:Y=-3.588lgX+44.064,相关系数R2为0.997。二者样品拷贝数的对数值与Ct 值之间均具有良好的线性关系,表明所建立的双重荧光定量RT-PCR 体系检测不同浓度的病毒核酸均具有理想的效果。
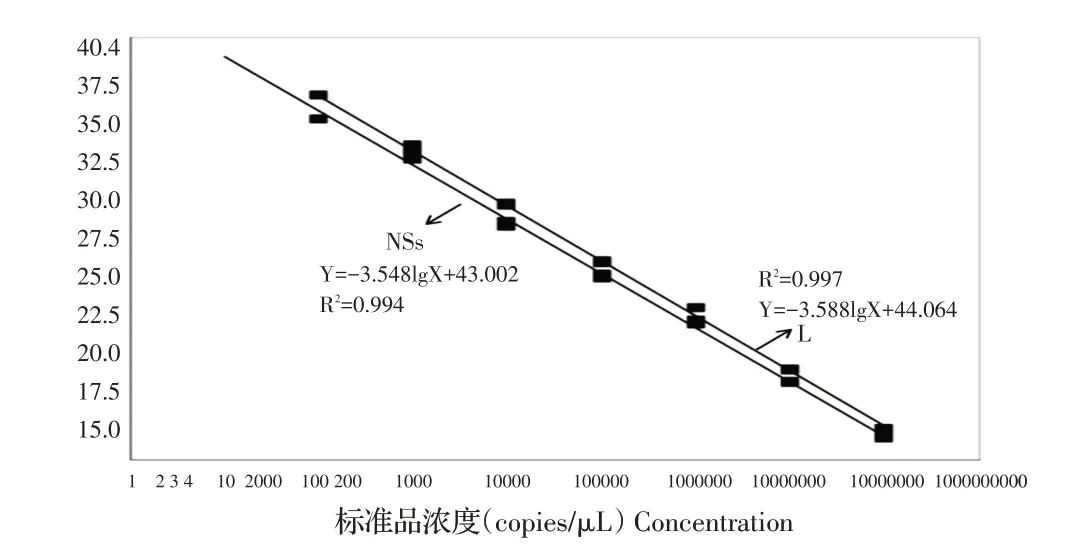
图1 双重荧光定量RT-PCR 方法的标准曲线Fig. 1 Standard curve of duplex real-time PCR
2.3 特异性试验结果分别取RVFV 阳性质粒和其他病原(小反刍兽疫病毒、山羊副流感病毒3 型、蓝舌病病毒、山羊疱疹病毒I 型、绵羊肺炎支原体)的核酸,利用该方法检测。结果显示,该方法仅对RVFV 重组质粒标准品显示NSs 基因和L 基因的阳性扩增曲线,而对其他病原核酸的检测双荧光均为阴性,表明该方法具有较强的特异性(图2)。

图2 特异性试验结果Fig. 2 The amplification curve of specific experiments
2.4 敏感性试验结果将NSs 和L 的重组质粒标准品分别做10 倍梯度稀释,以1 μL 1.0×108拷贝/μL~1.0×101拷贝/μL 的重组质粒为模板,进行双重荧光定量RT-PCR 试验。结果显示,该方法对NSs 和L 质粒标准品的检测下限分别为10 拷贝/μL 和100 拷贝/μL(图3A)。NSs 和L 基因普通RT-PCR检测下限分别为1.0×104拷贝/μL和1.0×105拷贝/μL(图3B)。结果表明双重荧光定量RT-PCR 的敏感性较高。

图3 双重荧光定量RT-PCR(A)与普通RT-PCR(B)敏感性试验结果Fig. 3 Sensitivity test of the real-time RT-PCR(A) and RT-PCR(B)
2.5 重复性试验结果选取NSs 和L 重组质粒标准品的104拷贝/μL、105拷贝/μL、106拷贝/μL 3 个稀释度作为模板分别进行4 次重复扩增,进行组内和组间重复性试验。结果显示,同一模板不同浓度的组内和组间重复变异系数均低于2%(表2),表明该方法稳定性高、重复性好。
2.6 野生型和缺失型病毒核酸样品的检测将同时转染完整NSs 基因和L 基因载体的细胞样品模拟野生型病毒样品,同时转染缺失型NSs 基因和L 基因载体的细胞样品模拟缺失型病毒样品。经双重荧光定量RT-PCR 检测,结果显示,对野生型核酸样品显示FAM(NSs 基因)和JOE(L 基因)呈双阳性扩增曲线;而对NSs 缺失型核酸样品则仅显示JOE(L 基因)阳性扩增曲线(图4)。表明该方法可有效区别野生型病毒和缺失型病毒。
2.7 临床样品的检测提取采集的22 份血清、鼻拭子样品中的核酸,并以其为模板,分别进行双重荧光定量RT-PCR 和常规荧光定量PCR 方法[15]检测。结果显示,仅对RVFV 重组质粒标准品检测为阳性,显示FAM(NSs 基因)和JOE(L 基因)双阳性扩增曲线,而对22 份临床样品核酸的检测双荧光均为阴性,与常规荧光定量PCR 方法结果完全相符。表明本研究建立的双重荧光定量RT-PCR 方法可用于临床检测。

表2 重复性试验结果Table 2 Repeatability test of the duplex real-time RT-PCR

图4 模拟野生型和缺失型核酸样品的检测结果Fig. 4 The amplification curve of mimic wild and deleted type samples
3 讨 论
RVFV 具有虫媒病毒典型的流行特点,从世界范围来看,RVFV 感染流行呈现上升和扩大趋势。我国南方地区气温较高,气候潮湿,适合RVFV 的储存宿主库蚊滋生,具有RVFV 流行的自然条件;尤其是随着我国经济的发展,国际交往日趋频繁,RVFV 传播至国内的风险增加。准确的诊断对于该病的防控至关重要。目前,RVFV 的实验室检测方法有多种,包扩病毒分离、抗原抗体的免疫学检测方法[16-18]、RT-PCR 及荧光定量RT-PCR[19-20]等。其中,RT-PCR 是一种快速、敏感、准确的病原检测方法;而荧光定量RT-PCR 通过引入探针进一步提高检测特异性,且可进行核酸定量检测,国内外已有许多相关研究报道[20-23]。这些方法均可用于野毒感染的定量检测,但无法提供NSs 缺失型疫苗株的鉴别检测。因此,建立一种快速准确的针对RVFV的鉴别检测方法,对于NSs 缺失型疫苗使用地区的鉴别检测以及今后基于NSs 缺失的新型疫苗的研发将具有重要意义。
双重荧光定量PCR 在单一荧光定量PCR 基础上,通过对待检病原的不同基因设置不同的荧光标记探针,以达到一次PCR 反应就可以检测不同靶基因的目的。本研究建立的检测RVFV 的双重荧光定量PCR 方法,通过荧光信号强度较高且干扰较小的FAM 和JOE 两种不同的荧光素,分别标记检测RVFV的NSs 基因和L 基因的探针,可以检测RVFV 野生型和NSs 缺失型核酸模拟物样品。在靶基因选择过程中,首先确定覆盖NSs 缺失区域的片段作为检测靶标之一,随后根据研究报道与序列分析结果先后选择N、L 不同区域设计多组引物探针与之组合,经多次分析与试验检验发现N 与NSs 组合难以获得最佳扩增效果,最终确定L 为检测靶基因并筛选获得最佳的引物组合。
由于我国不是RVF 流行国,无法引入野毒与疫苗毒株进行诊断和疫苗方面的研究,所以本研究建立荧光定量RT-PCR 方法时以人工合成的病毒核酸构建质粒标准品作为检测模板,经检测敏感性与其他报道一致[15,22-23]。同时用真核表达质粒转染细胞提取核酸,模拟病毒感染的样品进行检测。结果表明该方法特异性强且具有鉴别检测的能力,有望用于检测真实的病毒样品。
综上所述,本研究建立的双重荧光定量RTPCR 方法具有操作简单、特异性强、灵敏度高、重复性好、可实现鉴别检测等优点,为疫情诊断和进一步建立鉴别检测方法奠定了基础。
