结肠癌组织中lncRNA XIST、miR-32-5p、EZH2的表达变化及临床意义
2021-01-22李文强李爱杰张云岳金波
李文强,李爱杰,张云,岳金波
1 潍坊医学院临床学院,山东潍坊261053;2 山东省肿瘤医院
结肠癌是常见的恶性肿瘤,世界每年发病患者例数约110万,我国结肠癌发病率不断升高,并且有年轻化的趋势[1-2]。目前结肠癌的发病机制还未阐明,可能与遗传因素、饮食结构、经济状况等有关。因此,探究结肠癌的致病因素对疾病预防及早期筛查意义重大。非编码RNA 是无蛋白编码功能的RNA 分子,近年来研究表明,其在调控基因表达、染色质重构等过程中发挥重要的调节作用,与炎症、免疫及癌变的发生发展有关[3]。长链非编码RNA(ln⁃cRNA)X 染色体失活特异性转录本基因(XIST),位于Xq13.2,该基因是X 染色体上失活中心区域中第一个鉴定出的非编码基因,对X 染色体失活的启动和维持至关重要。研究表明,lncRNA XIST 在多种肿瘤中异常表达,并影响肿瘤细胞的增殖及转移等恶性生物学行为[4-5]。微小 RNA(miR)-32-5p 位于9q31.3,可调控多条细胞信号传导通路,其作为一种抑癌基因,在非小细胞肺癌[6]、口腔鳞癌[7]等恶性肿瘤中表达失调,促进肿瘤的恶性进展。基因增强子的人类同源基因(EZH2)位于7q36.1,该基因编码蛋白是多梳蛋白PcG 家族成员之一,具有多梳抑制复合物2(PRC2)的催化亚基,参与维持基因表达的调控,在细胞分裂增殖、染色体重构及肿瘤发生等生理病理过程中起重要的调节作用[8]。有学者在结直肠癌HCT-8 肿瘤细胞中发现,lncRNA XIST 通过抑制miR-32-5p 的表达,促进EZH2 的表达,促进HCT-8细胞的增殖及迁移等恶性生物学行为[9]。本研究观察了结肠癌组织中lncRNA XIST、miR-32-5p 及EZH2的表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 收集 2018 年 8 月—2019 年 8 月于山东省肿瘤医院诊治的86 例结肠癌患者的临床病理资料。纳入标准:患者均经组织病理学检查明确;患者均为首次诊治,无放化疗治疗史;住院期间相关检查及病理资料完整,患者已签署知情同意书。排除标准:伴肠道急慢性感染性疾病;既往罹患恶性肿瘤病史;伴心肺肝肾功能障碍。结肠癌患者中男51例,女35例;年龄27~78(52.4 ± 7.1)岁;肿瘤位置:直肠31 例,结肠55 例;伴淋巴结转移20 例,无淋巴结转移 66 例;肿瘤直径:≤3 cm 者 60 例,>3 cm 者 26例;肿瘤分期:Ⅰ期 23 例,Ⅱ期 33 例,Ⅲ期 24 例,Ⅳ期6 例;肿瘤分化程度:高分化26 例,中分化28 例,低分化32例。本研究经本院伦理委员会审核通过。
1.2 组织中 lncRNA XIST、miR-32-5p 及 EZH2 检测 各取癌组织及癌旁组织(距离癌组织5 cm 以上)约50 mg,剪碎后研钵中加液氮研磨,加入1 mL TRIzol 后重悬,利用TRIzol 法提取癌组织及癌旁正常组织中的RNA。将获取的RNA 产物按照试剂盒说明书反转录为cDNA,分光光度计检测cDNA 浓度及 纯度 ,cDNA 的 OD260/OD280在 1.8~2.1。 lncRNA XIST 正向引物序列:5"-TTGGGGAACCACCTA⁃CACTTGAG-3",反向引物序列:5"-CCATTTTGCTAT⁃GCGTTATCTGA-3";EZH2 正向引物序列:5"-CCCT⁃GACCTCTGTCTTACTTGTGGA-3",反向引物序列:5′-ACGTCAGATGGTGCCAGCAATA-3′;内参基因GAPDH 正向引物序列:5"-ACAGCCTCAAGATCAT⁃CAGC-3",反向引物序列:5"-GGTCATGAGTCCTTC⁃CACGAT-3";miR-32-5p 上游引物序列:5"-ACACTC⁃CAGCTGGGTACAGTATAGATGATGTACT-3",下 游引物序列:5"-CTCAACTGGTGTCGTGGA-3";内参基因U6 上游引物序列:5"-CTCGCTTCGGCAGCACA-3",下游引物序列:5"-AACGCTTCACGAATTTGCGT-3"。总反应体系20 µL,其中Master Mix 10 µL,上游及下游引物各1 µL,模板cDNA 1 µL,RNA-free 水8µL。LncRNA XIST 及 EZH2 反应条件:95 ℃ 2 min,95 ℃ 20 s,60 ℃ 20 s,70 ℃ 20 s,共40 个循环。miR-32-5p 反应条件:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 20 s,72 ℃ 20 s,共 50 个循环。采用 2-ΔΔCt法计算 lncRNA XIST、miR-32-5p及EZH2的相对表达量。
1.3 统计学方法 采用SPSS22.0 统计软件。计量资料采用-x±s表示,两组间比较采用独立样本t检验;各指标相关性用Pearson 线性相关进行分析。P<0.05 为差异有统计学意义。
2 结果
2.1 结肠癌与癌旁组织中lncRNA XIST、miR-32-5p及 EZH2 表达比较 lncRNA XIST、miR-32-5p 及EZH2 在结肠癌组织中相对表达量分别为2.172 ±0.243、0.544 ± 0.085、1.283 ± 0.212,在癌旁组织中分别为 1.079 ± 0.084、1.651 ± 0.122、0.479 ±0.110,癌组织中 lncRNA XIST、EZH2 相对表达量高于癌旁组织(t=39.423、31.218,P均<0.01),miR-32-5p低于癌旁组织(t=69.042,P<0.01)。
2.2 结肠癌组织中lncRNA XIST、miR-32-5p 及EZH2 表达与患者临床病理特征的关系 癌组织中lncRNA XIST、miR-32-5p 及 EZH2 表达与肿瘤分期有关(P均<0.05),见表1。
2.3 结肠癌组织中lncRNA XIST、miR-32-5p 及EZH2 表达的相关性 结肠癌组织中lncRNA XIST与 miR-32-5p 呈负相关(r=–0.612,P<0.01),miR-32-5p 的相对表达量与EZH2 的相对表达量呈负相关(r=–0.608,P<0.01),而lncRNA XIST与EZH2的相对表达量无明显相关性(r=0.375,P=0.284)。
3 讨论
结肠癌是我国常见的消化系统恶性肿瘤,发病率在恶性肿瘤中排第三[10]。结肠癌的治疗包括手术治疗、放化疗及生物靶向治疗等。早期患者首选手术治疗,但晚期转移患者即使经积极综合治疗仍预后不佳。因此,需深入研究结肠癌的病因及发病机制,寻找新的诊断治疗靶点[11]。结肠癌的发病与遗传因素、环境因素、饮食因素及肠道疾病等有关,各种因素综合作用,促进肠黏膜上皮细胞中癌基因的表达,导致细胞的恶性转化。近年来研究发现,ln⁃cRNA、miRNA 等在肿瘤的发生发展中发挥重要的作用,其可通过转录及转录后等机制调控下游癌基因的表达,促进肿瘤细胞增殖及转移、抑制凋亡等,有助于肿瘤诊断及治疗[12]。
lncRNA 是长度大于200 个核苷酸的非编码RNA。研究表明,lncRNA 在炎症、自身免疫及肿瘤等多种疾病中均发挥重要的调控作用,lncRNA 的异常表达影响疾病的发生发展[13]。lncRNA XIST 结构上具有X 染色体灭活中心域,是近年来发现的参与调控哺乳动物雌性早期发育过程X染色体失活的非编码RNA。近年来发现,口腔鳞癌[4]、胃癌[5]等多种肿瘤中lncRNA XIST 表达升高,其通过表观遗传学调控下游上皮间质转化基因如E-钙黏素、N-钙黏素等的表达,促进肿瘤的恶性增殖、浸润和转移[14]。本研究中,结肠癌组织中lncRNA XIST 表达升高,可能与调控其表达的上游分子异常有关。多数长非编码基因由RNA 聚合酶Ⅱ转录,并且具有组织和时间的特异性,肿瘤发生时某些因子如lncRNA增强子相关因子,能够促进RNA 聚合酶Ⅱ结合到lncRNA XIST基因启动子区域,导致 lncRNA XIST 表达升高[15]。此外,lncRNA XIST 表达与肿瘤分期有关,其原因可能是lncRNA XIST 的过表达能够通过分子海绵抑制miR-137 的表达,进而导致notch1 的过度激活,促进上皮间质转化过程的关键转录因子Snail的表达,降低肿瘤细胞之间上皮性标志E-钙黏素表达,而升高间质性表型如N-钙黏素、波形蛋白等的表达,增强肿瘤的浸润及转移能力[16]。miRNA 是长度为19~25 个核苷酸RNA 分子,可构成RNA 诱导的沉默复合物(RISC),RISC 结合靶基因mRNA 的3"非编码区(UTR),通过影响mRNA 进而达到调控基因的效果。miR-32-5p 是一种发挥肿瘤抑制功能的miRNA。研究表明,miR-32-5p 在非小细胞肺癌、结直肠癌等恶性肿瘤中表达降低,导致其下游癌基因ERBB2 转导子1 的表达增加,进而增强肿瘤细胞的增殖及浸润能力[6,17]。本研究中,结肠癌组织中 miR-32-5p 表达较癌旁组织低,其机制是miR-32-5p 的表达受ln⁃cRNA,如lncRNA GAS5 的表达调控。有研究表明,结直肠癌中lncRNA GAS5 的表达增加,而lncRNA GAS5 能作为分子海绵结合并抑制miR-32-5p 的表达,导致癌组织中 miR-32-5p 表达降低[18];此外,结肠癌高肿瘤分期患者miR-32-5p 表达低于低分期患者,提示miR-32-5p 低表达促进结肠癌的疾病进展。研究发现,miR-32-5p 能结合转录因子Kruppel 样因子 4(KLF4)mRNA 的 3"UTR,促进 KLF4 mRNA 的降解,抑制KLF4 的表达。但肿瘤发生时,肿瘤细胞中miR-32-5p 表达降低,导致KLF4 的表达升高,而KLF4促进细胞周期相关癌基因如周期素D1等的表达,导致肿瘤细胞增殖及转移能力增强[19]。
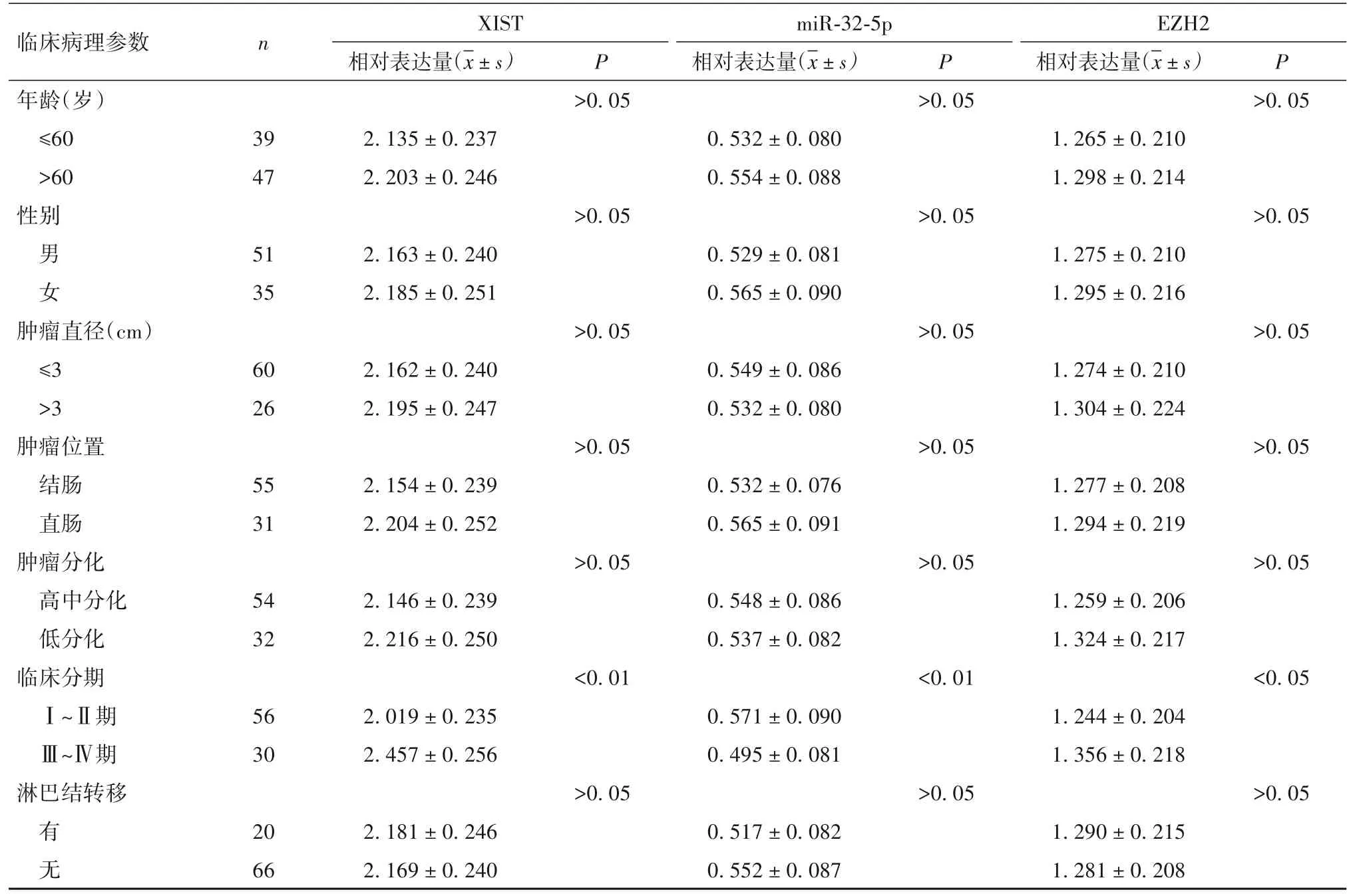
表1 结肠癌组织中lncRNA XIST、miR-32-5p及EZH2表达与患者临床病理特征的关系
EZH2 作为多梳蛋白家族成员之一,在胚胎发育的早期能够调控细胞的增殖及分化功能[20]。近年来有学者发现,EZH2 基因的持续激活能够促进细胞的恶性增殖及转化,可能是肿瘤重要的致癌基因。机制上,EZH2 参与构成组蛋白甲基转移酶,促进组蛋白赖氨酸甲基化,抑制多种P53 等抑癌基因的表达,促进肿瘤的进展[21]。我们的研究发现,癌组织中EZH2 表达上调,这可能与miRNA 对EZH2 的转录后调控有关。WANG 等[22]研究表明,结肠癌发生时抑制EZH2 表达的miRNA 如miR-600 表达降低,引起肿瘤中EZH2 的表达升高。此外,结肠癌中EZH2 的表达与肿瘤分期有关。可能原因是肿瘤发生时EZH2 的表达升高,引起组蛋白去乙酰化酶的活性降低、P53基因H3K27位点的甲基化水平增加,导致P53 基因的G2/M 期周期阻滞功能丧失、肿瘤细胞的增殖及浸润能力提高[23]。
本研究进一步分析结肠癌中lncRNA XIST、miR-32-5p 及EZH2 表达的相关性,结果显示ln⁃cRNA XIST 与 miR-32-5p 的表达呈负相关,miR-32-5p 与EZH2 的表达呈负相关,其机制可能是lncRNA XIST 能够作为分子海绵结合并抑制miR-32-5p 的表达,导致miR-32-5p 水平降低,而miR-32-5p 能够特异性结合并抑制EZH2的表达,即lncRNA XIST 能够通过miR-32-5p/EZH2 分子轴促进结肠癌肿瘤细胞的增殖及迁移[9]。
综上所述,结肠癌组织中lncRNA XIST 与EZH2表达上调,而miR-32-5p 表达下调,癌组织中ln⁃cRNA XIST、miR-32-5p 及 EZH2 表达与肿瘤分期有关,lncRNA XIST、miR-32-5p 及 EZH2 三者共同参与结肠癌的恶性进展。但三者的具体作用机制及临床应用价值仍需深入研究。
