环状RNA HIPK3在上皮性卵巢癌组织中的表达及其与临床病理和预后的关系探究
2021-01-21黄文凤伦朝伟韦励
黄文凤,伦朝伟,韦励
(东莞市人民医院妇产科,东莞 523000)
卵巢癌(Ovarian Cancer,OC)是常见的女性生殖系统恶性肿瘤,其病症隐匿一经发现多处于中晚期且易复发转移,晚期OC患者5年累积总生存率(OS)仅为30%左右。上皮性卵巢癌(Epithelial Ovarian Cancer,EOC)是卵巢癌最常见的组织学类型,约占卵巢恶性肿瘤的90%,其中高级别浆液性OC占EOC病理亚型的60%~75%左右,临床预后较差,严重威胁女性生命健康[1-2]。目前,以肿瘤细胞减灭术联合铂类化疗为主的一线治疗方案是OC临床治疗的主要手段,但其患者术后5年OS仍较低[3]。因此进一步探究EOC发生发展机制、找寻潜在肿瘤标志物或治疗靶点对提高患者预后具有重要意义。近年来,研究发现非编码RNA在基因组稳定性、细胞功能及生命多样性等方面发挥重要作用,现为肿瘤临床研究的主要方向。环状RNA(Circular RNA,circRNA)是具有闭合环状结构的一种新型非编码RNA,其表达水平高、稳定且分布广泛[4]。最新研究发现,circRNAs在多种肿瘤中异常表达,参与调控细胞的增殖、侵袭及迁移,通过信号通路正向或负向调控癌细胞的生物学行为[5-6]。circRNA HIPK3是新发现的一种circRNA,由同源结构域相互作用蛋白激酶3(HIPK3)第2个外显子环化而成,高通量测序及Circbase数据库显示circRNA HIPK3在人脑、心脏、结肠及肺和胃等5个正常组织中表达水平较高,提示其可能发挥重要作用。研究发现circRNA HIPK3在肺癌、肝癌、膀胱癌及卵巢癌等中均差异表达,调控癌细胞的各种生物学行为,参与肿瘤的发生发展进程,具有成为治疗靶标的潜质[7-10]。因此,本研究拟于临床病理层面探究circRNA HIPK3在EOC组织中的表达及其与临床病理和预后的关系,以期为EOC临床治疗及提高患者预后提供价值参考。
资料与方法
一、研究对象
回顾性分析2011年5月至2014年12月于我院接受手术治疗的80例EOC患者的临床病理资料。收集患者癌组织标本进行研究,并选取其对应癌旁正常组织(距癌灶边缘大于5 cm)标本作为对照。纳入标准:经术前影像学及术中、术后病理确诊为EOC;均为原发性肿瘤接受手术治疗;术前未行相关放化疗治疗,未合并其他肿瘤或既往有相关手术史;病理分期符合国际妇产科联盟(FIGO)中EOC诊断标准;临床病理资料完整。排除标准:排除继发性EOC病例;合并重要脏器功能异常;凝血功能障碍无法耐受手术者;临床病理资料不完整病例等。
二、主要试剂和仪器
Trizol试剂(Invitrogen,美国);Prime ScriptTMRT reagent Kit逆转录试剂盒(Invitrogen,美国);Vii ATM7 DX荧光定量PCR仪(南京诺唯赞)。
三、研究方法
1.样品收集:所有EOC患者原发灶癌组织及其对应癌旁正常组织样品(组织样品大小2.0 cm×2.0 cm×0.3 cm)均为手术无菌条件下获取,冰冻病理,后置于低温液氮中保存,经固定、脱水、透明、石蜡包埋、切片等操作制成组织标本,均来自我院病理科。
2.总RNA提取及逆转录:采用Trizol法提取组织样本总RNA,经测量其浓度及纯度后,按照Prime ScriptTMRT reagent Kit逆转录试剂盒说明书逆转录合成cDNA。
3.实时荧光定量PCR(qRT-PCR):以逆转录合成的cDNA为模板配置10 μmol/L PCR反应体系,应用Vii ATM7 DX荧光定量PCR仪进行扩增反应,以GAPDH为内参。相关引物序列由上海捷瑞生物科技有限公司设计合成,引物序列如下:circRNA HIPK3上游:5′-TAGACTATGCGTCGCGCAGT-3′,下游:5′-TCGACTAGACAGCTGATTGTC-3′;GAPDH上游:5′-GCGTGTCATCCATCAGATGTATCAC-3′,下游:5′-GTGCTGATCAGTCGTT GCACGATACG-3′。反应条件:50℃ 2 min、95℃ 10 min预变性,然后95℃变性15 s、60℃复性60 s、95℃延伸15 s,共循环40次。实验重复3次,采用2-△△CT法分析目的基因相对表达含量。
4.术后随访:术后通过电话及门诊复查等方式对入组患者进行为期5年随访。随访间隔:第1~2年每3月1次,第3~5年每6个月1次;随访内容包括:常规体格检查、肿瘤标志物检查、胸片、超声、复查盆腔和腹腔计算机X线断层扫描(CT)及磁共振成像(MRI)或CT等。随访时间截止2019年12月底。本研究以术后5年OS为研究终点。OS为自接受手术治疗后次日开始至患者因任何原因出现死亡的时间。
四、统计学分析
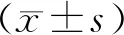
结 果
一、EOC患者临床基本特征
入组80例EOC患者年龄为25~78岁,平均年龄(52.5±9.8)岁,平均体重指数(BMI)(23.4±3.8)kg/m2。入组患者的临床基本特征见表1。
授予学分:经考核合格,授予《金陵胎儿医学高层论坛-胎儿疾病相关母婴保健技术研讨班》(省级继教项目编号:2017320502011)Ⅰ类学分 5 分。
二、实时荧光定量PCR(qRT-PCR)结果
与癌旁正常组织相比,EOC癌组织中circRNA HIPK3表达水平显著降低,差异有统计学意义(P<0.05)(图1)。
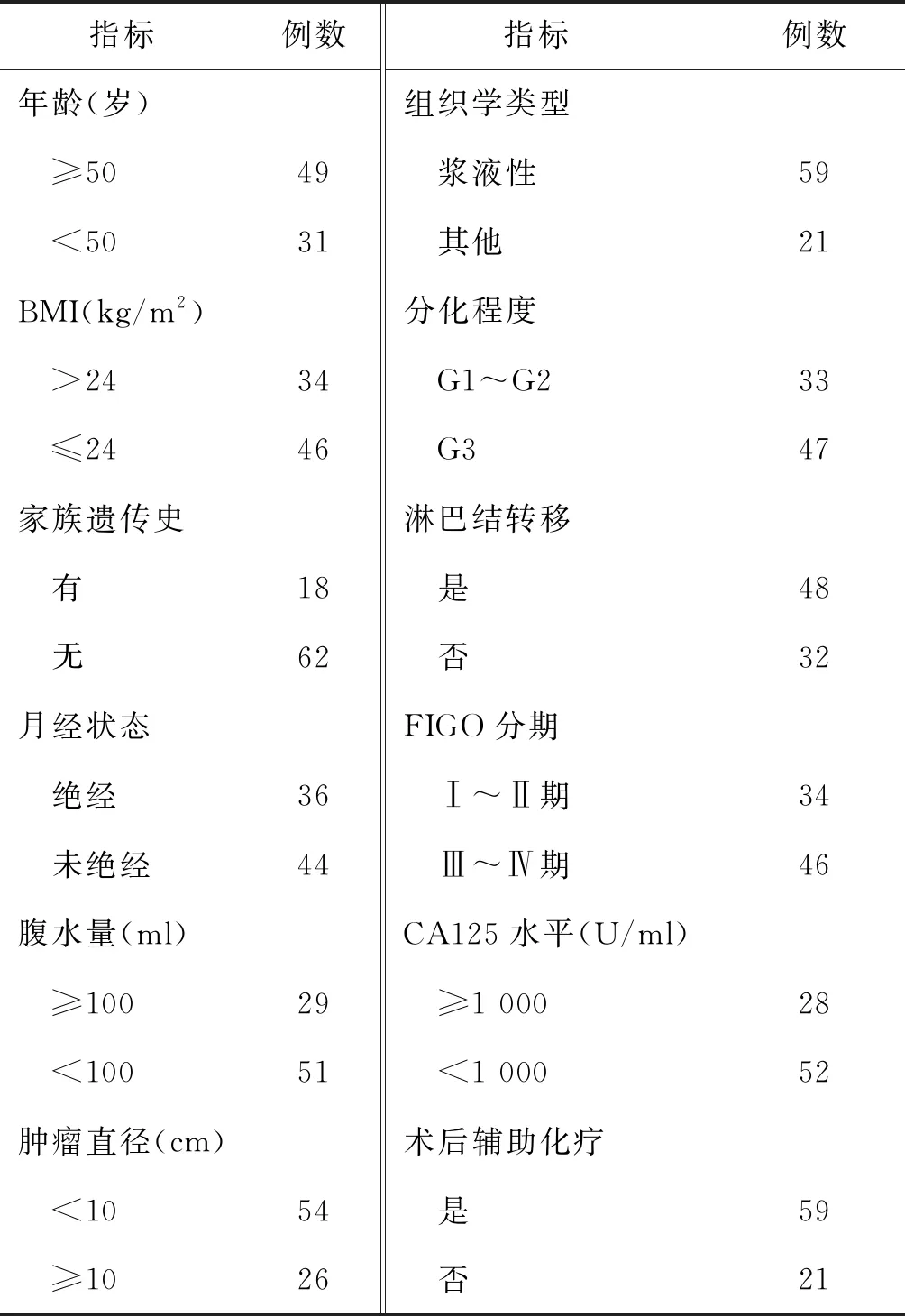
表1 EOC患者临床基本特征
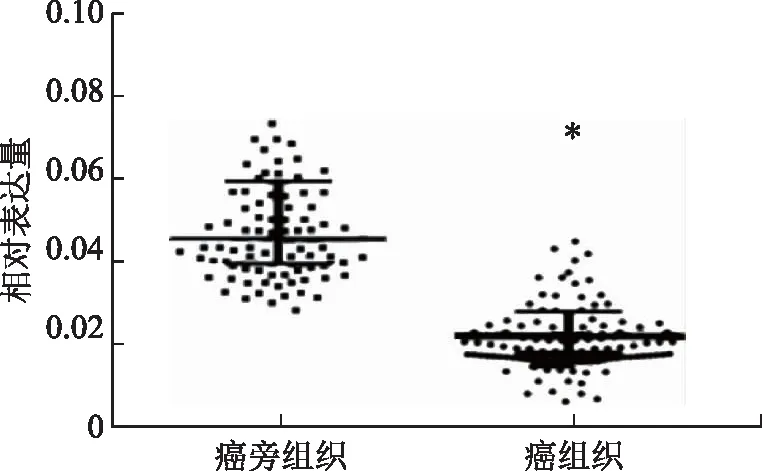
与癌旁组织比较,*P<0.05图1 circRNA HIPK3的表达情况比较
三、EOC临床病理特征比较
根据癌组织中circRNA HIPK3表达水平的平均数进行分组,分为高表达组(n=31)和低表达组(n=49)。组间肿瘤直径、分化程度、FIGO分期及淋巴结转移有显著性差异(P<0.05),而组间年龄、BMI、家族史、月经状态、腹水量、组织学类型及CA125水平等均无显著差异(P>0.05)(表2)。
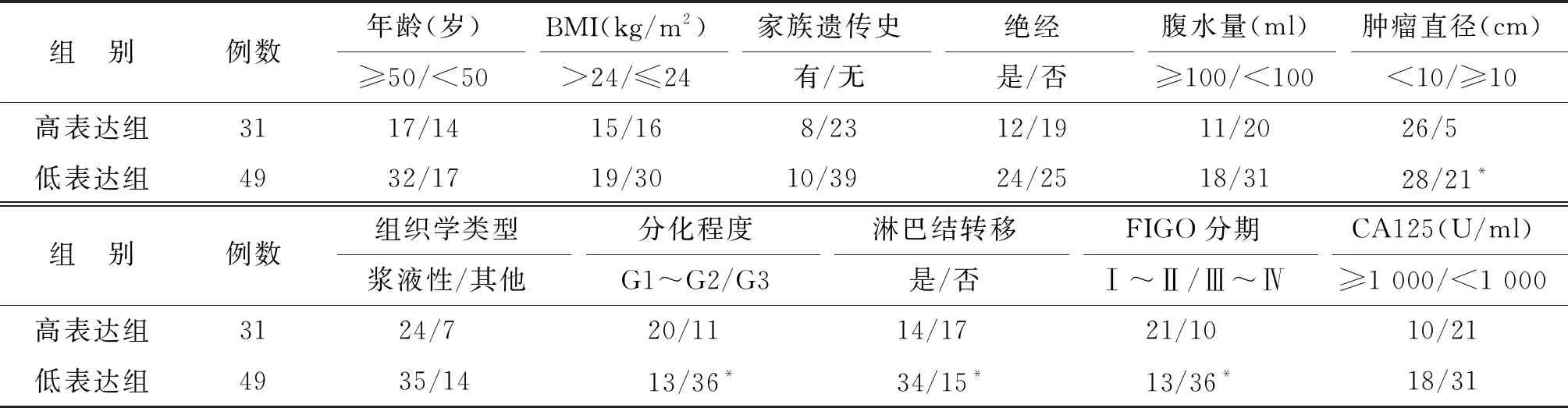
表2 EOC临床病理特征比较
四、circRNA HIPK3表达量与EOC患者预后的关系
截止随访结束,入组患者均获得完整随访资料,随访时间9~60个月,中位随访时间为42个月,其中失访11例(高表达组3例,低表达组8例),死亡38例(高表达组8例,低表达组30例)。K-M生存曲线分析预后OS结果表明,高表达组术后1、3、5年累积OS分别为96.8%、90.3%、74.2%,低表达组术后1、3、5年累积OS分别为89.8%、69.4%、38.8%;对比发现circRNA HIPK3高表达组患者具有更好的术后5年总OS,组间差异具有统计学意义(P=0.001)(图2)。
五、Cox比例风险回归模型分析
Cox比例风险回归模型单因素分析发现,腹水量、分化程度、FIGO分期、淋巴结转移、术后化疗及circRNA HIPK3表达量与EOC患者预后密切相关(P<0.05);多因素分析发现,分化程度(G3)、FIGO分期(Ⅲ~Ⅳ期)、发生淋巴结转移、术后未辅助化疗及circRNA HIPK3表达量低是EOC患者预后不良的独立危险因素(P<0.05)(表3)。

图2 生存分析函数
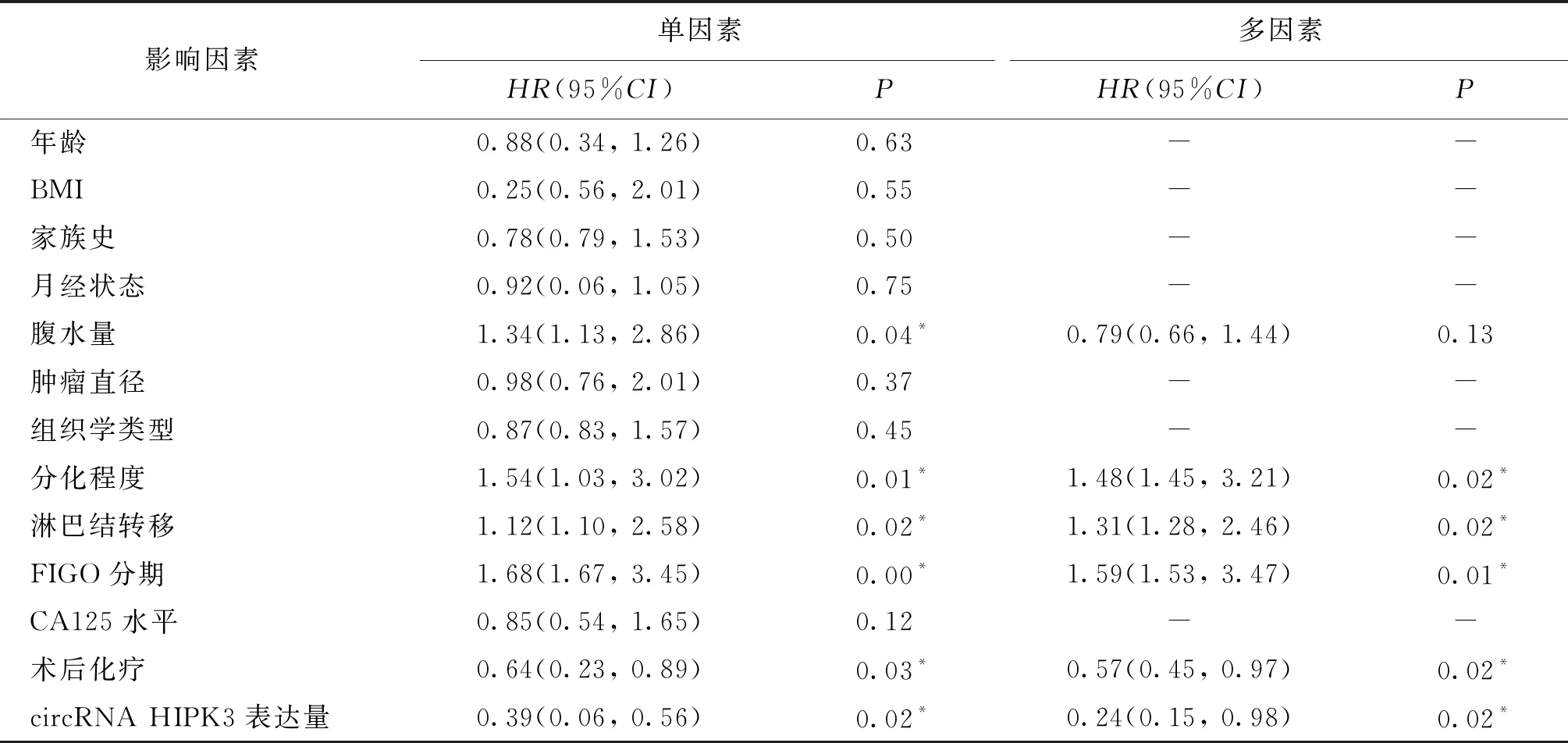
表3 EOC患者预后不良Cox风险回归分析
讨 论
卵巢癌(OC)作为常见的妇科恶性肿瘤,易复发转移,其不同组织类型的组织结构及生物学行为具有较大差异,严重影响女性生命健康。近年来大量研究发现,非编码 RNA在表观遗传学等方面发挥重要的调控作用,大量非编码RNA 相互影响形成高度复杂的调控网络,调控细胞增殖、分化等生物学行为,参与疾病进展[11]。因此,深入探究肿瘤发病机制,找寻有效的肿瘤标志物及治疗新靶点是临床目前研究的主要方向及重点。
circRNA是一种具有闭合环状结构的新型非编码RNA,其通过外显子或内含子环化将5’端和3’端连接,与线性RNA相比更稳定,具有组织特异性和表达特异性[4]。研究表明,circRNA通过作为内源性竞争RNA影响miRNA转录后调控;基因表达及转录调控;直接结合RNA蛋白及直接翻译表达有效蛋白等机制发挥生物学功能[12]。并有研究发现circRNA大量存在于真核细胞中且结构稳定,可以通过直接或间接调节基因或信号通路来影响肿瘤的发生发展,在人的血液及唾液等中稳定表达,显示出具有作为肿瘤诊断、治疗及预后标志物的潜质[13-15]。近年来,肿瘤研究领域证实,circRNA在胃癌、乳腺癌、高级别卵巢浆液性癌、结直肠癌、口腔癌、膀胱癌及肺癌等多种恶性肿瘤中均异常表达,通过上调原癌基因或抑癌基因进而发挥抑癌或促癌基因的双重作用,调节癌细胞的各种生物学行为[16-22]。进一步分析临床病理数据发现,部分circRNA表达与肿瘤临床病理分期、分化程度、淋巴结转移及肿瘤大小等病理因素及预后相关[23-24]。circRNAs特殊的闭环结构及良好的稳定性和组织特异性以及敏感性,使得其有望成为新的临床肿瘤标志物及治疗靶点[4,13]。因此对差异表达的circRNA进行分析可于基因水平阐明肿瘤的发病机理及调控通路,为肿瘤的临床干预及治疗提供新的思路。然而目前有关circRNA在OC中的功能仅有较少研究报道,circRNA 0061140在EOC中高表达,促进癌细胞的生长及转移,可能通过吸附miR-370调控叉头框蛋白M1(FOXM1)表达,调控OC的进展[25]。circRNA ITCH在OC中低表达,其过表达时可抑制OC细胞的增殖和侵袭,通过靶向miR-145/Ras p21蛋白活化因子1(RASA1)信号通路抑制OC的恶性进展[26]。
Zheng等[27]利用基因芯片对多例正常组织及癌组织进行检测发现,circRNA HIPK3在众多癌组织中表达异常,其表达丰度是正常组织表达量的几十倍,认为其可能是肿瘤发生发展的重要标志基因,或有可能作为肿瘤临床诊断的标记物。circRNA HIPK3通过调控多个miRNA调节细胞生长[27]。circRNA HIPK3通过调控miR-558抑制膀胱癌细胞中肝素酶的表达,circRNA HIPK3与HIPK3在膀胱组织中的表达负相关[9]。circRNA HIPK3通过吸附miR-7促进结直肠癌的生长和转移[28]。circRNA HIPK3通过分泌miR-124和调节肝癌水通道蛋白3(AQP3)的表达来调控肝细胞的增殖和迁移[8]。肺癌中circRNA HIPK3通过抑制miR-124发挥致癌特性[29]。circRNA HIPK3通过调控miR-654/IGF2BP3信号通路调控胶质瘤进展,可作为预后标志物[24]。而最新研究通过高通量测序筛选也发现EOC中circRNA HIPK3是表达丰度最高的circRNA,进一步研究发现OC细胞系中circRNA HIPK3表达下调,沉默其表达后促进了癌细胞的增殖、侵袭及迁移、抑制细胞凋亡,其机制可能通过竞争性内源RNA(ceRNA)机制调控OC恶性进展;circRNA HIPK3表达上调可预测EOC不良预后[10,30]。然circRNA HIPK3在OC组织中的临床意义尚不明确,基于此,本研究经采用qRT-PCR检测EOC组织及癌旁正常组织中circRNA HIPK3的表达,发现EOC组织中circRNA HIPK3表达显著降低,提示在EOC中circRNA HIPK3可能发挥抑癌基因的作用;通过χ2检验分析circRNA HIPK3表达量与EOC患者临床病理的关系,发现circRNA HIPK3表达量与肿瘤直径、分化程度、FIGO分期及淋巴结转移显著相关(P<0.05),提示circRNA HIPK3可能参与EOC恶性发展进程;K-M生存曲线及Cox回归模型分析发现circRNA HIPK3高表达EOC患者具有良好的OS,circRNA HIPK3低表达是影响EOC患者不良预后的独立危险因素之一,提示circRNA HIPK3可作为EOC新的肿瘤标志物及治疗靶点。
但本研究由于样本量小和样本集中等局限性仅探究了circRNA HIPK3与临床病理及预后的关系,未深入探究circRNA HIPK3参与调控EOC发生发展的分子作用机制。其次,有研究指出circRNA部分功能是通过直接或间接地调节自身亲本基因的表达进而发挥作用[31],而EOC中circRNA HIPK3与亲本基因HIPK3间具有怎样的表达相关性本研究尚未进行研究证实,也是本研究的不足之处。再者,就目前而言有关circRNA在OC中的研究报道相对较少。因此后期还需继续扩大研究样本量进行深入探究为本研究结果进行补充说明,进一步明确circRNA HIPK3的作用机制,同时找寻更多有效的肿瘤分子标志物为OC的临床诊治提供更多价值参考。
综上,EOC组织中circRNA HIPK3显著低表达,circRNA HIPK3表达量与FIGO分期、分化程度及淋巴结转移等临床病理及预后因素显著相关,是影响EOC患者不良预后的独立危险因素之一,可望作为新的临床肿瘤标志物及治疗靶点应用于临床。
