肝移植术后急性肾损伤的研究新进展
2021-01-21白明传毛慧娟
白明传 毛慧娟
210029 南京,南京医科大学第一附属医院(江苏省人民医院)肾内科
近年来,肝移植(liver transplant,LT)逐渐成为终末期肝病(end-stage liver disease,ESLD)的首选治疗方法。随着器官保存方式、手术和麻醉技术以及免疫抑制剂等方面的不断进展,LT的预后持续得到改善,目前患者的1年生存率>85%,5年生存率也达到75%以上[1]。而急性肾损伤(acute kidney injure,AKI)作为LT常见的并发症,在某些研究中发生率为12%~94%,并且4.5%~21.0%的患者在移植术后需要进行短暂的肾脏替代治疗(renal replacement therapy,RRT)[2]。越来越多的证据表明,LT后早期发生AKI,即使是短暂的,也可影响受体和移植物的短期及长期预后,导致急性排斥反应和感染并发症的发生率增加、住院时间延长、住院费用增加以及病死率升高[3-5]。
LT后AKI发生的危险因素是多种多样的,例如术前受体的病情[严重的ESLD、较高的终末期肝病模型(model of end-stage liver disease,MELD)评分、术前肾功能不全等],术中情况(尤其是缺血再灌注损伤),术后情况(二次手术、移植物功能障碍、感染、药物毒性、术后护理差等)[6-7]。本文旨在总结LT术后AKI有关定义的新见解,归纳与其发生有关的危险因素,并提出可能的预防策略及管理方法,改善LT患者的预后。
一、AKI的诊断
1.AKI的定义 目前在患有肝病的患者中很难定义AKI,因为肾功能不全是由于机体环境中功能变化(如血流动力学紊乱)和结构变化(如肾脏炎症和微血管变化)共同作用的结果[8]。而LT患者术后AKI除了受到上述因素影响外,还受到难以辨别和量化的患者特征、潜在的肾脏疾病、术中及术后因素的影响等[9]。
过去几年中,肝硬化AKI的定义发生了几项重大变化(表1)。2012年,急性透析质量倡议(acute disease quality initiative,ADQI)建议采用急性肾损伤网络(acute kidney injury network,AKIN)标准替代传统定义中使用固定的血清肌酐临界值>1.5 mg/dL来定义肝硬化患者的AKI[10]。由于这些标准与AKI的病因无关,因此将1型肝肾综合征(hepatorenal syndrome,HRS)归类为AKI的特定类型。
国际共识会议和国际腹水俱乐部(international club of ascites,ICA)根据改善全球肾脏病预后组织(Kidney disease: Improving global outcomes,KDIGO)指南再一次定义了肝硬化中的AKI,即48 h内血清肌酐升高超过0.3 mg/dL或在前7 d内血清肌酐升高超过基线的1.5倍[11]。并且建议使用分期系统来定义AKI的严重程度,根据严重程度来预测患者的短期及长期预后,从而定制相应的管理决策。
在重症监护病房患者中,尿量是AKI早期且敏感的标志物[12]。尽管以前没有将尿量包括在肝硬化患者的AKI定义中,但最近一项研究表明,符合尿量标准患者的病死率显著增加。联合尿量标准诊断的AKI的病死率比仅基于血清肌酐的标准增加了50%[13]。因此,尿量应纳入AKI的诊断标准。但基于目前临床状况的差异性,尿量的获取存在方式及主观上的困难及局限性,希望未来可以存在更为便捷有效的措施来提高诊断的准确性。
2.生物标志物 在一般人群中,常用于诊断和确定AKI病因的传统生物标志物包括血清肌酐、尿量、钠或尿素排泄量以及尿蛋白。但是对于ESLD患者来说,这些传统标志物都有一定的局限性。肌酐是肌酸的代谢产物,并且主要在肝脏中合成。肌酐的产生取决于饮食中肌酸的摄入量、人体肌肉质量和肝脏功能。与健康人相比,肝病患者的肌酐生成量减少约50%[17]。此外,液体超负荷也可能会掩盖血清肌酐的升高,从而低估AKI的严重程度。以往研究表明,仅凭血清肌酐可能高估等待肝移植患者的肾功能,并低估移植受者的术后肾功能[18]。实验室肌酐检测容易受到色原体(如胆红素)的干扰,从而可能高估肾功能。另外,血清肌酐的绝对值及其变化都无法区分肾脏的功能障碍与结构变化。已经有研究表明在LT患者中,传统标志物和肾脏活检结果之间的相关性很差[19]。
基于血清肌酐的这些局限性,研究者呼吁使用肾小管损伤和应激标志物来识别和诊断AKI,其中包括中性粒细胞明胶酶相关脂蛋白(neutrophil gelatinase-associated lipoprotein,NGAL)、肾损伤分子1(kidney injury molecule-1,KIM-1)、白介素18(interleukin-18,IL-18)等。因为它们能够最早反映出缺血相关事件,可能在AKI的鉴别诊断中发挥作用,因此得到了最广泛的研究。
NGAL是一种小分子分泌性多肽,当肾小管损伤时可显著上调,从而在血浆和尿液中检测到。有研究表明,检测血浆或尿液中的NGAL有助于预测早期AKI[20]。Wagener等[21]的一项对92例肝移植受者的前瞻性研究中证明肝移植后3 h尿NGAL/尿肌酐比值是预测移植后AKI的可靠指标,并且比血清肌酐预测提早约2 d时间。另外一项研究表明,血和尿NGAL可以在缺血再灌注后1~2 h内早期检测出AKI[26]。但是值得注意的是,NGAL在许多不同的组织中也有少量存在,急性和慢性的全身性炎症均会促进NGAL的释放,无法特异地测量肾小管细胞释放的NGAL,限制了其作为AKI特异性标志物的潜力。

表1 AKI的定义和分期的发展变化
与LT后AKI肾脏恢复相关的生物标志物可以指导移植方式及策略,其中组织基质金属蛋白酶抑制剂-1(tissue inhibitors of metalloproteinase 1,TIMP-1)及骨桥蛋白表现出了积极作用。TIMP-1作为基质金属蛋白酶的抑制剂,可以减少肾脏修复过程中细胞基质的降解。骨桥蛋白是AKI诱导的肾保护蛋白,可能有助于肾小管上皮细胞的再生。有一项研究表明,TIMP-1、骨桥蛋白联合患者的特征(如年龄、糖尿病等)可以有效区分出LT受体发生AKI是否可逆[23]。但是这些结果仍需要进一步研究证实。
二、AKI的危险因素
LT后AKI的发生通常是多种因素综合导致的,这其中包括了供体、受体、移植物质量、围手术期事件以及早期移植后免疫抑制等各种原因。LT后出现的任何程度的肾功能不全大多预示着不良的预后,比如导致急性排斥反应和感染并发症的发生率增加、住院时间延长、住院费用增加以及病死率升高[3-5]。因此了解上述各种不良因素的作用对LT患者术后的恢复显得尤为重要。本文列举了近5年相关研究中肝移植术后AKI发生的危险因素。(表2)
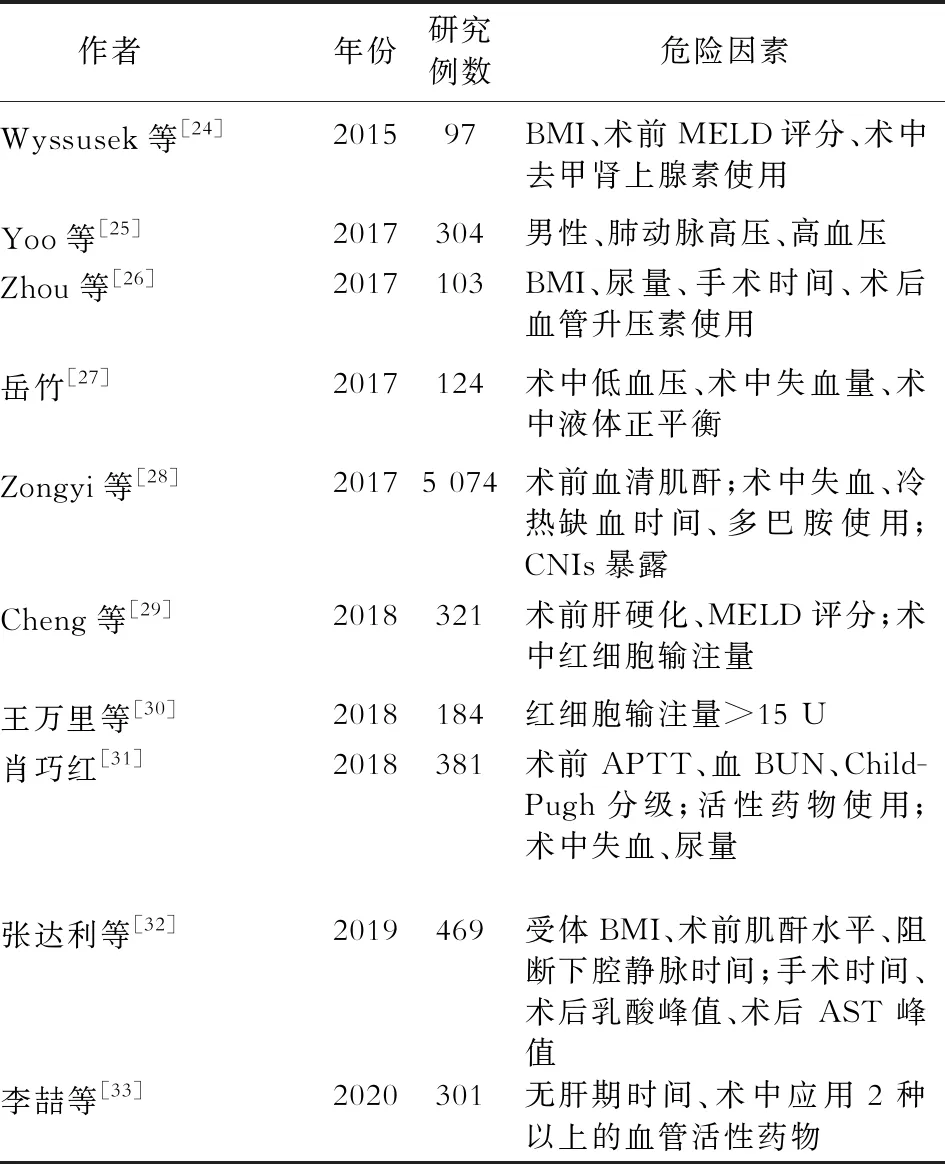
表2 近5年研究中肝移植术后AKI发生的危险因素
1.受体和供体因素 对于受体来说,移植前MELD评分高的患者发生移植后AKI的风险更高。在一项单独分析MELD评分3个组分的研究中,移植前国际标准化比值与移植后AKI密切相关[34],这提示肝脏疾病的严重程度是移植后AKI发生的重要因素。血清肌酐作为反映肾功能状况的常用指标,在移植后AKI发生的过程中也起着一定作用。虽然,术前单次测量血清肌酐似乎不是移植后AKI发生的重要危险因素,但是移植后发生晚期AKI的患者术前肌酐水平似乎更高[35]。另外,非酒精性脂肪性肝炎与其他肝脏疾病相比,移植后AKI更常发生。其中的机制可能是发生脂肪变性和炎症的肝脏释放多种促炎物质、全身性胰岛素抵抗或动脉粥样硬化性血脂异常。
而供体方面,与脑死亡捐赠者的移植物相比,循环死亡捐赠(donation after circulatory death,DCD)移植后AKI的发生率更高[36]。在DCD移植中,供体和受体的总热缺血时间与移植后AKI的发生风险有关[37]。
2.手术因素 手术过程中任何导致肾脏灌注不足的事件都可能导致术后AKI的发生。再灌注综合征(post-reperfusion syndrome,PRS)是一种以在手术特定阶段器官再灌注时引起心血管血流及代谢紊乱为特征的术中并发症,并且可以诱发AKI的发生,从而影响受体AKI的发病率和病死率。另外,有研究表明,冷缺血时间(cold ischemia time,CIT)和移植物脂肪变性都与PRS有关[38]。CIT的增加可能会导致缺血再灌注损伤增加,从而引起促炎介质释放、自由基产生、嗜中性粒细胞螯合和活化,导致PRS[39]。
手术方式方面,保留腔静脉技术(背驼式技术)在腔室吻合时避免了腔静脉完全夹持。在整个过程中保留腔室流量可确保静脉血回流至右心腔,从而降低血流动力学不稳定的风险,并且防止肾脏充血。最近的一项荟萃分析表明,与无分流术相比,该技术与术后早期红细胞的输注量减少以及血清肌酐降低有关[40]。另外,在活体供体肝移植中,远端缺血预处理也可以减少术后AKI的发生[41]。
国内多项研究表明,术中大量失血和输血也可导致AKI发生[27-28,30-31]。严重的门脉高压伴有大/弥散性侧支血管、门静脉血栓形成和腹部手术可导致失血和肾灌注不足。有研究表明,LT后AKI的发生与失血量和围手术期红细胞输注量之间存在相关性,但因失血量不易测定,所以经常将围手术期红细胞输注量作为失血的替代指标[42-44]。
3.术后因素 在过去的临床研究中,低蛋白血症被认为与AKI的发生有关[45]。有研究表明在肝移植受体中,术前白蛋白水平低于3.5 g/dL与术后AKI的发生有关[42,46]。另外,术后第二天血清白蛋白水平低于3 g/dL的患者术后AKI的发生率和病死率均较高[47]。但不能明确的是术前和术后白蛋白水平是否是AKI的独立危险因素,到底是白蛋白本身,还是导致白蛋白水平降低的根本原因导致了移植后AKI的发生。
钙调磷酸酶抑制剂(calcineurin inhibitors,CNIs)是LT术后制定免疫抑制方案的主要组成部分,但众所周知,CNIs具有急性或者慢性肾毒性,长期使用可能会导致移植后AKI的发生[28]。除此之外,术后脓毒症、围手术期高血糖,再次手术、移植后心力衰竭、再次移植和早期同种异体移植物功能障碍均与术后AKI的发展有关。
三、AKI患者的管理
1.术前预防策略 患有终末期肝病和腹水的LT受体在移植前后均容易发生AKI。即便如此,利尿剂仍应谨慎使用,即使血清肌酐轻度升高也应停用。应避免使用如非甾体类消炎药、氨基糖苷类、造影剂等各种肾毒性药物[48]。对于大量腹水穿刺抽液和(或)有自发性细菌性腹膜炎的患者,应系统性地使用白蛋白[49],但是没有证据表明除抗生素外,白蛋白可降低细菌性腹膜炎患者AKI的发生率[50]。细菌感染是肝硬化中AKI的常见诱因。对于任何细菌感染的患者均应尽早使用抗生素[51]。为防止感染,静脉曲张破裂出血的患者也应接受抗生素治疗。研究表明,在单独使用类固醇激素相比,使用喹诺酮类药物预防自发性细菌性腹膜炎可以延缓肝肾综合征的发生并提高生存率[50,52]。顽固性腹水患者使用非选择性β受体阻滞剂与AKI风险增加和病死率显著升高有关[53-55]。大量穿刺后,非选择性β受体阻滞剂可能使循环功能障碍恶化[56]。
对于肝肾综合征,尤其是1型肝肾综合征的患者,主要的治疗药物为血管升压素[16,57]。特利加压素与白蛋白联用是首选的治疗方法。但是特利加压素仅可以改善肾功能,降低MELD评分,却不会改善3个月的生存期[58]。因此,建议在研究中计算MELD评分时应纳入特利加压素治疗前的基线MELD[59]。
2.围手术期容量管理 尽管缺乏足够的前瞻性随机对照试验,但众所周知,血容量减少是术后AKI的主要危险因素。关于用于液体复苏的理想液体成分一直存在争议。有学者研究发现,羟乙基淀粉的使用是LT后AKI的独立危险因素。但是另一项随机对照试验显示,当用于活体供体LT患者的容量替代时,羟乙基淀粉不影响肾功能[60]。对于肾功能衰竭的患者,建议使用生理盐水或无钾液体进行静脉输液治疗[61],但是含高氯化物的液体(如生理盐水)会引起高氯酸中毒,进而损害肾血流量并引起AKI。有一项研究表明,输注大量胶体和含高氯化物的晶体均可导致LT后AKI的发生[62]。这些矛盾的结果值得进一步进行充分的随机对照试验研究进行论证。
3.术后治疗与护理 CNIs作为LT后免疫抑制的主要手段,使LT存活率显著提高[63]。然而,CNIs长期使用可导致移植后AKI。研究已经报道了各种CNIs诱导的损伤机制,这些机制可分为早期(少于12个月)和晚期(大于12个月)两种。推测CNIs相关损伤的早期机制是肾动脉血管收缩,并发展为较小程度的血栓性微血管病[64]。值得注意的是,与CNIs相关的肾损伤是剂量依赖性的,荟萃分析表明,最小化剂量的CNIs可以保留和改善LT受体的肾功能[65]。 因此,现在已经提出了多种短期和长期策略来减少CNIs的使用剂量,并且在LT后期可完全停药。
除传统药物治疗外,RRT有助于控制容量平衡、纠正电解质及酸碱紊乱,在改善患者生存率并促进肾脏功能早期恢复方面尤为重要[66]。但一直以来,RRT起始的最佳时机仍存在很多争论。有2项针对重症患者的随机对照试验(ELAIN[67]和AKIKI[68])提示RRT的早期启动可能对生存有有益的影响。但是除了ELAIN试验[70]包括了肝移植后一小部分患者(8%),两项研究均排除了肝硬化和肝肾综合征患者。而最近的一项研究结果表明较早启动RRT并不会降低患者的病死率,反而会增加90 d的透析依赖率和不良反应[69]。我们无法确切确定哪些患者最可能从肝移植后早期RRT中受益最大,因此,建议进行RRT应个性化。
对于需要行RRT的患者,在RRT过程中,需要在维持心率、血压平稳的基础上控制补液的量和速度,量出为入,减轻心肺负担,在治疗早期不一味追求每日液体负平衡,逐渐减少血管活性药物和静脉补液量,适时增加肠内营养量。
由于手术应激、移植肝功能未恢复,糖皮质激素、免疫抑制剂的使用,AKI患者移植后高血糖发生率较高,尤其是术后24 h,建议控制血糖水平为8~10 mmol/L[70]。而临床上患者血糖波动大,控制困难,尚无针对LT术后患者早期血糖控制方案,需要进一步研究探索。
LT术后AKI患者血流动力学易不稳定,同时并发高血糖、大剂量激素及免疫抑制剂使用等,均增加了感染风险。因此,临床上需要我们采取措施预防感染发生,如严格执行手卫生、呼吸机及各种导管维护、输注血制品及脂肪乳类药物时间段冲洗导管、每天进行患体温水擦浴、标本及时送检等。对于已经出现感染的患者需根据病原学检查结果采取有效的抗感染方案。
LT术后AKI的发生可导致各种并发症的发生风险增加,并且严重影响患者短期及长期预后。基于临床总结建议对于移植后AKI患者的管理应采取多学科团队方法管理,其中包括外科医生、护理人员、呼吸治疗师、康复医师、临床药剂师、营养师和物理治疗师的共同参与[71],做到早发现、早诊断、早治疗,以预防移植患者临床预后进一步恶化。
四、结论
AKI作为LT术后常见的并发症,是由多种因素供体导致的。移植后AKI的发生增加了移植后慢性肾功能不全的风险。现有的诊断标准仍需进一步明确优化,血清肌酐及尿量需结合新型生物标记物对AKI进行准确诊断。在移植前所采取的预防AKI的策略可能对于确保移植患者获得良好的术后结果至关重要。针对术后可能引起AKI的各种因素,尤其是免疫抑制药物方面需采取个体化的治疗策略。移植后AKI患者的管理应采取多学科团队方法管理,最大限度地保证LT患者的良好预后。
