枸杞多糖的羧甲基化修饰及抗氧化性能
2021-01-21许春平姚延超白家峰徐石磊贾学伟刘绍华
许春平,姚延超,白家峰,徐石磊,贾学伟,刘绍华
(1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450000;2.广西中烟工业有限责任公司 技术中心,广西 南宁 530001)
0 引言
自由基是人体生命活动中各种生化反应的中间代谢产物,若自由基数量过多且未被消灭时,就会对机体造成不同程度的损伤,加速衰老,严重时可能诱发各种疾病,补充含抗氧化剂的营养物质可提高机体清除自由基的能力[1]。目前,对枸杞多糖的研究主要集中在抗衰老、抗氧化、免疫调节、降血糖、降血脂和抗癌等药理方面[2-7]。文献[8]将提取纯化后的黄精多糖组分PSP1-A进行羧甲基化修饰,得到产物CPSP1-A,相同剂量下CPSP1-A的抗氧化能力和还原力强于PSP1-A,表明将多糖羧甲基化后抗氧化性能得到提高。文献[9]通过响应面法优化羧甲基化龙眼肉多糖制备工艺,制备出龙眼肉多糖的羧甲基化产物CM-LYP,结果表明羧甲基的引入增强了龙眼肉多糖的抗氧化活性,并且CM-LYP具有更好的免疫调节作用。但是目前关于羧甲基化枸杞多糖抗氧化性能的研究未见报道。
本文以广西产枸杞为原料,使用微波辅助酶解法提取枸杞多糖,并制备羧甲基化枸杞多糖,对枸杞多糖的结构特性进行了表征,研究并对比了枸杞多糖和羧甲基化枸杞多糖的抗氧化性能,以期为枸杞多糖和羧甲基化枸杞多糖在保健食品中的应用与开发提供科学依据。
1 试验材料和方法
1.1 材料、试剂和仪器
材料:广西枸杞。
主要试剂:乙酸乙酯(C4H8O2)、1,1-二苯基-2-三硝基苯肼(C18H12N5O6, DPPH)、吡啶(C5H5N)、三氯甲烷(CHCl3)、纤维素酶(β-1,4-葡聚糖-4-葡聚糖水解酶)、正丁醇(CH3(CH2)3OH)、果胶酶(果胶裂解酶)、异丙醇(C3H8O)、三氟乙酸(CF3COOH)、氯乙酸(CH2ClCOOH)、30%(体积分数)过氧化氢(H2O2)均为国产分析纯。
主要仪器:SCIENTZ-10N型冷冻干燥机(宁波新芝生物科技股份有限公司);DGX-9143型电热恒温鼓风干燥箱(上海福玛实验设备有限公司);永磁直流电动搅拌器(上海梅颖浦仪器仪表制造有限公司);高效液相色谱仪(high performance liquid chromatograph, HPLC, Waters科技有限公司);Nicolet5700 型傅里叶变换红外光谱仪(Fourier transform infrared spectrometer, FTIR, 美国布鲁克海文仪器公司);尺寸排阻色谱-多角度激光光散射-示差折光联用仪(size exclusion chromatography-multi-angle laser light scattering refractive index, SEC-MALLS-RI, 美国怀亚特技术公司);MCR-3型微波化学反应器(上海予正仪器设备有限公司);UV-17001C 型紫外分光光度计(上海凤凰光学科仪有限公司)。
1.2 试验方法
对枸杞进行人工筛检,剔除发生霉变、虫蛀的变质枸杞。参照文献[10]的方法,使用减压干燥法对枸杞进行预处理,然后粉碎。
1.2.2 枸杞多糖的提取
采用微波辅助酶解法[11]提取枸杞多糖,先将200 g枸杞粉末溶于3 000 mL蒸馏水中,使用微波预处理20 min,微波功率为300 W,常温下放置3 h,过滤,将滤渣溶于1 500 mL蒸馏水中,重复提取1次。将两次滤液合并后加入一定质量的纤维素酶(质量分数0.1%)和果胶酶(质量分数0.25%)浸提12 h,离心(4 000 r/min,15 min),收集上清液,Sevage法除蛋白,使用体积分数为30%的H2O2进行脱色处理。透析5 d后浓缩。冷冻干燥,得到枸杞多糖。
1.2.3 羧甲基化修饰
准确称取200 mg枸杞多糖,溶于25 mL异丙醇中,搅拌下加入体积分数为20%的氢氧化钠10 mL,碱化处理3 h。将2.63 g氯乙酸溶于25 mL异丙醇中,再加入体积分数为20%的氢氧化钠溶液10 mL,充分搅拌,缓慢滴加一半混合液于反应液中,搅拌3 h。升温到60 ℃反应30 min。滴加另一半混合液于反应液中,在60 ℃下反应1 h。用浓度为0.5 mol/L的乙酸溶液调节反应液至pH=7。透析5 d,浓缩后冷冻干燥,得到羧甲基化的枸杞多糖。
1.2.4 羧甲基化取代度的测定
准确称取10 mg 羧甲基化枸杞多糖,在烘箱中干燥1~2 h后,加入3 mL体积分数为70%的乙醇,充分混合均匀后在常温下放置5 min。依次加入10 mL 蒸馏水、50 mL 0.5 mol/L 的NaOH溶液,搅拌至枸杞多糖溶解。用浓度为0.1 mol/L的盐酸滴定,以酚酞为指示剂,使用文献[12-13]的方法,计算红色褪去时每毫克羧甲基化枸杞多糖所需盐酸的用量和羧甲基取代度。
你们急个啥?老冬瓜说。老鳜鱼可没说要杀谁。他那把刀子,有一尺多长,锋利着呢,刀片可也不薄,握在手里正好,沉甸甸的,满有手感。
1.2.5 HPLC分析单糖组成
准确称取20 mg枸杞多糖,加入到15 mL 2 mol/L的三氟乙酸中,在121 ℃条件下油浴搅拌4 h。旋蒸至溶液蒸干,加入2 mL甲醇,再次蒸干,重复3次。最后加入2 mL纯水,摇晃均匀后用0.45 μm滤膜过滤,装入液相小瓶待用。分别配制1 mol/L的葡萄糖、葡萄糖醛酸、半乳糖、甘露糖、木糖、阿拉伯糖和鼠李糖标准样品。然后参照文献[14]的方法进行试验。
1.2.6 FTIR分析
称取2~3 mg枸杞多糖,加入溴化钾粉末,磨细之后压片,使用傅里叶变换红外光谱仪,在波长区间4 000~400 cm-1扫描红外吸收值。
1.2.7 SEC-MALLS-RI分析
准确称取20 mg枸杞多糖,溶解于5 mL质量分数为0.9%的氯化钠溶液中,80 ℃搅拌至完全溶解,过 0.45 μm聚醚砜滤膜。流动相为质量分数0.2%的NaNO3和质量分数0.02%的NaN3,测试温度为25 ℃,进样量为100 μL,流速为0.4 mL/min。用Astra软件进行数据采集和分析。
1.2.8 DPPH法检测抗氧化性能
配制不同浓度的枸杞多糖母液于具塞试管中,分别加入2 mL质量浓度为0.1 g/L 的DPPH乙醇溶液,充分混匀,避光静置30 min。将不同质量浓度的枸杞多糖母液分别加入无水乙醇溶液中作空白,以DPPH溶液作对照,在517 nm波长处测定各待测液的吸光度,采用文献[15]的方法计算对DPPH·自由基的清除率。
1.2.9 羟基(·OH)自由基清除作用测试
利用芬顿(Fenton)反应原理,测定枸杞多糖及其羧甲基化衍生物对H2O2与FeSO4反应产生的羟基(·OH)自由基的清除能力。分别配制不同质量浓度的枸杞多糖溶液和羧甲基化枸杞多糖溶液,取样品溶液1 mL,然后依次加入9 mmol/L的FeSO4溶液1 mL、9 mmol/L的水杨酸-乙醇溶液1 mL,8.8 mmol/L 的H2O2溶液1 mL,充分混匀后37 ℃水浴30 min。以等体积的蒸馏水代替样品溶液作空白组,以等体积的蒸馏水代替水杨酸作样本组,在510 nm波长处测定各待测液的吸光度,采用文献[9]的方法计算对·OH自由基的清除率。
2 试验结果分析
2.1 羧甲基化取代度
通过微波辅助酶解法,从200 g枸杞粉末中提取得到枸杞多糖8.64 g,提取率为4.32%。对枸杞多糖进行羧甲基化修饰后,计算得到羧甲基化枸杞多糖取代度为0.43。
2.2 HPLC结果分析
图1为HPLC分析枸杞多糖的单糖色谱图。由图1可知:从8 min开始,单糖成分开始分离,在25 min左右完成分离。通过与标准样品色谱图对比,可以确定样品中所含的单糖有甘露糖、葡萄糖醛酸、阿拉伯糖、鼠李糖和葡萄糖等,再结合峰面积,使用面积归一法,计算出各个单糖组分的摩尔分数。甘露糖、葡萄糖醛酸、阿拉伯糖、鼠李糖和葡萄糖的摩尔分数分别为40.05%、18.98%、18.34%、15.73%和6.90%。
2.3 FTIR结果分析
图2为枸杞多糖和羧甲基化枸杞多糖的红外光谱图。由图2可知:羧甲基化修饰后枸杞多糖的大部分特征吸收峰都发生了不同程度的移动,这是由枸杞多糖分子中羧甲基基团的引入所引起的。在3 432 cm-1和3 425 cm-1处为—OH的伸缩振动峰,2 970 cm-1和2 963 cm-1处为亚甲基C—H伸缩振动峰,这两组特征峰为典型多糖类物质的特征峰,羧甲基化修饰后仍然保留了此特征吸收峰。1 641 cm-1处为—C—O—的非对称伸缩振动,该吸收峰为强峰; 1 423 cm-1处为—C—O—对称伸缩振动,该吸收峰为中强峰;1 368 cm-1处为O—H面内变角振动,该吸收峰为中强峰。而1 641 cm-1、1 423 cm-1和1 368 cm-1处的 3个吸收峰为—COOH—基团的特征吸收峰,证明羧甲基取代成功。

图1 HPLC分析枸杞多糖的单糖色谱图

图2 枸杞多糖和羧甲基化枸杞多糖的红外光谱图
2.4 SEC-MALLS-RI结果分析
相对分子质量和相对分子质量分布是多糖最为关键的结构特性,很大程度上影响多糖的物理特性和化学特性,而多糖构象对于其物理特性和化学特性具有非常重要的作用。本文使用SEC-MALLS-RI系统测定了枸杞多糖的数均相对分子质量Mn、质均相对分子质量Mw、多分散系数Mw/Mn和均方根旋转半径Rg,结果如表1所示。枸杞多糖的数均相对分子质量为3.561×104,质均相对分子质量为5.059×104,均方根旋转半径为73.0 nm,多分散系数为1.421。多分散系数Mw/Mn的值用于说明聚合物(如多糖)的相对分子质量分布宽度,Mw/Mn的值越大,相对分子质量分布越宽。由表1中枸杞多糖的多分散系数可知,提取出来的枸杞多糖相对分子质量分布较窄,分子结构比较均一[16]。

表1 枸杞多糖的SEC-MALLS-RI 测定结果参数表
2.5 DPPH·自由基清除率
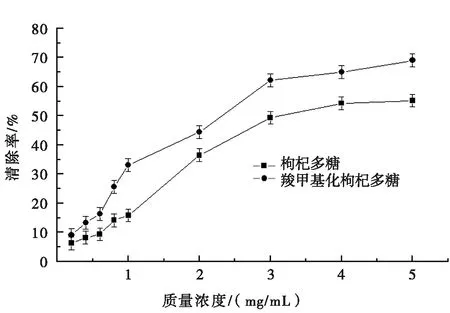
图3 枸杞多糖和羧甲基化枸杞多糖对DPPH·自由基的清除作用
图3为枸杞多糖和羧甲基化枸杞多糖对DPPH·自由基的清除作用。由图3可知:枸杞多糖和羧甲基化枸杞多糖对DPPH·自由基均具有一定的清除作用,且与其质量浓度成正相关关系。当质量浓度小于1 mg/mL时,枸杞多糖和羧甲基化枸杞多糖对DPPH·自由基的清除率相差不大;当质量浓度大于1 mg/mL时,羧甲基化枸杞多糖对DPPH·自由基的清除率明显高于枸杞多糖;当质量浓度达到5 mg/mL时,羧甲基化枸杞多糖对DPPH·自由基的清除率达到68.02%。
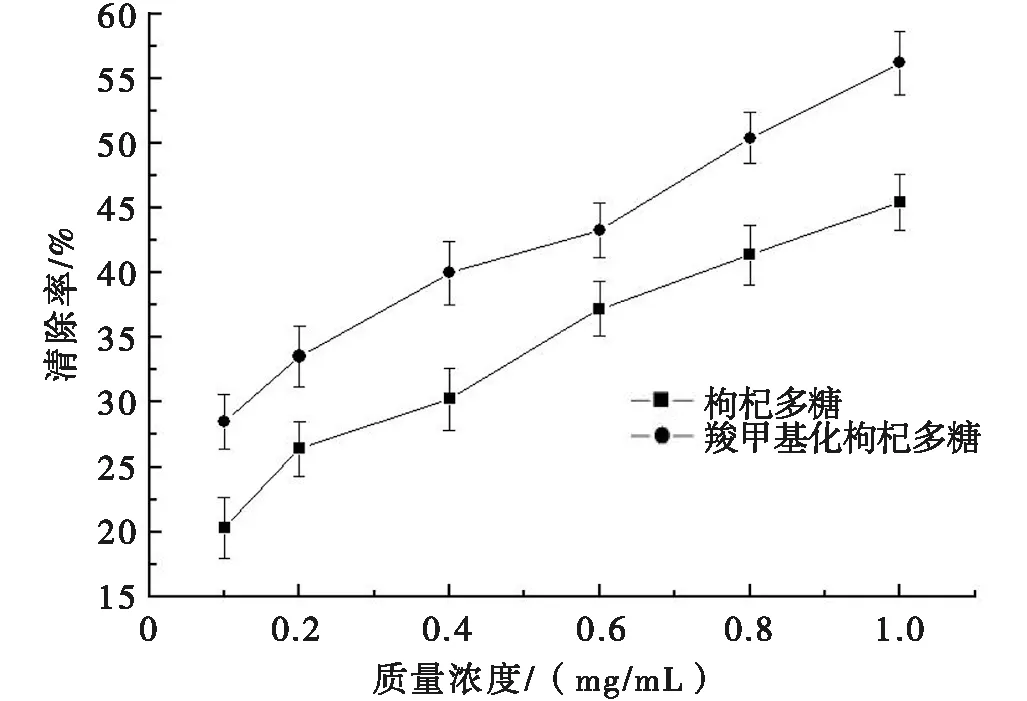
图4 枸杞多糖和羧甲基化枸杞多糖对·OH自由基的清除作用
2.6 ·OH自由基清除率
图4为枸杞多糖和羧甲基化枸杞多糖对·OH自由基的清除作用。由图4可知:枸杞多糖和羧甲基化枸杞多糖均对Fenton反应产生的·OH自由基有清除作用,且与质量浓度成正相关。当质量浓度达到1.0 mg/mL时,枸杞多糖和羧甲基化枸杞多糖对·OH自由基的清除率分别为45.42%和56.22%。在相同质量浓度下,羧甲基化枸杞多糖对·OH自由基表现出更强的清除率,说明羧甲基的引入可以提高枸杞多糖对·OH自由基的清除能力。
3 结论
(1)使用微波辅助酶解法提取枸杞多糖,提取率为4.32%,并对枸杞多糖进行羧甲基化修饰,羧甲基化取代度为0.43。FTIR结果显示羧甲基化成功。
(2)枸杞多糖主要由甘露糖、葡萄糖醛酸、阿拉伯糖、鼠李糖和葡萄糖这5种单糖组成。
(3)在相同质量浓度下,羧甲基化枸杞多糖抗氧化性能高于枸杞多糖。
