CS/PVA 交联膜对重金属离子的吸附1
2021-01-20刘建文赵道辉王银莹张海鹏杨忠华
曾 嵘, 刘建文, 赵道辉, 王银莹, 张海鹏, 杨忠华
(1. 湖北大学 化学化工学院, 湖北 武汉 430062; 2. 武汉科技大学 化学与化工学院, 湖北 武汉 430081)
1 前 言
含有重金属离子的工业废水给地球的生态环境造成极大危害,对水生生物的生存和人类健康构成了巨大威胁。重金属离子可以通过食物链进入人体进而造成器官的损伤或病变,严重的甚至危及生命[1]。如何快速、高效地除去工业废水中的重金属离子,是近年来环保领域研究的热点之一。
水体中重金属离子污染的治理主要有:化学沉淀法、氧化还原法、离子交换法和膜分离法等。它们有各自的优势,但对于低浓度的废水处理效率较低[2]。吸附法具有操作简便、处理速度快、效果好的优点,而且对于低浓度废水的治理,具有特别大的优势[3]。活性炭是一种常见的重金属吸附剂,吸附容量大,但是成本较高,且固液分离困难[4]。开发环保的新型重金属离子吸附剂,成为这一领域的研究热点[2]。
壳聚糖(chitosan,CS)是一种来源广泛、价廉、可生物降解的天然高分子吸附剂,它通过分子链上的活性基团(氨基、羟基)螯合吸附金属离子[5]。与一般的吸附剂相比,这种螯合吸附剂与金属离子之间的键合力更强,选择性更高,受溶剂和干扰离子的影响较小。文献中报道 CS 对多种金属离子,如:Cu2+、Ni2+、Zn2+、Pb2+、Cd2+等,都有很好的吸附能力[6-17]。但是,CS 上的氨基在强酸性条件下会质子化,吸附效果变差,因此需要对它进行化学改性。聚乙烯醇(polyvinyl alcohol,PVA)分子链上含有大量的羟基,与CS 共混后两者之间可形成氢键,由于PVA 的韧性好,可改善CS 质脆的缺点,提高材料的机械性能[18]。
本文采用溶液共混法来制备CS/PVA 共混膜,共混膜中的CS 具有优良的金属离子吸附性能,它的含量直接影响膜对重金属离子的吸附性能。由于高 CS 含量的共混膜,交联后易脆,膜片不完整,作者制备了3 种CS 含量适宜的共混膜,控制共混膜中CS 与PVA 的质量比分别为0.225:1、0.45:1、0.9:1。随后,采用环氧氯丙烷对3 种CS/PVA 共混膜进行交联,获得了在宽广的酸碱环境中具有优良机械性能及重金属离子吸附能力的CS/PVA 交联膜[18]。在此基础上,进一步研究了该CS/PVA 交联膜对二价金属Cu2+与Ni2+的吸附特性及其吸附动力学行为,为它在重金属废水治理领域的应用提供理论基础。
2 实验部分
2.1 实验材料
壳聚糖(CS),脱乙酰度>90%,购自上海如吉生物科技发展有限公司;聚乙烯醇(PVA),醇解度99%,天津市凯通化学试剂有限公司生产;二甲基亚砜、环氧氯丙烷(epichlorohydrin,ECH)、CuSO4·5H2O、NiSO4·6H2O、乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium,EDTA-2Na)、CH3COONa 及其他常规试剂,均购自国药集团化学试剂有限公司。所用的试剂均为分析纯。
2.2 实验方法
2.2.1 CS/PVA 交联膜的制备
CS/PVA 交联膜的制备参见作者前期发表的文章[18]。首先制备3 种比例的CS/PVA 共混膜:将CS 的乙酸溶液和PVA 水溶液按m(CS):m(PVA)质量比w=0.225:1、0.45:1 和0.9:1 的比例混合,经水浴、磁力搅拌和超声波消泡后,得到3 种比例的CS/PVA 共混铸膜液。采用流延法将95 mL 的铸膜液倒入尺寸为23 cm×17 cm 的带框玻璃板,干燥后,用NaOH 浸泡揭膜,水洗、晾干,制得厚度为0.01~0.05 mm 的CS/PVA 共混膜,将其剪成Φ50 mm 的圆片存于干燥器中。利用环氧氯丙烷对制得的CS/PVA 共混膜进行交联:将CS/PVA 共混膜圆片放入含环氧氯丙烷和二甲基亚砜的碱性交联液中,体系pH 值为10 左右[19],40 ℃下反应14 h 后,将膜取出,用纯水冲洗、干燥,得到CS/PVA 交联膜。
2.2.2 吸附性能的测定
将一片CS/PVA 交联膜(Φ50 mm 的圆片,面积为19.63 cm2)放入10 mL 含CuSO4或NiSO4溶液的锥形瓶内。将其置于恒温培养振荡器中,恒温吸附6 h,测定吸附前后溶液中Cu2+或Ni2+的浓度,求出交联膜对重金属离子的吸附量q(mg⋅g-1)。为寻求较优的吸附条件,分别考察了溶液的pH 值、金属离子的初始浓度、温度等因素对重金属离子吸附的影响。
2.2.3 再生性能的测定
将一片 w= 0.9:1 的 CS/PVA 交联膜放入 10 mL,浓度为 0.10 mol⋅L-1,pH=5 的 CuSO4或 pH=7 的 NiSO4溶液中,25 ℃下振荡吸附6 h 后取出,用纯水反复冲洗,以去除膜表面残留的金属离子。然后将干燥后的膜放入10 mL,浓度为0.10 mol⋅L-1的乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)水溶液中,25 ℃下振荡解吸4 h 后将膜取出,再用纯水冲洗干净,干燥后备用。分别测定吸附前后溶液以及EDTA解吸液中Cu2+或Ni2+的浓度。多次重复上述吸附、解吸循环,以考察该金属离子吸附剂的再生能力。
2.3 分析方法
2.3.1 Cu2+和Ni2+浓度的测定
CuSO4和NiSO4溶液中Cu2+与Ni2+的浓度利用比色法进行测定[20]。以EDTA 为金属离子螯合剂,用紫外-可见分光光度计,分别在740 和590 nm 处测定CuSO4和NiSO4标准溶液的吸光度,得到相应的标准曲线。利用所得的标准曲线测定待测样品中的相应离子浓度。
2.3.2 金属离子吸附量的计算
单位质量的CS/PVA 交联膜上金属离子的吸附量为

式中:c0为溶液中金属离子的初始浓度,mol⋅L-1;ct为 t 时刻溶液中金属离子的浓度,mol⋅L-1;V 为溶液的体积,L;q 为t 时刻的吸附量,mg⋅g-1;m 为共混膜的质量,g;M 为金属离子的摩尔质量,g⋅mol-1。
2.3.3 金属离子解吸分率的计算
按2.2.3 中的方法,测定w=0.9:1 的CS/PVA 交联膜对金属离子的吸附量q。吸附结束后,用EDTA水溶液对膜进行解吸,测定其中的金属离子浓度,求出从CS/PVA 交联膜上解吸的金属离子量qd,mg⋅g-1。
CS/PVA 交联膜上金属离子的解吸分率为

3 结果与讨论
本文的研究结果主要包括CS/PVA 交联膜对重金属Cu2+与Ni2+的吸附特性、再生性能及其吸附动力学3 部分。
3.1 CS/PVA 交联膜对Cu2+与Ni2+的吸附特性
分别考察了溶液的pH 值、金属离子的初始浓度、温度等因素对Cu2+与Ni2+吸附的影响,并采用经典的吸附模型对Cu2+与Ni2的吸附数据进行拟合。结果如下:
3.1.1 溶液的pH 值对吸附的影响
在相同的金属离子初始浓度下,CS/PVA 交联膜对Cu2+的吸附量明显高于Ni2+。分别配制了浓度为0.10 mol⋅L-1,pH=1~5 的 CuSO4和 pH=3~7 的 NiSO4溶液(在该浓度下 pH=6 的 CuSO4和 pH=8 的 NiSO4溶液均会沉淀,溶液的pH 值采用醋酸或醋酸钠调节),用于考察溶液的pH 值对这2 种重金属离子吸附的影响。实验结果如图1 所示。
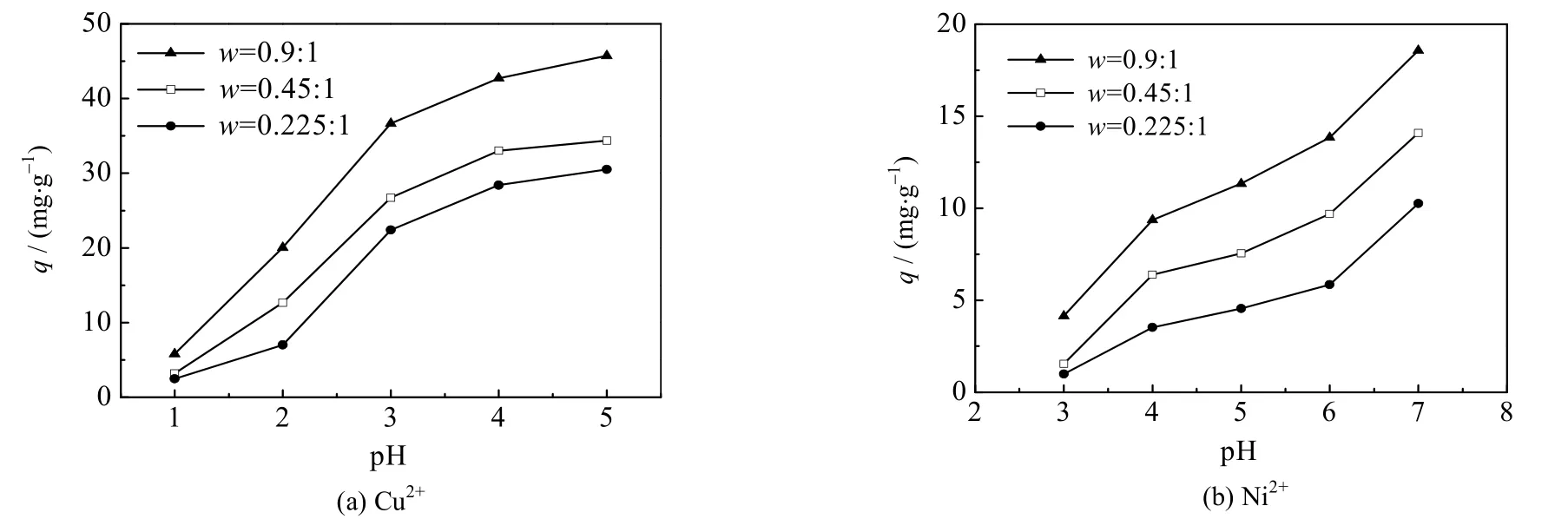
图1 溶液的pH 值对Cu2+与Ni2+吸附的影响Fig.1 Effects of solution pH on the adsorption of Cu2+ and Ni2+
由图 1 可知:在初始浓度为 0.10 mol⋅L-1,pH 值为 1~5,w=0.9:1,0.45:1,0.225:1 的 3 种 CS/PVA交联膜对Cu2+的吸附量q 均随pH 值的增大而增大,当pH=5 时,达最大值,分别为45.74,34.35 和30.53 mg·g-1。在相同的初始浓度,pH 值为 3~7,w=0.9:1,0.45:1,0.225:1 的 3 种 CS/PVA 交联膜对 Ni2+的吸附量q 均随pH 值的增大而增大,当pH=7 时,q 达最大值,分别为18.57,14.10 和10.26 mg⋅g-1。这3种CS/PVA 交联膜对Cu2+与Ni2+吸附量由小到大的顺序与交联膜的CS 与PVA 质量比的顺序相一致,说明交联膜对Cu2+与Ni2+的吸附量与膜上的壳聚糖含量有关。
在较低pH 值下,单位质量的交联膜对Cu2+、Ni2+的吸附能力较低。这是由于当H+浓度较高时,它不仅会与金属离子竞争膜上的吸附位点[21-22],还会与膜上的─NH2结合形成─NH3+,使得交联膜上可络合金属离子的官能团数目变少;另一方面,NH3+和重金属离子之间存在着静电排斥力,会对金属离子的吸附产生阻碍作用[23-24]。当溶液的 pH 值升高时,H+的浓度降低,膜上的活性官能团数量增加,金属离子在与 H+的竞争吸附中逐渐占据优势,交联膜的吸附量随之增大。因此,在实验的浓度条件下,CS/PVA交联膜吸附重金属Cu2+与Ni2+最适宜的pH 值分别为5 和7。
3.1.2 金属离子的初始浓度对吸附的影响
在25 ℃,最适宜的pH 值、不同的初始浓度下,测定了CS/PVA 交联膜对金属Cu2+与Ni2+的吸附量,绘制出相应的吸附等温线,即:金属离子的平衡吸附量qe和溶液中金属离子平衡浓度ce之间的关系曲线,如图2 所示。结果表明:CS/PVA 交联膜对Cu2+与Ni2+的吸附量均随金属离子平衡浓度的增大而增大,在低浓度下吸附量的增加较为迅速,当浓度增大到一定程度后,吸附量的增加比较缓和,趋于饱和。本文分别采用Langmuir、 Freundlich 和Langmuir-Freundlich 3 种吸附模型[25]对图2 中的吸附数据进行拟合。
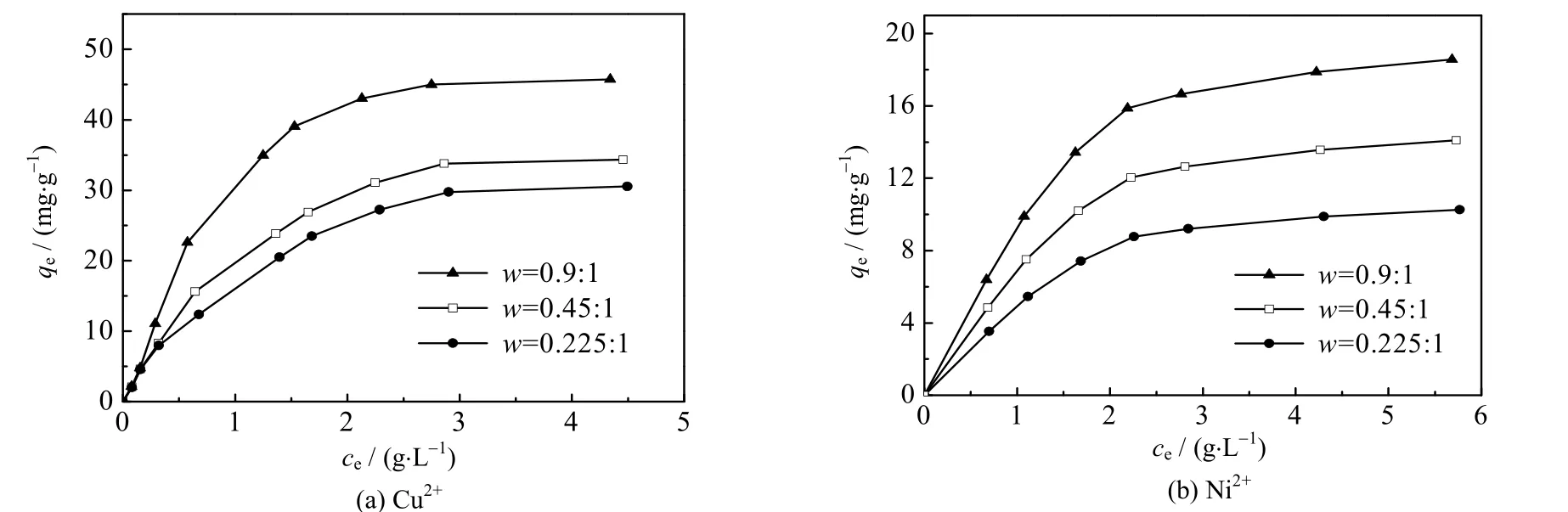
图2 Cu2+与Ni2+的吸附等温线Fig.2 Adsorption isotherms of Cu2+ and Ni2+
Langmuir 吸附模型方程为

式中:qe为金属离子的平衡吸附量,mg⋅g-1;ce为溶液中金属离子的平衡浓度,g⋅L-1;qm为金属离子的最大吸附容量或饱和吸附容量,mg⋅g-1;Kd为解离常数,g⋅L-1。其中 KL=Kd-1,KL为 Langmuir 常数,L⋅g-1。
示踪剂技术应用于油田勘探开发领域已经有70多年的历史,示踪剂技术在评价油藏特征、制定开发方案和选择增产措施方面均发挥了重要的作用。
Freundlich 吸附模型方程为

式中:KF和n 为Freundlich 方程中的物理常数,KF和n 分别为吸附容量和吸附强度。
Langmuir-Freundlich 吸附模型方程为

采用上述3 种吸附模型分别对图2 的吸附数据进行拟合,结果如表1 所示。由表1 中相关系数R2的值可知,对于Cu2+与Ni2+在3 种CS/PVA 交联膜上的吸附行为,采用Langmuir 和Freundlich 2 种吸附模型对实验数据的拟合结果均不太理想。而Langmuir-Freundlich 吸附模型则能够更好地拟合实验数据,对铜离子的相关系数R2都在0.993 8 以上,对镍离子的相关系数R2都达到了0.999 9。
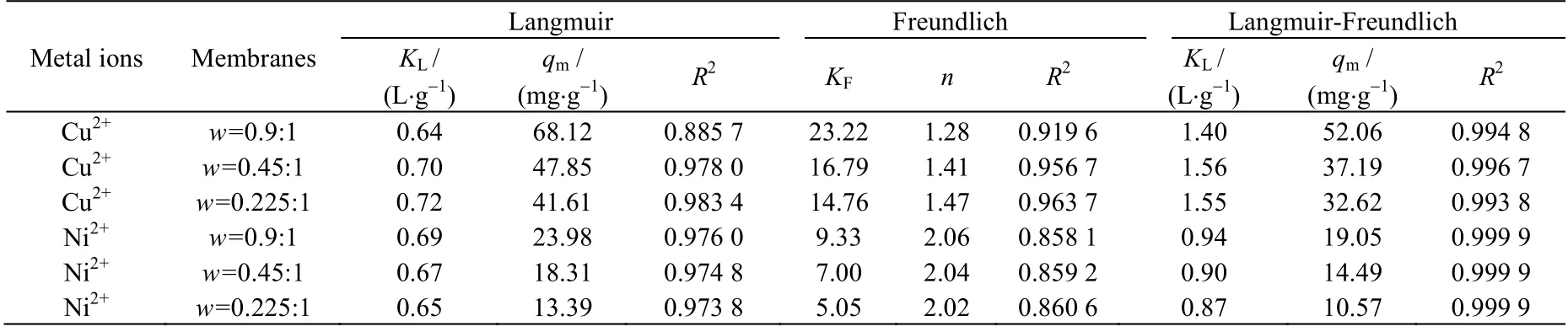
表1 Cu2+与Ni2+的等温吸附拟合参数Table 1 Fitting parameters for isothermal adsorption of Cu2+ and Ni2+
这是由于Langmuir 模型假设所有的吸附位点都是均匀的,为单分子层吸附,吸附的组分间没有相互作用力。而 Freundlich 模型用于非均匀、可逆吸附过程的模拟,不仅局限于单分子层吸附[1,14]。Langmuir-Freundlich 组合模型将两者有机结合,较好地弥补了它们在描述膜吸附剂上重金属离子实际吸附行为的不足,因而拟合的结果优异。Chu[16]在研究壳聚糖吸附Cu2+时,也采用Langmuir-Freundlich 模型进行拟合,其模型计算值与实验结果均能够很好地吻合。这些结果表明Langmuir-Freundlich 模型适于模拟这类壳聚糖基吸附材料对重金属离子的吸附行为。
由Langmuir-Freundlich 吸附模型得出w=0.9:1,0.45:1,0.225:1 的CS/PVA 交联膜对Cu2+的qm分别为 52.06、37.19 和 32.62 mg⋅g-1,对 Ni2+的 qm分别为 19.05、14.49 和 10.57 mg⋅g-1。就饱和吸附容量而言,3 种CS/PVA 交联膜中w=0.9:1 的交联膜最佳,这是由于该种比例的交联膜具有较高的壳聚糖含量。此外,同种CS/PVA 交联膜对Cu2+的饱和吸附容量远大于对Ni2+的饱和吸附容量,这一方面可能与这些离子的半径大小有关,另一方面可能与它们之间的络合作用有关。壳聚糖与过渡金属离子(Cu2+、Cd2+、Pb2+、Ni2+等)之间通过—NH2的络合反应,可形成环状的络合结构,从而能够吸附金属离子[3]。

式中:M 为金属离子,X 为阴离子。
根据Lewis 的酸碱理论,CS 上的N 原子(为Lewis 弱碱)易与金属离子(Cu2+、Pb2+、Cd2+,为Lewis弱酸)形成较稳定的络合物[26],因而对这些金属离子具有较好的络合能力。由于Cu2+引起Jahn-Teller 效应,使得络合的构型产生畸变,有利于铜离子的吸附,从而使它的吸附容量较高。而 Ni2+与 CS 上的—NH2的络合作用较弱,因而其吸附容量较小[27]。
如表 2 所示为常用吸附剂对 Cu2+与 Ni2+的饱和吸附容量 qm。与表 2 中的吸附剂相比,w=0.9:1 的CS/PVA 交联膜对Cu2+的qm高于沸石、活性炭、壳聚糖粉末以及乙二醇二缩水甘油醚(EGDE)交联的壳聚糖;低于戊二醛(GLU)和环氧氯丙烷(ECH)交联的壳聚糖;3 种比例的CS/PVA 交联膜对Ni2+的qm均高于表2 中的吸附剂。通过上述比较,发现CS/PVA 交联膜对Cu2+的qm高于大部分的常用吸附剂,但与ECH交联的壳聚糖相比还存在一定的差距。这是由于在共混膜中加入了 PVA 的缘故,使得单位质量的膜对Cu2+的吸附容量下降。

表2 常用吸附剂对金属铜、镍离子的饱和吸附容量Table 2 Saturated adsorption capacities of copper and nickel ions by typical adsorbents
3.1.3 温度对吸附的影响
将一片 CS/PVA 交联膜放入 10 mL,浓度为 0.10 mol⋅L-1,pH=5 的 CuSO4或 pH=7 的 NiSO4溶液中。分别在15、25、35、45、55 ℃下置于恒温培养振荡器中,振荡吸附6 h 后,测定CS/PVA 交联膜对金属Cu2+与Ni2+的吸附量。绘制出这2 种重金属离子的吸附量q 和温度θ 之间的关系曲线,如图3 所示。
由图3 可知,当温度由15 上升到25 ℃时,重金属Cu2+与Ni2+的吸附量随温度的升高而增大;当温度升至25 ℃以后,吸附量随温度的升高略有增加,但增幅不大。对于w=0.45:1 的交联膜,在55 ℃下对Cu2+与Ni2+的吸附量与25 ℃下的吸附量相比,仅增加了3.0%左右。
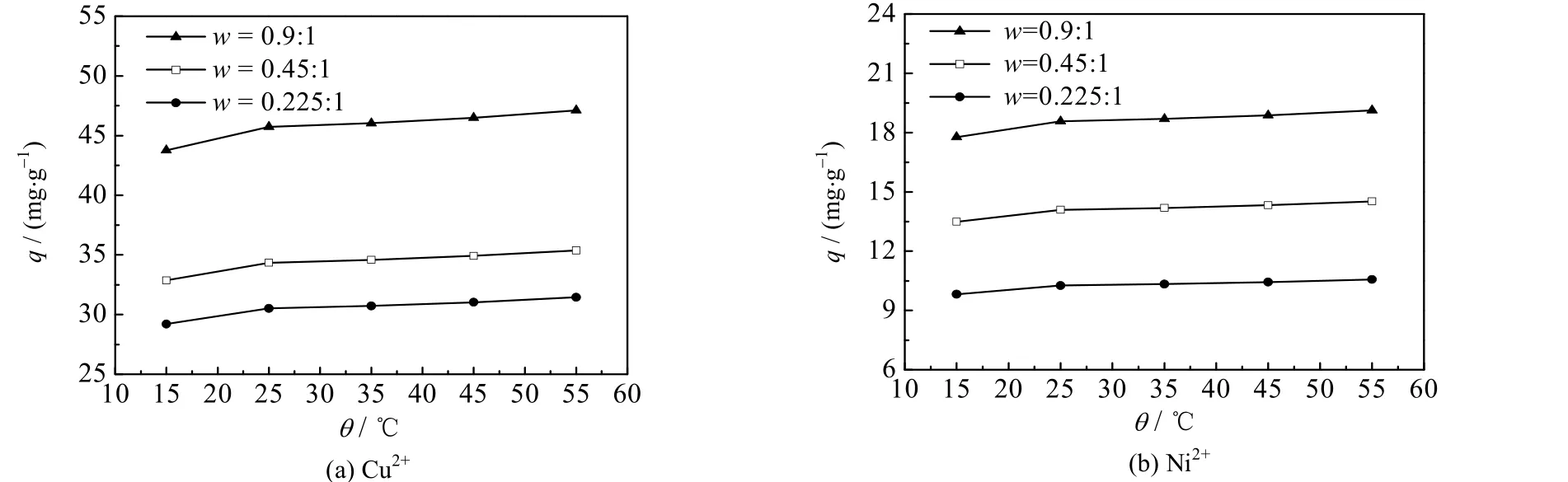
图3 温度对Cu2+与Ni2+吸附的影响Fig.3 Effects of temperature on the adsorption of Cu2+ and Ni2+
由 Clausius-Clapeyron 方程[28]:

式中:∆HM为金属离子吸附的焓变,J⋅mol-1;R 为通用气体常数,8.314 J⋅(mol⋅K)-1;T 为绝对温度,K。
根据不同温度下,CS/PVA 交联膜对金属Cu2+与Ni2+的吸附量q,分别求出CuSO4与NiSO4溶液的平衡浓度ce。以ln ce为纵坐标,1/T 为横坐标,得到ln ce与1/T 的数据点线性拟合图,如图4 所示。
由图4 中3 条拟合直线斜率的平均值,可求出3 种CS/PVA 交联膜上金属Cu2+与Ni2+吸附的平均焓变分别为107.82、32.37 J⋅mol-1。焓变为正,说明金属离子在交联膜上的吸附过程为吸热反应,该吸附过程属于化学吸附,升高温度有利于吸附。但是,当温度升高到25 ℃以后,吸附量随温度的升高增加的幅度不大,从简化操作的角度出发,可将吸附实验的温度统一为室温25 ℃。
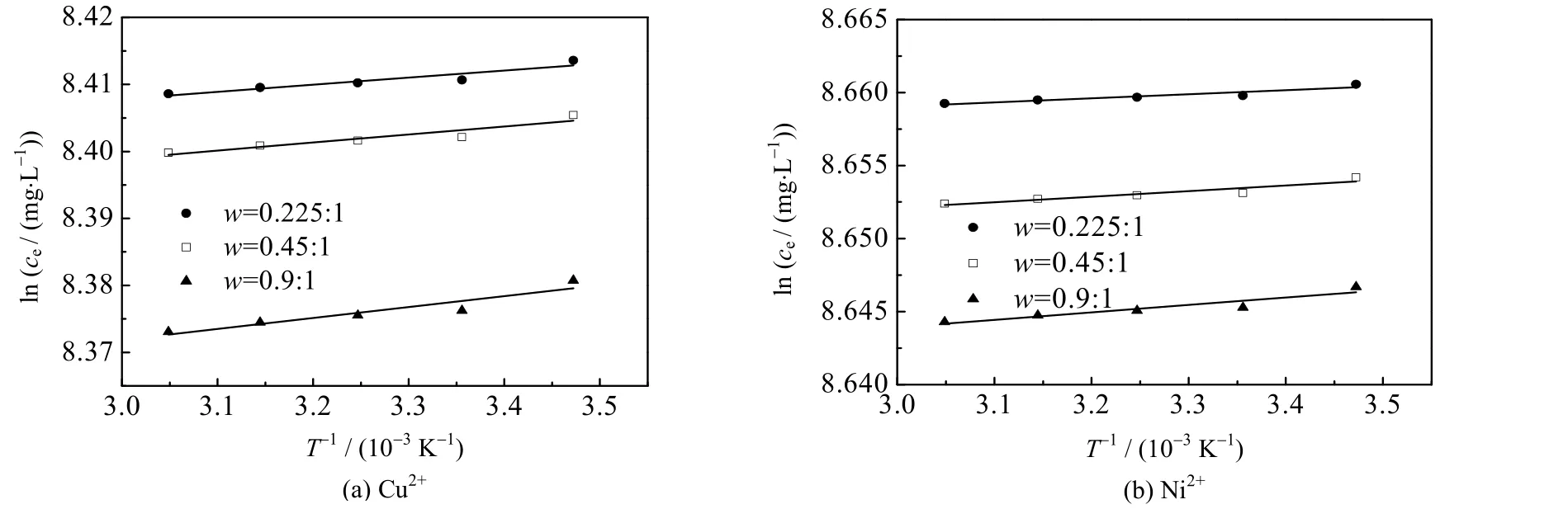
图4 Cu2+与Ni2+的lnce 与1/T 的线性拟合曲线Fig.4 Linear fitting curves between lnce and 1/T for Cu2+ and Ni2+
3.2 CS/PVA 交联膜的再生性能
w=0.9:1 的 CS/PVA 交联膜吸附金属Cu2+与Ni2+后的再生性能如表3 所示。由表3 可知,经过5 次吸附、解吸循环后,质量比为 0.9:1 的 CS/PVA 交联膜对金属 Cu2+与 Ni2+的吸附量 qe仅略有下降而解吸分率D 基本不变。由此可见,经多次重复利用后,CS/PVA 交联膜对金属 Cu2+与 Ni2+仍具有较强的吸附能力和较高的解吸分率,说明它具有优良的再生性能。
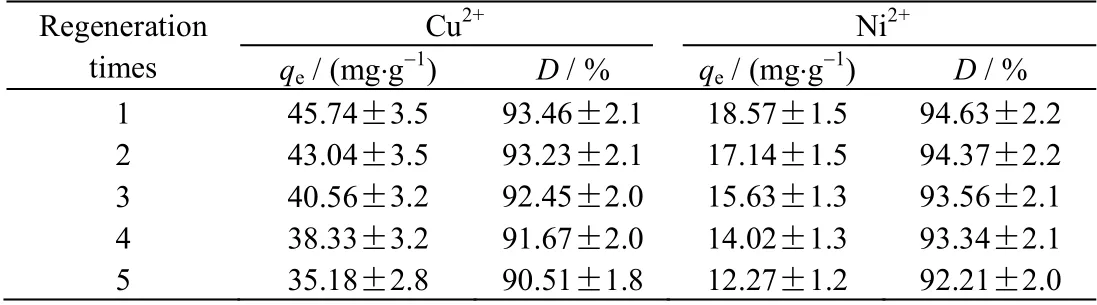
表3 CS/PVA 交联膜的再生性能Table 3 Regeneration properties of the CS/PVA cross-linked membranes
3.3 CS/PVA 交联膜对Cu2+与Ni2+的吸附动力学
在 25 ℃下,分别将 CS/PVA 交联膜放入 10 mL,浓度为 0.10 mol⋅L-1,pH=5 的 CuSO4或 pH=7 的 NiSO4溶液中。每隔一定的时间,测定CS/PVA 交联膜对Cu2+与Ni2+的吸附量,绘制CS/PVA 交联膜对这2 种重金属离子的吸附动力学曲线,结果如图5 所示。
由图5 可知,在吸附开始阶段,CS/PVA 交联膜对金属Cu2+与Ni2+的吸附量迅速增加;随着吸附时间的延长,吸附量增加的速度逐渐变缓;吸附时间超过300 min 后,吸附达到平衡。这是由于:吸附刚开始时,溶液中金属离子的浓度较高,而金属离子在膜吸附剂表面的浓度低,吸附的推动力大,因此吸附量增加的速度较快;随着吸附的不断进行,溶液中金属离子的浓度逐渐降低,过程的推动力减小,吸附量增加的速度逐渐变慢,直至吸附平衡。
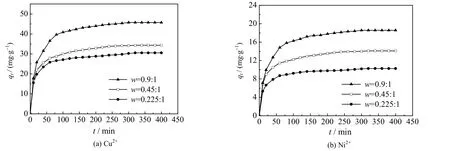
图5 Cu2+与Ni2+的吸附动力学曲线Fig.5 Adsorption kinetic curves of Cu2+ and Ni2+
本文采用2 种吸附动力学模型,准一级和准二级动力学模型[26],对图5 的实验数据进行拟合。
准一级动力学模型方程为

准二级动力学模型方程为

式中:k1为准一级动力学模型吸附速率常数,min-1;k2为准二级动力学模型吸附速率常数,g⋅mg-1⋅min-1。
用这2 种动力学模型拟合得到的模型参数,如表4 所示。由表4 中相关系数R2的数值可以发现,准二级动力学模型比准一级动力学模型对实验数据拟合的结果更好,且由准二级动力学模型拟合得到的平衡吸附量qe,cal与实验值qe,exp很接近,而由准一级动力学模型拟合得到的平衡吸附量与实验值相差较大。由实验测定质量比为0.9:1、0.45:1 和0.225:1 的CS/PVA 交联膜对Cu2+的平衡吸附量qe,exp分别为45.74、34.35 和 30.53 mg⋅g-1;对 Ni2+的平衡吸附量 qe,exp分别为 18.57、14.10 和 10.26 mg⋅g-1。这一拟合结果与文献[1,13-14]得到的结论一致,可进一步说明,准二级动力学模型与这2 种重金属离子在CS/PVA 交联膜上的吸附动力学行为更符合。
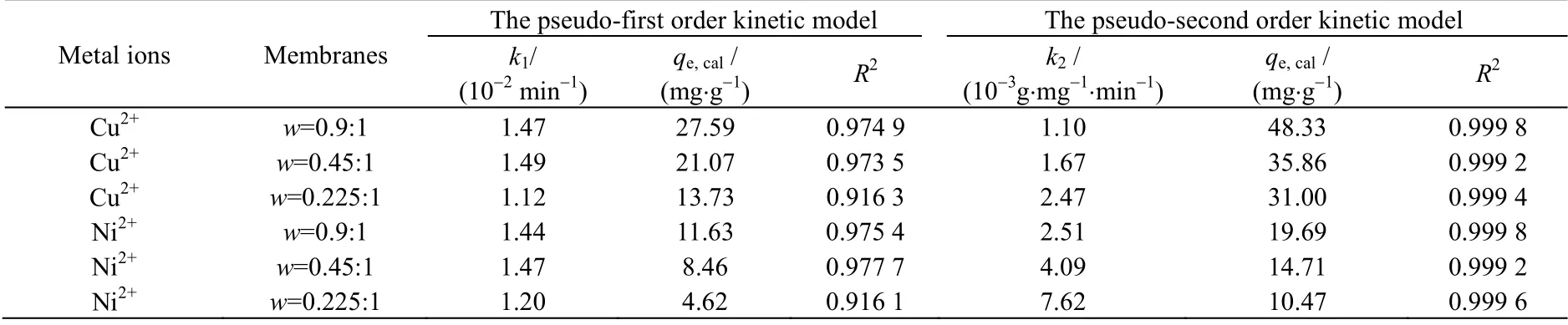
表4 Cu2+与Ni2+的吸附动力学模型拟合参数Table 4 Adsorption kinetic model fitting parameters of Cu2+ and Ni2+
4 结 论
本文通过相转化法制备了CS/PVA 共混膜,采用环氧氯丙烷对膜进行交联,详细考察了交联膜对二价重金属Cu2+与Ni2+的吸附性能。
研究表明:CS/PVA 交联膜上重金属Cu2+与Ni2+的吸附量随pH 值的增大而增大,适宜的pH 值分别为5 和7;Cu2+与Ni2+的等温吸附数据均符合Langmuir-Freundlich 吸附模型;3 种比例的CS/PVA 交联膜中,质量比为 0.9:1 的交联膜对 Cu2+与 Ni2+的吸附量最大,其饱和吸附容量高于大多数常用的吸附剂;Cu2+与Ni2+在交联膜上的吸附为吸热反应,属于化学吸附,吸附量随温度的升高而增大,当温度超过25 ℃后,吸附量增加的幅度较小;经多次重复利用后,交联膜对金属Cu2+与Ni2+仍具有较强的吸附能力;吸附的平衡时间为300 min,吸附动力学符合准二级动力学模型。
本文所制备的CS/PVA 交联膜,既具有CS 的生物活性和优良的吸附性能,又具有PVA 良好的机械性能,它对重金属Cu2+与Ni2+具有优良的吸附能力,易于再生,是一种性能优良的膜吸附分离材料,可作为重金属离子的吸附剂,在水污染的治理领域发挥积极作用。
