BDD 电极氧化降解SDBS 的研究
2021-01-20苏志伟陈鲁川雷乐成张兴旺
苏志伟, 陈鲁川, 雷乐成, 张兴旺
(浙江大学 化学工程与生物工程学院 工业生态与环境生态研究所, 浙江 杭州 310027)
1 前 言
表面活性剂是一种在溶液中可大幅度改变溶液表面能的物质,有着发泡、清洁、乳化、表面改性等作用,被广泛用于生活、生产[1]。表面活性剂根据其分子结构可分为阴离子、阳离子、非离子型,目前在生活、生产应用中,主要是以阴离子型表面活性剂为主。阴离子表面活性剂作为一种发泡清洁的去污物质,随生活用水排入污水系统中,是生活污水中常见的污染物质。阴离子表面活性剂主要是直链烷基苯磺酸盐(linear-alkylbenzene sulfonic,LAS),在生活污水中的含量较高,自身难降解,进入水体后易与其他污染物结合在一起,会阻碍环境对其他污染物的降解过程[2]。另外,LAS 在水体中容易发泡,会抑制水体的氧气流动,使水体的可生化性减弱,进而造成水体富营养化,恶化水体环境。含有一定浓度的LAS 生活污水,对水生动植物也具有一定的毒性,也会对人体造成损伤[3-4]。
目前常用的去除水中表面活性剂的方法有物理吸附法、化学法和生物法[5]。物理吸附法通过吸附剂如活性炭、树脂、膨润土、粉煤灰等具有多孔性的材料对表面活性剂进行吸附,从而除去水溶液中的表面活性剂[6]。化学法通过加入化学试剂进行化学氧化、光电催化氧化、电化学催化氧化等将表面活性剂降解为水与二氧化碳[7]。生物降解法通过微生物对有机物的降解处理表面活性剂,但表面活性剂大多具有生物毒性,生物降解法中对微生物的生存环境需要较高的要求[8]。
电催化氧化是通过阳极直接氧化有机物或在水中产生羟基自由基(·OH)、臭氧等强氧化物质[9-10],将有机物直接降解为H2O、CO2等小分子。本文通过自制硼掺杂金刚石薄膜(BDD),以BDD 作为阳极,钛片作为阴极进行电催化氧化。研究在电流密度、SDBS 初始质量浓度、电解质浓度、pH 等不同条件下,BDD 电极对十二烷基苯磺酸钠(sodium dodecyl benzene sulfonate,SDBS)的电催化降解能力。
2 实验部分
2.1 BDD电极的制备
通过热丝化学气相沉积技术(hot filament chemical vapor deposition,HFCVD)将钽片作为衬底制备硼掺杂金刚石薄膜。其中,所用沉积衬底为钽圆片,直径5 cm。先对衬底钽片进行划痕、研磨预处理,再放入管式炉中依次使用甲烷、乙硼烷和氢气,气体速度分别为44、12 和356 mL⋅min-1,电机加热功率为7 800 W,在800 ℃下沉积4 h,最后得到BDD 电极。
2.2 实验与测试方法
装置简图如图1 所示。使用4 个双头螺丝固定住3 块树脂,中间的一块树脂为空心圆柱,每2 块树脂之间用2 个硅胶片夹住一块电极,保证正负电极相对。使两电极与中间的空心树脂共同构成小反应器,用条状铁片与电极片相接,铁片另一端与直流电源的正负极相接。将250 mL 的烧杯作为储液罐用来储存SDBS 溶液。以反应器、蠕动泵和储液罐的顺序通过20 mm 软管连接,使反应器中的溶液输送到储液罐中。再以储液罐、蠕动泵和反应器的顺序通过20 mm 软管连接,使储液罐中的溶液输送到反应器中,从而实现整个反应体系中SDBS 溶液的均匀循环。并且电极为圆形,除去与硅胶片的接触部分,直接与电解液接触的面积约为11 cm2,两电极之间的距离为22 mm。
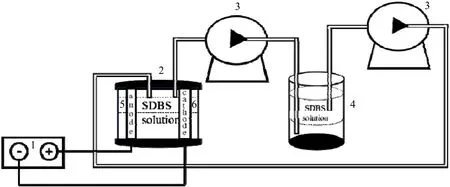
图1 实验装置简图Fig.1 Schematic diagram of experimental apparatus
取200 mL SDBS 溶液放入储液罐中,以BDD 电极作为阳极,钛片作为阴极,Na2SO4作为电解质,通电一定的时间,移取1 mL 反应液通过水系滤头过滤后注入色谱瓶,以高效液相色谱法测定SDBS 浓度。
使用高效液相色谱(Agilent 1200HPLC 液相色谱仪)进行测定,色谱柱为 SB-C18 柱,柱温维持在(40±0.5) ℃,流动相配比为甲醇:水=95:5,以0.4 mL⋅min-1流动相流速,进样量10 μL。由于十二烷基苯磺酸钠有较好的荧光吸收,故采用荧光检测器检测,荧光激发波长为232 nm,发射波长为290 nm[11]。
3 实验结果与讨论
3.1 BDD 电极 SEM 分析
通过场发射扫描电子显微镜(field emission scanning electron microscope,FESEM)(FEI SIRION-100,荷兰)分析BDD 微观形貌和通过FESEM 中的高性能X 射线能谱仪对BDD 电极进行微区点线面元素的定性、半定量及定量分析。图2 为BDD 的扫描电子显微镜图像和X 射线能谱仪分析。从扫描电子显微镜图像中可知,制备得到的BDD电极表面具有形状完备的晶粒,且晶粒有良好的均匀性,大小为0.5~1.0 μm。从X 射线能谱仪分析可观察到明显的硼元素峰形,表明了硼元素的存在,硼元素成功掺杂进入金刚石薄膜表面,证明制备得到BDD 电极。
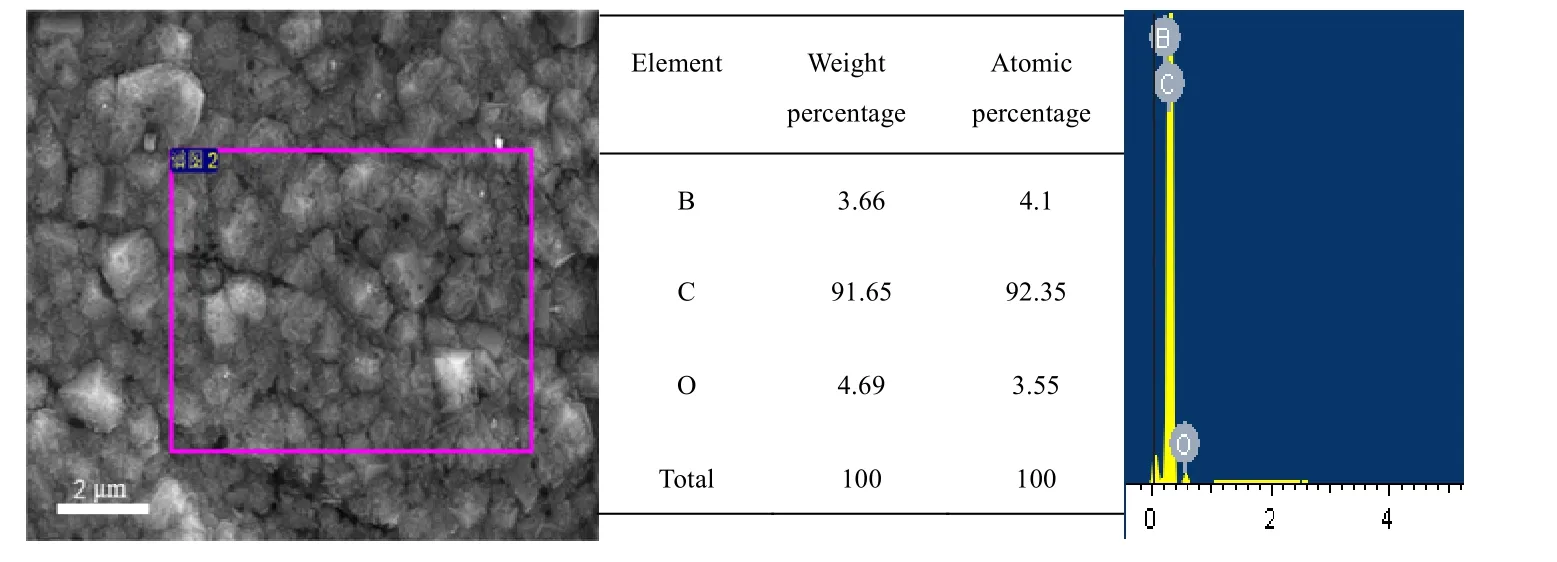
图2 BDD 的扫描电子显微镜图像和X 射线能谱仪分析Fig.2 SEM image and energy spectrometer element analysis of BDD
3.2 BDD 电极拉曼光谱析
金刚石薄膜的激光拉曼光谱出现1 333 和1 500~1 600 cm-1两个特征峰。1 333 cm-1处为金刚石一阶立方特征拉曼峰,峰偏移程度的大小表示金刚石薄膜内应力大小。1 500~1 600 cm-1处的SP2态拉曼宽峰的峰强度与存在 SP2态的碳多少有关[12]。采用激光共聚焦拉曼光谱仪(ZTJD6-13471HK,中国)了制备得到的金刚石薄膜在掺入硼元素后的拉曼峰变化,如图3 所示。从拉曼图谱中可知,在1 345 和1 568 cm-1的2 个位置附近出现了峰位,与金刚石薄膜具有的2 个特征峰出峰位置相似,说明制备得到了金刚石薄膜。1 345 cm-1的出峰位置对于1 333 cm-1的位置有较小的偏移,且1 345 cm-1处峰形与1 568 cm-1处的宽峰相似,表明1 345 cm-1处的峰形产生了一定的宽化,说明金刚石薄膜表面的颗粒尺寸较小[13]。在1 568 cm-1附近出现的宽峰与整个碳拉曼区的背景基线对比明显,说明金刚石薄膜上存在较多的非金刚石碳[14]。
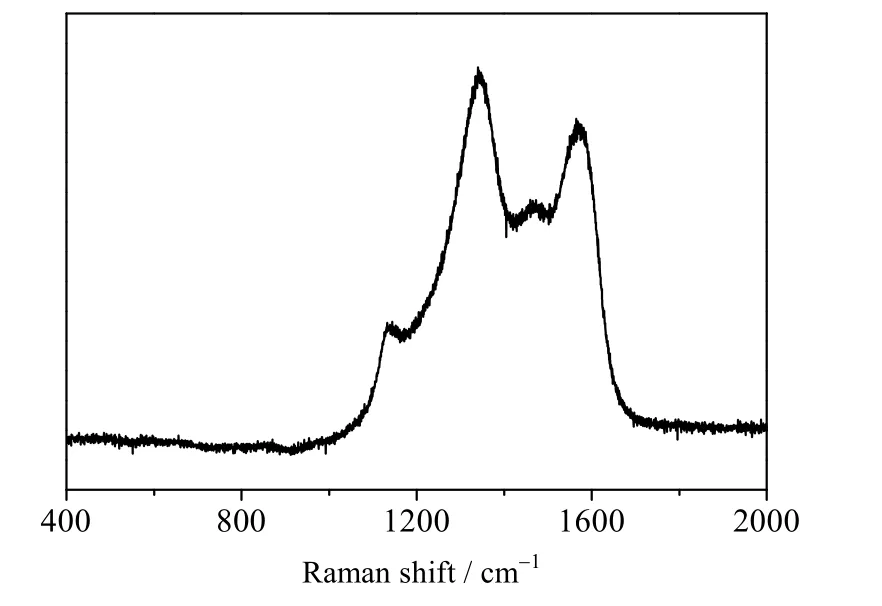
图3 BDD 电极的拉曼图谱Fig.3 Raman spectrum of BDD electrode
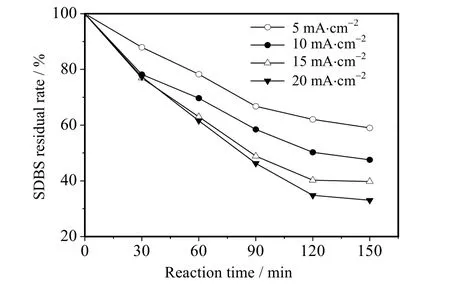
图4 不同电流密度下SDBS 剩余率Fig.4 SDBS residual rate at different current densities
3.3 电流密度的影响
在 SDBS 初始质量浓度 50 mg⋅L-1、溶液 pH=7、Na2SO4浓度 0.1 mol⋅L-1、电解时间 150 min 的条件下,考察了电流密度对SDBS 降解的影响。结果如图4 所示,随着电流密度从5 升高到20 mA⋅cm-2,经过BDD 电极降解后,SDBS 剩余率从59%降到33%,其中在电流密度为10、15 mA⋅cm-2时SDBS 剩余率分别为47%、39%,在20 mA⋅cm-2电流密度下的SDBS 剩余率33%。这是因为提高电流密度有利于在水中电解产生更多⋅OH[15],从而加快SDBS 在溶液中降解,SDBS 剩余率随之提高而减少。但随着电流密度的不断提高,溶液电阻在整个电化学降解体系中产生能耗较大,从而使SDBS 剩余率的减少幅度减小。考虑到电解过程中所需能耗和后续实验研究,电流密度为10 mA⋅cm-2时可满足降解要求,所以后续实验采用电流密度10 mA⋅cm-2作为实验条件。
3.4 SDBS 初始质量浓度的影响
SDBS 是一种具有发泡功能的表面活性剂,过高浓度的SDBS 溶液在蠕动泵传送过程中会出现大量气泡,造成溶液中SDBS 浓度不均匀,从而对反应造成较大干扰,所以选取初始质量浓度为25~100 mg⋅L-1的 SDBS 溶液。在电流密度 10 mA⋅cm-2、溶液 pH=7、Na2SO4浓度 0.1 mol⋅L-1、电解时间 150 min 的条件下,考察了SDBS 溶液在不同初始浓度时对SDBS 降解的影响,结果如图5 所示。当SDBS 的初始质量浓度从25 增加到75 mg⋅L-1,剩余率逐渐减小,当SDBS 初始质量浓度为100 mg⋅L-1时,SDBS 剩余率比初始质量浓度为75 mg⋅L-1的高,表明SDBS 溶液在初始质量浓度为75 mg⋅L-1时SDBS 的剩余率最少,BDD 电极的降解效率最高。在一定的电流密度和时间下,BDD 电极产生的⋅OH 的量相对一定,使⋅OH 不易与溶液中的较小质量浓度的SDBS 接触反应,导致SDBS 的剩余率高,随着初始质量浓度增加溶液中的SDBS 逐渐容易和⋅OH 接触反应,使SDBS 剩余率降低,从而提高了降解效率。当SDBS 浓度过高时,反应体系中产生的⋅OH 的量一定,只能降解一定量的SDBS,从而使溶液中部分 SDBS 不能得到降解,导致SDBS 剩余率减少缓慢。
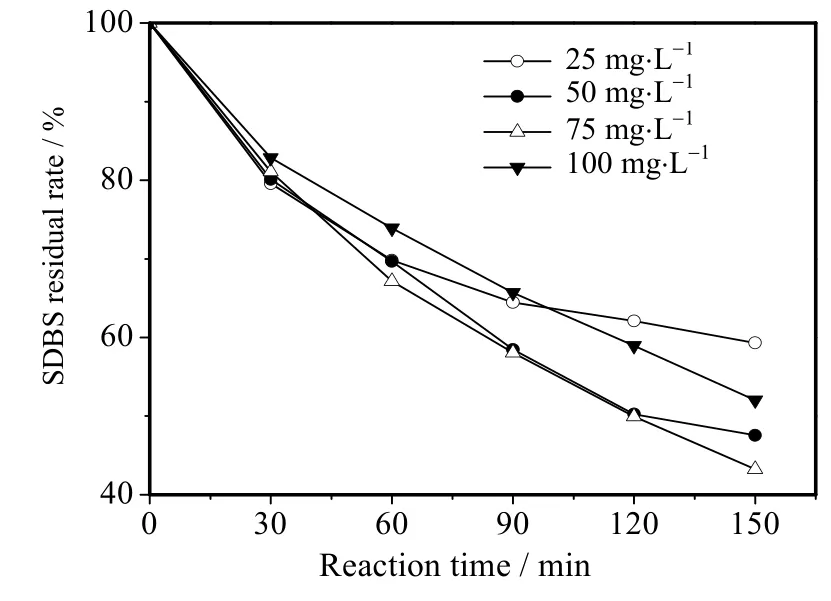
图5 不同SDBS 初始浓度下SDBS 剩余率Fig.5 SDBS residual rate under different initial concentrations of SDBS
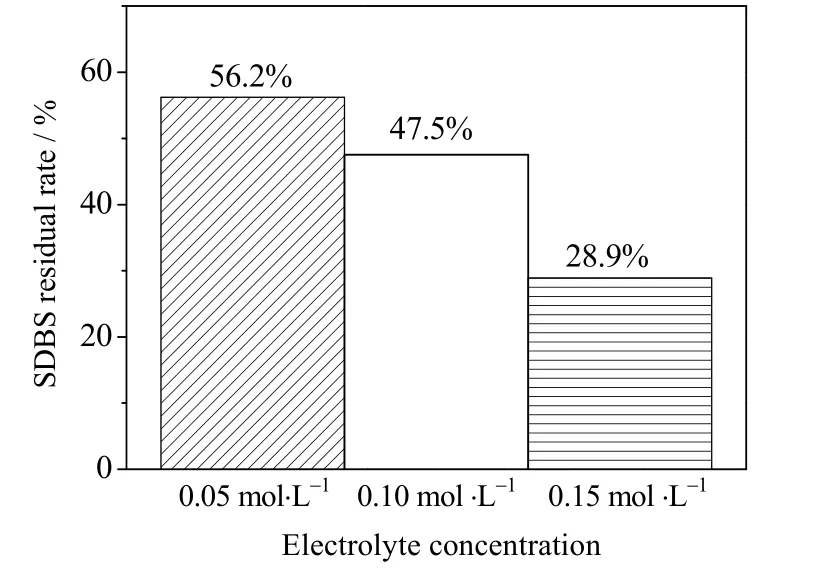
图6 不同电解质浓度下SDBS 剩余率Fig.6 SDBS residual rate at different electrolyte concentrations
3.5 电解质浓度的影响
在SDBS 初始质量浓度50 mg⋅L-1、溶液pH=7、电流密度10 mA⋅cm-2、电解时间150 min 的条件下,考察了不同的电解质浓度对SDBS 降解的影响。如图6 所示,电解质浓度为0.05、0.10、0.15 mol⋅L-1时 SDBS 剩余率分别为 56.2%、47.5%、28.9%,表明电解质浓度提高对溶液中 SDBS 的降解有很大的影响。随着电解质浓度的增加,SDBS 剩余率随之减少。因为在通电过程中硫酸根自由基与水中的羟基生成·OH[16]。随着电解质浓度的提高,生成的·OH 量也随之提高,使SDBS 的剩余率减少,从而提高了 SDBS 的降解效率。另外,电解质浓度影响溶液电导率,溶液电导率随电解质浓度的升高而增大,在一定的电流密度下溶液电阻产生的能耗减小,促进了·OH 的生成,从而也使 SDBS 的剩余率减少。
3.6 pH 的影响
硫酸盐在酸性溶液的电解过程中,会发生以下反应(见方程(1)、(2)),产生具有强氧化性的过硫酸根。

在 SDBS 初始质量浓度 50 mg⋅L-1、Na2SO4浓度 0.1 mg⋅L-1、电流密度10 mA⋅cm-2、电解时间150 min 的条件下,考察了pH 对BDD 电极降解SDBS 的影响,如图7 所示。从图中可知,在pH 为 2.7、7、12 时,SDBS 剩余率分别为 38%、50%、48.5%,说明在酸性条件下,SDBS 的降解效率最高。这是因为Na2SO4作为电解质时,酸性条件下硫酸根在电解过程中会被氧化生成S2O82-,S2O82-作为强氧化中间产物,具有较强的氧化性,会与电解过程中产生的·OH 协同氧化SDBS,使SDBS 剩余率减少,从而提高BDD 电极对SDBS 的降解效率[11,18]。
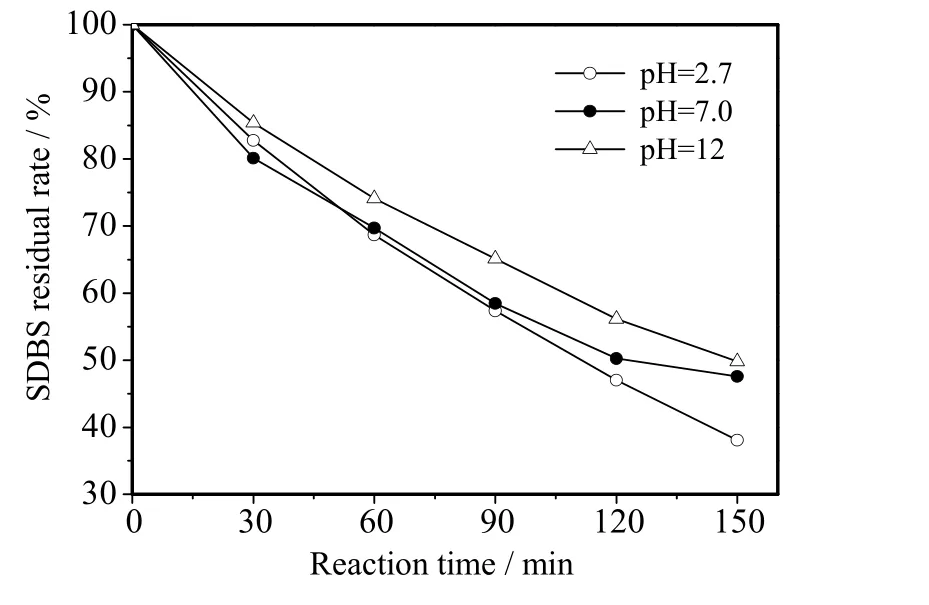
图7 不同pH 溶液下SDBS 剩余率Fig.7 SDBS residual rate at different solution pH values
4 结 论
本实验通过HFCVD 制备BDD 电极,根据SEM、拉曼光谱法分析观察到BDD 具有较小的金刚石纳米结构和对应的金刚石特征峰,从而证明BDD 电极制备成功。对于BDD 电极降解SDBS 溶液时, SDBS剩余率随电流密度和电解质浓度的提高而减小,而且SDBS 剩余率先随SDBS 初始质量浓度提高而减小后再增加,酸性条件有利于SDBS 的降解。
