水杨酸处理诱导采后甜瓜抗坏血酸-还原型谷胱甘肽循环代谢清除过氧化氢的作用及机制
2021-01-20范存斐任亚琳
杨 乾,范存斐,王 毅,任亚琳,毕 阳
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
化学诱抗剂可有效诱导厚皮甜瓜对多种采后真菌的抗性[1],其诱导抗性的机制与激活苯丙烷、活性氧和能量等代谢密切相关[2]。氧爆是诱抗剂处理果实后的典型反应[3],氧爆初期产生的少量活性氧可作为信号分子激活相关防御反应,而后期产生的大量活性氧则具有直接抑菌、促进氧化交联等作用[4]。然而,过量活性氧会破坏细胞膜结构、降低果实的抗病性[5]。植物体内已进化出有效的清除系统来平衡活性氧,以防止过量活性氧的伤害[6]。清除系统包括酶促和非酶促两类,前者包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶、过氧化氢酶(catalase,CAT)以及抗坏血酸(ascorbic acid,AsA)-还原型谷胱甘肽(reduced glutathione,GSH)循环相关酶,后者包括VE、VC、谷胱甘肽、多酚和类黄酮等[7]。有研究表明,采后水杨酸处理柑桔[8-9]、苯并噻二唑(benzothiadiazole,BTH)处理苹果[10]能诱导果实氧爆,同时提高其SOD活性,但会降低CAT活性。由此表明,诱抗剂所诱导的清除H2O2不依赖于过氧化氢酶。AsA-GSH循环是植物体内存在的一个重要抗氧化保护系统,主要通过GSH和AsA的氧化还原来清除H2O2,在维持H2O2产生和清除平衡中发挥了重要作用[11]。有研究表明,水杨酸及其类似物BTH处理能促进柑橘和苹果AsA-GSH循环[9-10]。由此表明,AsA-GSH循环在诱抗剂激发的H2O2清除中具有重要作用。本课题组前期研究发现,采后BTH处理会通过激发厚皮甜瓜的氧爆来提高果实的抗病性[12],但AsA-GSH循环如何系统参与诱抗剂激发的厚皮甜瓜H2O2清除鲜见报道。本研究以‘玉金香’厚皮甜瓜为试材,研究采后水杨酸(salicylic acid,SA)浸泡处理对果实活性氧的积累和丙二醛(malondialdehyde,MDA)含量的影响,测定处理后果实的SOD和CAT活力,以及AsA-GSH循环代谢酶活性和产物含量。以期为揭示AsA-GSH循环在清除诱抗剂激发的果实过量H2O2方面提供理论依据。
1 材料与方法
1.1 材料与试剂
供试‘玉金香’甜瓜于2 0 1 0 年7 月采自甘肃省民勤县收成乡露地大田。选取大小一致、成熟度大约九成、单果质量约0.5~0.7 kg、可溶性固形物质量分数约12%~13%、无损伤、无病虫害的果实,单果套发泡网袋,入包装箱(20 个/箱),第2天运抵甘肃农业大学采后生物学与技术实验室,于常温((22±2)℃、相对湿度55%~60%)下贮藏待用。
SA(分析纯) 天津市光复精细化工研究所。
1.2 仪器与设备
3K30台式高速冷冻离心机 德国Sigma公司;UV-2450紫外-可见光分光光度计 日本岛津公司;DDS-307A电导率仪 上海精密科学仪器有限公司;DW-HL218超低温冰箱 中科美菱低温科技有限公司。
1.3 方法
1.3.1 甜瓜处理
甜瓜处理参照范存斐等[13]的方法。SA用少量体积分数75%乙醇溶液溶解后加蒸馏水配制成浓度为4 mmol/L的溶液(内含体积分数0.05% Tween-80,用1 g/100 mL NaOH溶液调节pH值至7.0)。取甜瓜果实表面用自来水冲洗干净后晾干,将晾干后的果实浸入4 mmol/L的SA溶液中10 min,取出晾干后,单果套发泡网袋,放入包装箱(20 个/箱),于常温((22±2)℃、相对湿度55%~60%)下贮藏待用。以清水(内含体积分数0.05% Tween-80,用1 g/100 mL NaOH溶液调节pH值至7.0)处理作对照。每处理用果实40 个,重复3 次。
参照Ren Yalin等[14]的方法取样,分别于处理后0、2、4、6、8、10 d用直径5 mm打孔器打取皮下3~10 mm处组织3 g,锡箔纸包好后液氮冷冻,在-80 ℃超低温冰箱中保存待测。
1.3.2 MDA含量的测定
参照Hodges等[15]的方法测定MDA含量。取3 g冷冻组织,加5 mL 100 g/L三氯乙酸溶液研磨,研磨后的匀浆于4 ℃、12 000×g条件下离心20 min,取上清液,加入相应试剂后,分别测定其在450、532 nm及600 nm波长处的吸光度,MDA含量单位为µmol/g。
H2O2含量的测定参照Prochazkova等[16]的方法。取3 g冷冻组织,加入3 mL经4 ℃预冷的丙酮,冰浴条件下研磨成匀浆后,于4 ℃、12 000×g条件下离心20 min。取上清液,加入相应试剂后测定其在410 nm波长处的吸光度。H2O2含量单位为mmol/g。
1.3.4 SOD和CAT活力测定
粗酶液的提取参照Lacan等[17]的方法并略作修改。取3 g冷冻组织,分别向研钵内加入3 mL 0.1 mol/L p H 7.5 磷酸盐缓冲液(含5 m m o/L 二硫苏糖醇和2 g/100 mL PVP),在冰浴条件下研磨成匀浆后于4 ℃、12 000×g离心30 min,上清液即为粗酶液。
SOD活力测定参照Oberley等[18]的方法并略作修改,测定反应液在560 nm波长处吸光度。以每克组织抑制氮蓝四唑光化还原的50%定义为一个酶活力单位(U),SOD活力单位为U/g。
CAT活力测定参照Clairbone[19]的方法并略作修改,测定反应液在240 nm波长处的吸光度。以每克组织在反应体系中每分钟催化1 nmol H2O2降解定义为一个酶活力单位(U),CAT活力单位为U/g。
1.3.5 AsA-GSH循环代谢酶活力的测定
粗酶液的提取参照Nakano等[20]的方法。取3.0 g冷冻组织于预冷的研钵中,加5 mL预冷的50 mmol/L pH 7.0磷酸盐缓冲液(含1 mmol/L抗坏血酸、1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、2 g/100 mL PVP,0.25% TritonX-100)研磨,于4 ℃、16 000×g离心20 min,上清液即为粗酶液。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力的测定参照Nakano等[20]的方法。取上清液加入相应试剂后,测定其在290 nm波长处的吸光度。以每克组织每分钟氧化1 µmol AsA定义为一个酶活力单位(U),APX活力单位为U/g。
谷胱甘肽还原酶(glutathione reductase,GR)活力的测定参照Halliwell等[21]的方法。取上清液,加入相应试剂后测定其在340 nm波长处的吸光度。以每克组织每分钟氧化1 µmol烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)定义为一个酶活力单位(U),GR活力单位为U/g。
脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)活力的测定参照Nakano等[20]的方法并略作修改,取上清液,加入相应试剂后测定其在265 nm波长处的吸光度。以每克组织每分钟还原1 µmol AsA定义为一个酶活力单位(U),DHAR活力单位为U/g。
单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)的活力测定参照Nakano等[20]的方法并修改,取上清液,加入相应试剂后测定其在340 nm波长处的吸光度。以每克组织每分钟还原1 µmol NADPH定义为一个酶活力单位(U),MDHAR活力单位为U/g。
1.3.6 AsA-GSH循环产物和底物含量的测定
AsA、脱氢抗坏血酸(dehydroascorbate,DHA)含量测定参照Turcsányi等[22]的方法并略作修改。取3 g冷冻组织,加入5 mL 100 mmol/L盐酸,冰浴条件下充分研磨,于4 ℃、7 800×g离心10 min,取上清液立即用于后续实验。AsA含量的测定:取100 μL上清液加入2 mL 100 mmol/L磷酸钾缓冲液,再加入0.5 mL蒸馏水,在265 nm波长处测其吸光度,AsA含量单位为μg/g。
总抗坏血酸含量的测定:取100 μL上清液加入2 mL 100 mmol/L磷酸钾缓冲液和0.5 mL 2 mmol/L二硫苏糖醇溶液,置于室温下反应8 min后,在265 nm波长处测定其吸光度,总抗坏血酸含量单位为μg/g。总抗坏血酸含量减去AsA含量即为DHA含量,DHA含量单位为μg/g。
GSH和氧化型谷胱甘肽(oxidized glutathione,GSSG)含量的测定参照Brehe等[23]的方法并略作修改。取3 g冷冻组织,加入5 mL预冷的体积分数6%偏磷酸(pH 2.8),冰浴条件下研磨成匀浆,于4 ℃、12 500×g条件下离心20 min,所得上清液为粗酶液。
总谷胱甘肽含量测定:500 μL上清液加入2.5 mL反应液,其中反应液包含800 μL反应液1(110 mmol/L Na2HPO4·7H2O、40 mmol/L NaH2PO4·H2O、15 mmol/L EDTA、0.3 mmol/L二硫代二硝基苯甲酸、0.04 g/100 mL牛血清白蛋白(bovine serum albumin,BSA)、8 0 0 μ L 反应液2(1 m m o l/L E D TA、5 0 m m o l/L咪唑和0.0 2 g/1 0 0 m L B S A)、8 0 0 μ L 反应液3(5 g/100 mL pH 7.5 Na2HPO4)和100 μL 9 mmol/L NADPH,以体积分数6%偏磷酸(pH 2.8)代替粗酶液作为对照,测定反应体系在412 nm波长处的吸光度,总谷胱甘肽含量单位为μg/g。
GSSG及GSH含量测定:在500 μL粗酶液中共加入2.5 mL乙烯吡啶,25 ℃下水浴1 h,在412 nm波长处测定其吸光度,GSSG含量单位为μg/g。GSH的含量由总谷胱甘肽含量减去GSSG含量得到,单位为μg/g。
1.4 数据统计与分析
上述每项指标测定至少重复3 次。用Excel 2010软件计算平均值和标准差,用SPSS 19.0软件进行Duncan's多重差异显著性分析(P<0.05)。
2 结果与分析
2.1 SA处理对甜瓜果实贮藏过程中MDA含量的影响
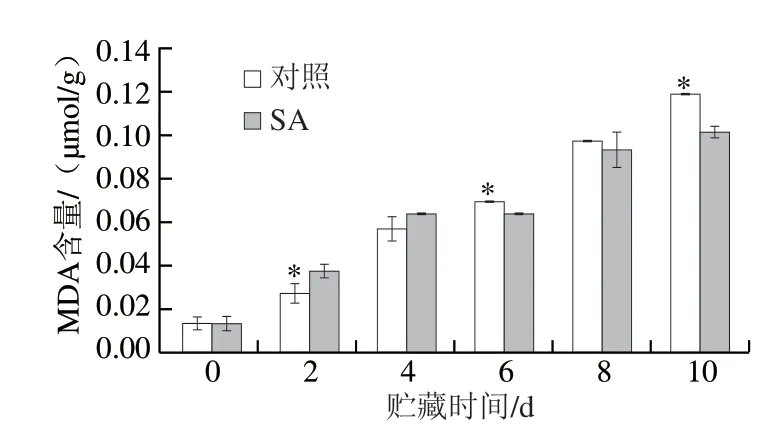
图1 SA处理对甜瓜果实贮藏过程中MDA含量的影响Fig.1 Effect of SA treatment on MDA content in melons
由图1可知,SA处理组和对照组果实的MDA含量在贮藏期间逐渐升高,SA处理组果实的MDA含量在贮藏的中后期低于对照组,第10天时低于对照组14.6%(P<0.05)。说明SA处理可以抑制甜瓜贮藏期间MDA的产生,有利于维持细胞膜的完整性。
2.2 SA处理对甜瓜果实贮藏过程O2-·产生速率和H2O2含量的影响
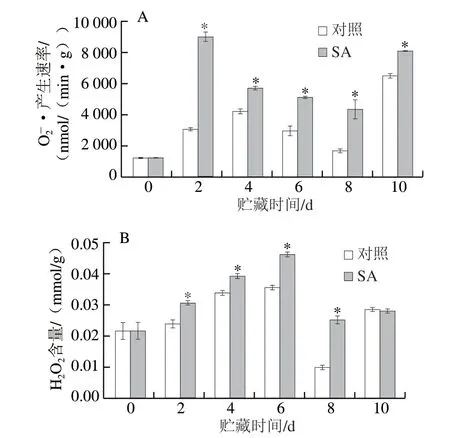
图2 SA处理对厚皮甜瓜果实贮藏过程中·产生速率(A)和H2O2含量(B)的影响Fig.2 Effect of SA treatment on superoxide anion radial production rate (A) andH2O2 content (B) in melons
2.3 SA处理对甜瓜果实贮藏过程SOD及CAT活力的影响
贮藏期间,SA处理组和对照组果实的SOD活力均呈先下降后上升再下降的趋势,SA处理组果实的SOD活力整体高于对照组,第6天较对照组高21.3%(P<0.05)(图3A)。SA处理组和对照组果实的CAT活力在贮藏期间总体呈下降趋势,且SA处理组果实的CAT活力明显低于对照组,第4天较对照组低22.9%(P<0.05)(图3B)。SOD和CAT活力的结果表明,SA处理提高了厚皮甜瓜果实的SOD活力,但抑制了CAT活力。

图3 SA处理对厚皮甜瓜果实贮藏过程中SOD(A)和CAT(B)活力的影响Fig.3 Effect of SA treatment on SOD (A) and CAT (B) activities in melons
2.4 SA处理对甜瓜果实贮藏过程AsA-GSH循环代谢相关物质含量和酶活力的影响
贮藏期间,SA处理组果实的APX活力整体呈先上升后下降的趋势,对照组果实的活力基本保持平稳,后期缓慢降低再升高。SA处理组果实的APX活力明显高于对照组,第2天较对照组高2.6 倍(P<0.05)(图4A)。SA处理组和对照组果实的MDHAR活力在贮藏期间呈先下降后上升的趋势,SA处理组果实的活力明显高于对照组,处理后第10天较对照组高70.8%(P<0.05)(图4B)。SA处理组和对照组果实DHAR活力在贮藏期间呈现先上升后下降的趋势,处理组果实的活力明显高于对照组,第6天时较对照组高67.8%(P<0.05)(图4C)。SA处理组果实的GR活力在贮藏期间呈现先上升后下降的趋势,对照组果实的GR活力则缓慢上升并趋于平稳,SA处理组果实GR活力明显高于对照组,处理后第4天较对照组高1.3 倍(P<0.05)(图4D)。
贮藏期间,SA处理组和对照组果实中AsA含量呈先下降后上升的趋势,但SA处理组果实的AsA含量明显高于对照组,第8天较对照组高1.4 倍(P<0.05)(图4E)。SA处理组和对照组果实DHA含量在贮藏期间先上升后下降并趋于平稳,SA处理组果实的DHA含量明显低于对照组,处理后第4天低于对照组64.2%(P<0.05)(图4F)。对照组和SA处理组果实中GSSG含量在贮藏期间呈先下降后缓慢上升的趋势,但SA处理组果实的GSSG含量明显高于对照组,第8天高出对照组71.5%(P<0.05)(图4G)。SA处理组果实的GSH含量在贮藏期间呈先上升后降低再升高的趋势,对照组果实的GSH含量呈先上升后平稳降低的趋势,但SA处理组果实的GSH含量明显低于对照组,处理后第8天低于同期对照组66.1%(P<0.05)(图4H)。AsA-GSH循环中的4 种抗氧化酶(APX、MDHAR、DHAR和GR)与AsA、DHA、GSH和GSSG相互作用可以清除H2O2。上述结果表明,SA处理激活了厚皮甜瓜果实的AsA-GSH循环,促进了H2O2的清除。
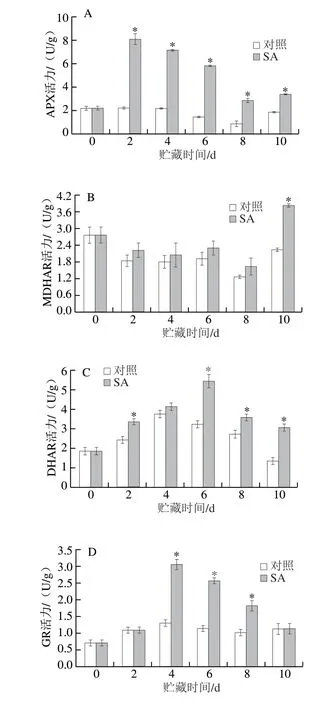
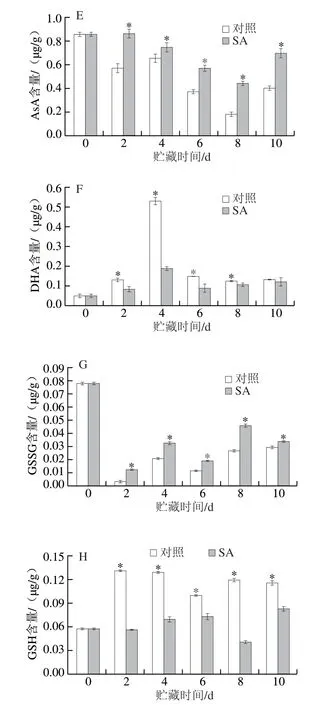
图4 SA处理对厚皮甜瓜果实贮藏过程中AsA-GSH循环代谢相关物质含量和酶活力的影响Fig.4 Effect of SA treatment on substance contents and enzyme activities related to AsA-GSH cycle in melons
3 讨 论
氧爆是SA及其类似物处理果实后的典型反应[3],即产生大量的·和H2O2。氧爆期间,NADPH电子通过NADPH氧化酶(NADPH oxidases,NOX)转移给O2,从而产生·[14],·很快在SOD作用下歧化为H2O2[7]。氧爆早期的少量H2O2可作为信号分子激活相关防御反应,而后期产生的大量H2O2则具有直接抑菌、促进氧化交联等作用[24]。有研究表明,BTH处理可提高苹果果实NOX和SOD活力,进而导致·和H2O2的积累[10],该结果与本研究水杨酸处理甜瓜后得到的结果基本一致。由于活性氧会提高脂氧合酶和磷脂酶D的活力,导致多不饱和脂肪酸的降解,从而增加脂质饱和度,改变膜的流动性,形成MDA等脂质过氧化物[25]。虽然本研究发现SA处理导致了厚皮甜瓜果实·和H2O2的显著积累,但同时抑制了MDA产生。由此表明,SA处理还激活了厚皮甜瓜果实的抗氧化系统,避免了过量活性氧对细胞膜的伤害。
AsA-GSH循环是存在于植物体内重要的H2O2清除系统,在有效清除H2O2水平中发挥着重要作用[31]。在此循环中,APX分解H2O2形成H2O和单脱氢抗坏血酸(monodehydroascorbate,MDHA),MDHA可进一步转化为DHA,DHAR可催化DHA向AsA转变,AsA也可在MDHAR作用下转变为MDHA,同时,GSH在DHAR作用下转变为GSSG,GSSG经GR和NADPH的作用还原为GSH[12](图5)。APX是AsA-GSH循环中的第一个酶,能专一性地催化AsA与H2O2反应形成MDHA[30]。GR是一种黄素蛋白氧化还原酶,能将谷胱甘肽二硫化物还原为巯基形式[7];也是重要的抗氧化酶,可保护酶蛋白的巯基,在NADPH的作用下能将GSSG转化为GSH,进一步降低氧化应激[32]。本研究发现,SA处理能通过增强APX和GR活力来清除过量的H2O2,该结果与BTH增强草莓[5]和苹果[10]果实APX和GR活力结果类似。MDHAR是一种黄素腺嘌呤二核苷酸酶,以叶绿体和细胞溶质同工酶的形式存在。MDHAR可以协同APX清除H2O2[7]。DHAR是另一种重要的酶,在GSH和NADH存在的条件下催化DHA向AsA转变[33]。本研究发现SA处理提高甜瓜DHAR和MDHAR活力的结果与SA处理萝卜观察到的结果[34]类似。AsA是植物组织普遍存在的重要抗氧化剂[31],可去除·OH、淬灭1O2、降低·产生速率,并催化H2O2分解为H2O和O2[35]。AsA可被APX氧化为MDHA,然后形成DHA,在MDAR和DHAR同时存在时,AsA可由MDHA和DHA再生[36]。此外,AsA再生也与GSH通过DHAR氧化为GSSG有关[36]。有研究表明,SA是植物应对环境胁迫的重要调节和信号转导物质,SA处理可以提高植物组织AsA含量[36]。本研究发现,SA处理明显促进了厚皮甜瓜果实的AsA积累,抑制了DHA的生成,该结果与BTH处理增强苹果果实AsA含量[10]和SA处理抑制柑橘果实DHA含量[9]的结果相似。谷胱甘肽是具有抗氧化功能的小分子短肽[9]。本研究发现,SA处理会使厚皮甜瓜果实GSSG含量升高,GSH含量降低,可能是DHAR和GR活力的升高促使GSSG向GSH转化。
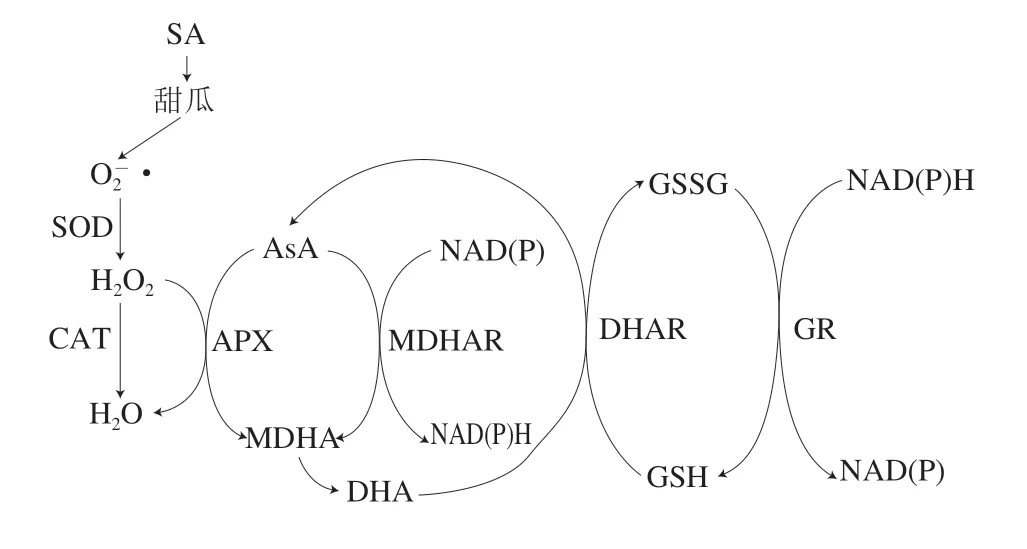
图5 SA处理诱导采后甜瓜AsA-GSH循环代谢清除H2O2模式Fig.5 Scheme of AsA-GSH cycle participates in H2O2 scavenging in muskmelons induced by salicylic acid
