苦荞清蛋白酶解物对高糖诱导的HepG2细胞胰岛素抵抗的保护作用
2021-01-20龚仕英王筑婷雷霆雯张礼林汪希兰李红梅
费 烨,王 雍,龚仕英,田 艳,王筑婷,雷霆雯,张礼林,汪希兰,李红梅,*
(1.贵州医科大学基础医学院,生物化学与分子生物学教研室,贵州 贵阳 550025;2.贵州医科大学公共卫生学院,贵州 贵阳 550025)
糖尿病是由胰岛素分泌不足或胰岛素抵抗(insulin resistance,IR)引起的糖、脂肪和蛋白质代谢失调综合征[1]。它是一种慢性内分泌系统紊乱,主要表现为长期高血糖。糖尿病主要分为1型和2型糖尿病(type 2 diabetes mellitus,T2DM),其中T2DM占所有糖尿病病例的90%~95%[2]。近几十年来,全球T2DM患病率持续以惊人的速度增长。目前,全球约有3 710万 人患有T2DM,其中中国和美国患者分别占总量的11.6%和11.3%[3]。据国际糖尿病联合会(international diabetes federation,IDF)估计,到2030年,全球T2DM患者人数将达到3.42亿,并且年轻人的患病率将会增高[4]。因此,T2DM的防治已成为一个严重的全球性公共卫生问题。
T2DM的主要病因是IR,IR在T2DM的发生发展中起着重要的作用。IR的特征是胰岛素调节和功能受损,正常水平的胰岛素无法在靶组织(如肝脏、脂肪和骨骼肌)中引起典型的胰岛素反应[5]。当体内出现IR时,胰岛素敏感组织对葡萄糖的利用率下降,导致糖尿病[6]。大量的研究表明氧化应激是导致IR的关键因素[7],因此通过抗氧化改善IR是T2DM的一种防治策略。
苦荞(tartary buckwheat)学名鞑靼荞麦,别名万年荞、野兰荞、荞叶七,隶属于蓼科荞麦属(FagoPyrum tataricum Gaertn.),与何首乌、大黄等同属蓼科,是我国药食同源文化的典型体现,具有很高的食药两用价值。苦荞营养丰富,富含蛋白质、维生素、膳食纤维、黄酮类化合物和多种微量矿物质元素等营养物质[8-9]。研究发现苦荞蛋白具有降胆固醇、抑制脂肪蓄积、抗衰老、抑制大肠癌和乳腺癌、抑制胆结石等作用[10]。本课题组前期采用碱性蛋白酶酶解苦荞清蛋白后发现酶解物具有体外抗氧化活性[11],并且分子质量小于3 kDa的酶解物抗氧化活性最强。因此本研究将苦荞清蛋白酶解物(tartary buckwheat albumin hydrolysate,TBAH)超滤后,采用分子质量小于3 kDa的TBAH作用于高糖高胰岛素诱导的人肝细胞癌细胞系HepG2 IR模型,探讨TBAH对细胞IR的影响及其可能的机制。
1 材料与方法
1.1 材料与试剂
细胞株(HepG2细胞) 上海细胞库;苦荞粉贵州威宁苦荞专卖店。
DMEM培养基、胎牛血清 美国HyClone公司;乳酸脱氢酶(lactic dehydrogenase,LDH)、一氧化氮(nitric oxide,NO)、微量丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、活性氧(reactive oxygen species,ROS)测定试剂盒 南京建成生物工程研究所;胰岛素受体底物1(insulin receptor substrate 1,IRS-1)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(phosphorylated Akt,p-Akt)(Ser407)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)、β-肌动蛋白(β-actin) 美国Proteintech公司;磷酸化IRS-1(phosphorylated IRS-1,p-IRS-1)(Ser307) 北京Cell Signaling Technology公司;辣根过氧化物酶标记羊抗兔免疫球蛋白G(immunoglobulins G,IgG)、辣根过氧化物酶标记羊抗鼠IgG 美国Jackson Immuno Research公司;罗格列酮、重组人胰岛素 北京Solarbio公司;碱性蛋白酶南宁庞博生物工程有限公司。
1.2 仪器与设备
二氧化碳细胞培养箱 日本松下公司;制胶器及电转移装置、DYY-6C型稳压稳流电泳仪 北京六一仪器厂;多功能酶标仪 美国Bio-Tek公司;Syngene凝胶成像仪 美国基因有限公司;荧光倒置显微镜 日本尼康公司;氨基酸自动分析仪 德国Sykam公司。
1.3 方法
1.3.1 苦荞清蛋白的制备
按1∶1(m/V)的比例用正己烷溶解苦荞粉48 h以脱脂,然后将已脱脂苦荞粉按1∶10(m/V)的比例加入ddH2O,搅拌2 h,4 ℃、6 000 r/min离心15 min,取上清液用1 mol/L的HCl溶液调节pH值至4.5,以利于苦荞清蛋白充分沉淀,蛋白沉淀用ddH2O冲洗2 次后用0.1 mol/L的NaOH溶液调至中性,置于真空冷冻干燥机除去水分,由此制得苦荞蛋白粉末[12]。
1.3.2 TBAH的制备
准确称取一定量的苦荞蛋白冻干粉,用ddH2O溶解配制3%的底物溶液。用1 mol/L NaOH溶液调节pH值至10.0,加入碱性蛋白酶(酶与底物质量比为5%)45 ℃孵育4 h,反应完成后将酶解液置于100 ℃沸水浴中灭酶10 min,冷却后6 000 r/min离心10 min,收集上清液即得TBAH。采用截留分子质量为3 kDa的超滤管对TBAH进行截留分离,收集分子质量不大于3 kDa的组分,冻干成粉末,-20 ℃保存备用。
1.3.3 TBAH的氨基酸组成
冻干后的TBAH加入6 mol/L HCl溶液混匀,放入液氮中冷冻,然后110 ℃水解24 h,冷却后用0.45 μm滤膜过滤,然后真空干燥,加入pH 2.2样品缓冲液溶解,0.22 μm滤膜过滤,随后通过氨基酸自动分析仪进行分析。
1.3.4 HepG2细胞培养与传代
利用含10%胎牛血清、1%青霉素、链霉素的DMEM低糖培养液,37 ℃、5% CO2饱和湿度下对细胞进行培养,0.25%胰蛋白酶进行消化、传代,取对数生长期的细胞进行实验。
1.3.5 HepG2细胞IR模型建立
将处于对数生长期的HepG2细胞用0.25%胰蛋白酶消化后,1 000 r/min离心5 min收集细胞,加新鲜培养液吹打成单细胞悬液,调整细胞密度至1×105个/mL,均匀接种于48 孔培养板中,待细胞贴壁后,更换为无胎牛血清的DMEM培养基培养12 h,然后更换为含1 μmol/L胰岛素和25 mmol/L葡萄糖的DMEM培养基中培养,设置3 个复孔并设无胰岛素空白孔。经37 ℃、5% CO2孵育36 h后检测培养基上清液的葡萄糖含量。以空白孔葡萄糖含量减去样品孔葡萄糖含量计算出各孔细胞的葡萄糖消耗量[13]。
1.3.6 葡萄糖消耗实验
实验分为6 组:正常对照组(Control)、IR模型组、低质量浓度苦荞蛋白酶解肽组(2.5 μg/mL TBAH,L-TBAH)、中质量浓度苦荞蛋白酶解肽组(5 μg/mL TBAH,M-TBAH)、高质量浓度苦荞蛋白酶解肽组(10 μg/mL TBAH,H-TBAH)、罗格利酮阳性对照组(4 μg/mL,RGT)。TBAH各组的剂量根据葡萄糖消耗实验确定,罗格列酮的剂量参照文献[14]进行。建模完成后将48 孔培养板中旧培养液去除,正常对照组、IR模型组更换正常DMEM培养液。药物干预组分别给予相应浓度的药物处理24 h。24 h后采用葡萄糖氧化酶-过氧化物酶法测定每孔细胞培养基中葡萄糖的含量,通过与未接种细胞DMEM葡萄糖浓度平均值相减,计算每孔细胞葡萄糖的含量。
1.3.7 氧化损伤标志物活性及含量的检测
收集各组细胞,用磷酸盐缓冲液洗涤2 次,加入细胞裂解液,冰上裂解1 h,12 000 r/min、4 ℃离心10 min,收集上清液,细胞内总蛋白水平采用BCA法测定,SOD、LDH活力、MDA、NO含量的测定按照相应试剂盒说明书操作。
1.3.8 ROS水平检测
按照ROS试剂盒说明书操作。建模完成以后每孔加入母液DCFH-DA于培养基,使其浓度为10 µmol/L,37 ℃孵育细胞1 h。用0.25%胰蛋白酶消化细胞3 min,加入培养基终止消化,制成细胞悬液,1 000×g离心5 min收集细胞,用磷酸盐缓冲液洗涤2 次,离心收集细胞沉淀物用于荧光检测。将收集好的细胞用磷酸盐缓冲液重悬,计数,并用于检测。波长设置:最佳激发波长500、485 nm,最佳发射波长525 nm。孵育完毕,未消化的细胞使用荧光倒置显微镜记录拍照。
1.3.9 IRS-1、Akt、PI3K、GLUT4、p-IRS-1、p-Akt蛋白表达水平检测
提取各组细胞蛋白,采用BCA法蛋白定量后,取蛋白样品15 μg进行电泳,转膜、封闭、加入IRS-1、Akt、PI3K、GLUT4、p-IRS-1、p-Akt抗体孵育。洗涤之后加入辣根过氧化酶标记的二抗,孵育,洗涤后用ECL化学发光试剂反应,曝光后扫描,采用Image J软件进行光密度分析。
1.4 数据统计分析
实验重复3 次,实验数据以平均值±标准差表示,采用SPSS 19.0软件进行统计分析,采用方差齐性检验和单因素方差分析对多组进行比较,P<0.05具有统计学意义。
2 结果与分析
2.1 TBAH的氨基酸组成
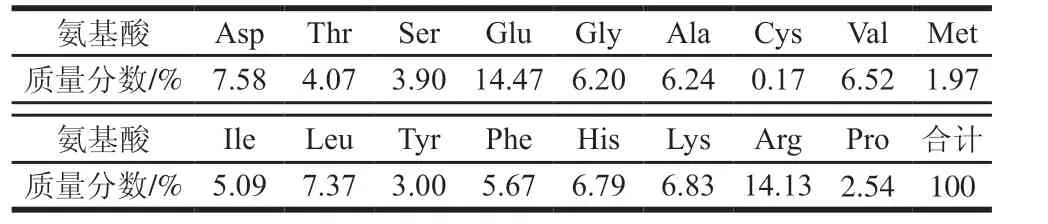
表1 分子质量小于3 kDa TBAH的氨基酸组成Table 1 Amino acid composition of TBAH (< 3 kDa)
由表1可知,TBAH富含谷氨酸(Glu)和精氨酸(Arg),质量分数分别为14.47%和14.13%,其他带电荷的极性氨基酸如天冬氨酸(Asp)、组氨酸(His)和赖氨酸(Lys),质量分数分别为7.58%、6.79%和6.83%,酸性氨基酸和碱性氨基酸的质量分数为49.80%;总的非极性疏水性氨基酸(甘氨酸(Gly)、丙氨酸(Ala)、脯氨酸(Pro)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile))的质量分数为33.78%;芳香族氨基酸中苯丙氨酸(Phe)质量分数为5.67%,酪氨酸(Tyr)质量分数为3.00%;而含硫氨基酸量很少,如甲硫氨酸(Met)质量分数为1.93%,半胱氨酸(Cys)质量分数仅为0.17%。
2.2 TBAH对IR HepG2细胞的葡萄糖消耗的影响
如表2所示,在HepG2细胞中,25 mmol/L葡萄糖和1 μmol/L胰岛素联合作用36 h可显著降低葡萄糖消耗量,IR组较正常对照组葡萄糖消耗量下降66%,表明高糖高胰岛素可诱导HepG2细胞IR。罗格列酮和TBAH作用后可提高葡萄糖消耗,TBAH的作用更强,并且呈剂量依赖性。结果表明TBAH可以减轻IR。

表2 TBAH对HepG2细胞IR的影响(n=3)Table 2 Effect of TBAH on insulin resistance in HepG2 cells (n= 3)
2.3 TBAH对IR HepG2细胞氧化指标的影响
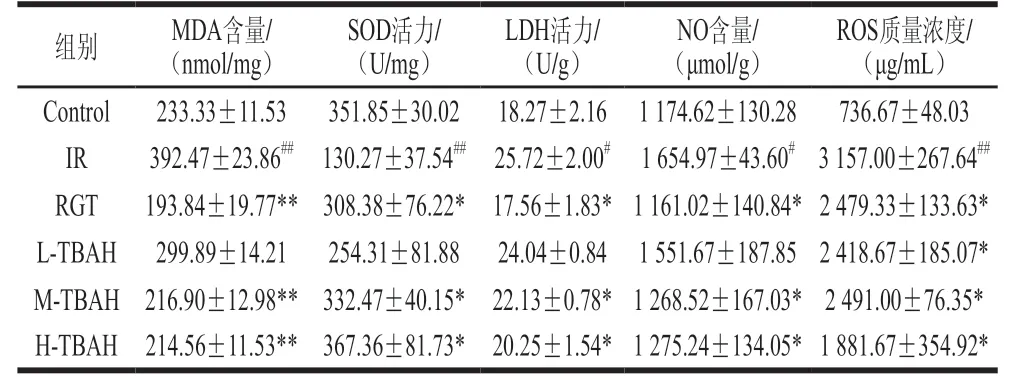
表3 TBAH对IR HepG2细胞氧化指标的影响(n=3)Table 3 Effect of TBAH on oxidative stress indices in HepG2 cells with insulin resistance (n= 3)
如表3所示,25 mmol/L葡萄糖和1 μmol/L胰岛素孵育HepG2细胞36 h,导致MDA、NO和ROS水平升高,同时SOD活力下降,LDH活力升高,说明在IR时氧化应激增强。与IR模型组相比,罗格列酮和TBAH可显著降低MDA、NO和ROS水平(表3和图1),同时提高SOD活力,降低LDH活力。TBAH对SOD的影响呈剂量依赖性。结果表明TBAH能改善IR的氧化损伤。
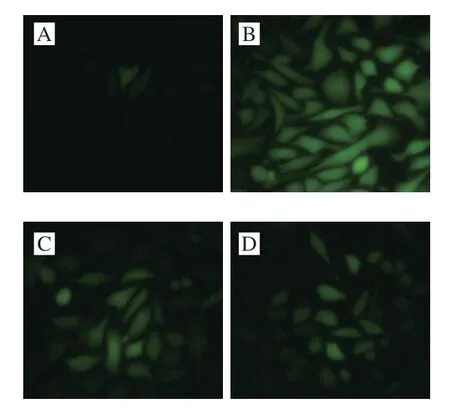
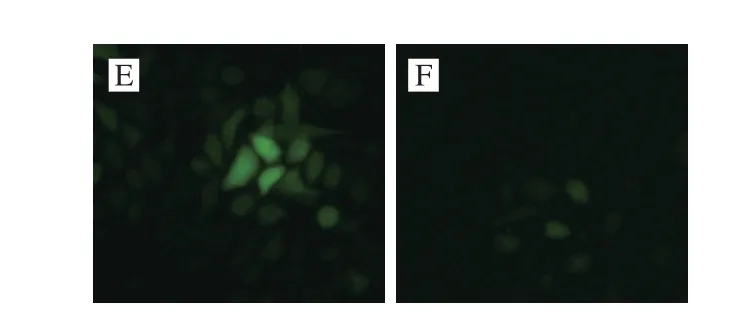
图1 TBAH对IR HepG2细胞中ROS的影响Fig.1 Effect of TBAH on ROS generation in HepG2 cells with insulin resistance
2.4 TBAH对IRS-1/PI3K/Akt胰岛素信号通路的影响
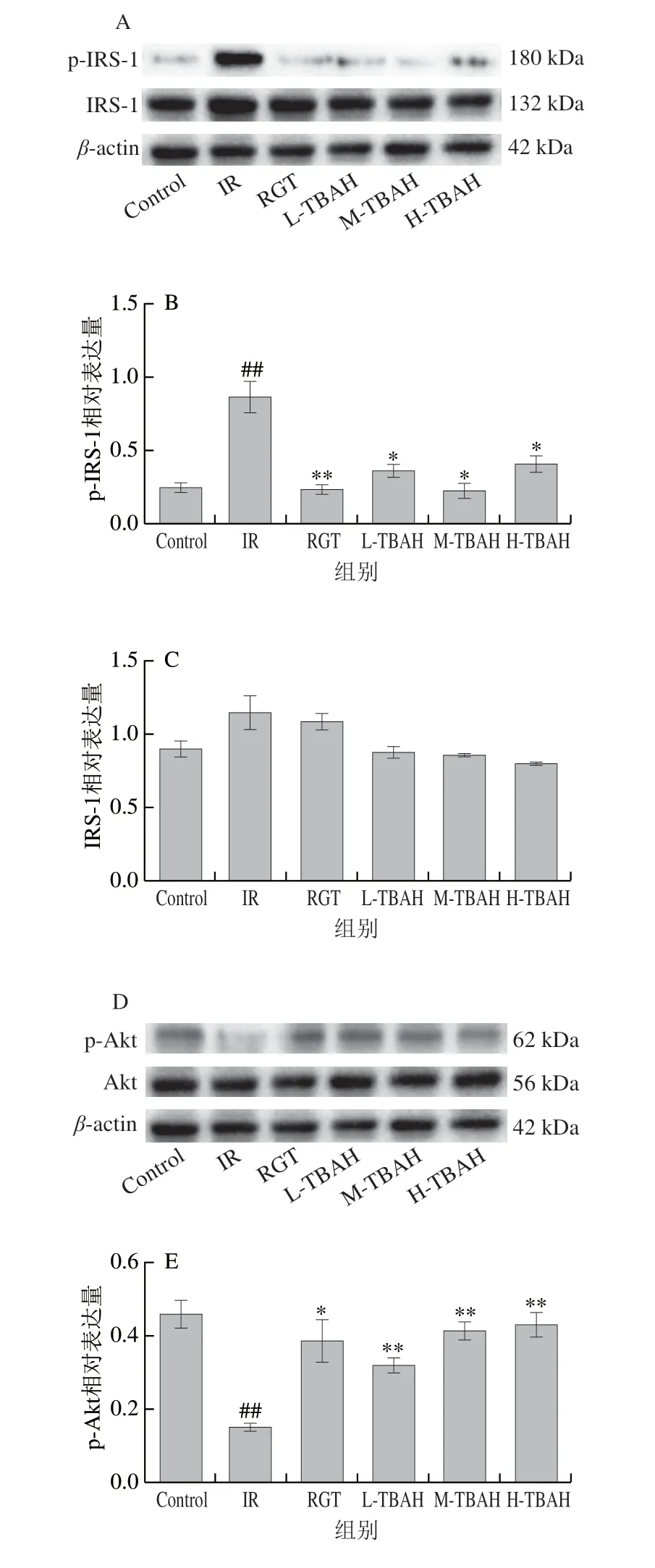

图2 TBAH对IR HepG2细胞IRS-1/PI3K/Akt信号通路的影响Fig.2 Effect of TBAH on IRS-1/PI3K/Akt signaling pathway in HepG2 cells with insulin resistance
如图2所示,高糖高胰岛素诱导的IR模型中,p-IRS-1(Ser307)表达水平增加,说明IR的发生与IRS-1的磷酸化调节密切相关,而罗格列酮和TBAH能明显地逆转这种变化。其次,IR模型中,PI3K、p-Akt表达水平降低,而罗格列酮和TBAH能促进PI3K、p-Akt的表达,结果提示TBAH对IR的改善可能与细胞中Akt蛋白的磷酸化调节有关。与IR模型组相比,罗格列酮和TBAH能促进GLUT4蛋白的表达,其中TBAH对GLUT4的影响呈剂量依赖性,说明TBAH通过促进GLUT4的表达提供细胞对葡萄糖的利用,从而降低血糖。
3 讨 论
因为氧化应激是IR发生发展的关键因素,因此,一些抗氧化剂用于改善IR和治疗T2DM。如N-乙酰半胱氨酸(N-acetylcysteine,NAC)是一种有效的自由基清除剂,已被证实可以降低高脂饮食诱导的肥胖小鼠的高血糖和高胰岛素血症,并改善IR[15]。近年来,蛋白水解物以其多种生物活性和高度的安全性引起众多研究者的关注[16]。研究认为生物活性肽的生物活性取决于它们的氨基酸组成和序列[17]。在具有抗氧化活性的生物活性肽中,含有羧基或氨基的氨基酸,如酸性氨基酸Glu、Asp和碱性氨基酸Arg、Lys和His可通过其电离基团与自由基相互作用,从而清除自由基,His的咪唑基还能通过提供电子将自由基转化为稳定分子而使自由基失活[18]。疏水氨基酸(Ala、Val、Gly、Ile和Leu)和芳香族氨基酸(如Tyr和Phe)可以通过直接电子转移或与疏水性靶点(如脂肪酸和细胞膜)相互作用来促进肽的自由基清除活性[19]。在本实验中,TBAH富含Glu(14.47%)和Arg(14.13%),此外,酸性氨基酸和碱性氨基酸的质量分数达到49.80%,非极性疏水性氨基酸质量分数为33.78%,说明TBAH含有丰富的抗氧化氨基酸。在IR细胞模型实验中,TBAH能降低氧化物MDA、NO和ROS的含量,同时提高了抗氧化酶SOD的活力,降低了氧化酶LDH的活力。说明TBAH能通过清除ROS来增强细胞抗氧化活性。
IR是T2DM的主要发病原因,IR的特征是葡萄糖消耗减少[20]。当体内出现IR时,胰岛素敏感组织对葡萄糖的利用率下降,导致糖尿病[21]。本实验采用高糖高胰岛素诱导HepG2细胞建立IR模型,发现25 mmol/L葡萄糖联合1 μmol/L胰岛素孵育细胞36 h后,葡萄糖消耗减少,而TBAH能增加细胞对葡萄糖的消耗,且呈剂量依赖性,提示TBAH可阻碍IR的发展。
在正常细胞中,胰岛素主要通过PI3K/Akt信号途径调节葡萄糖代谢[22-23]。当血糖水平升高,胰岛素结合并激活胰岛素受体,促进IRS-1的酪氨酸磷酸化,从而激活PI3K和Akt,调节葡萄糖转运和代谢[24-25]。此外,激活的PI3K/Akt信号途径促进GLUT4向细胞膜的运输,促进葡萄糖摄入到细胞中,并最终降低血糖水平[26]。研究认为IR的形成主要是由于胰岛素信号转导通路受阻,或者通路中关键蛋白作用减弱而使胰岛素不能发挥其正常的生理作用[27]。IRS蛋白的丝氨酸/苏氨酸磷酸化被认为是IR的分子基础[28-29],IRS-1的丝氨酸磷酸化,特别是Ser307和Ser636/639上的丝氨酸磷酸化后,可抑制IRS-1的酪氨酸磷酸化[30]。在本研究中,TBAH可逆转高糖高胰岛素引起的IRS-1蛋白Ser307磷酸化水平的升高,调节胰岛素信号转导,激活PI3K/Akt信号通路增加GLUT4的表达,从而增加细胞对葡萄糖的摄取。
综上所述,在高糖高胰岛素诱导的IR中,TBAH可防止HepG2细胞氧化-抗氧化系统失衡,通过抑制IRS-1蛋白Ser307磷酸化,激活PI3K/Akt信号通路,增加GLUT4的表达,进而促进细胞对葡萄糖的摄取,从而改善IR。
