榆干离褶伞溶栓酶对大鼠动脉血栓的抑制作用
2021-01-20李芳芳沈明花
李芳芳,卫 莹,刘 雪,沈明花
(延边大学医学院,吉林 延吉 133000)
血管内皮细胞的损伤及血小板的活化在血栓形成过程中起重要作用。血管内皮细胞不仅是血液与组织间的机械屏障,而且具有内分泌功能。它分泌的生物活性物质,如前列腺素I2、一氧化氮等在抗血小板聚集、抗凝血和纤溶方面起重要作用[1]。血小板是成熟的巨核细胞脱落下来的小块胞质,参与机体的止血、炎症等反应[2-3]。血小板异常活化与血栓形成密切相关[4]。在氧化应激、高糖等多种诱因的作用下,血管内皮细胞损伤时继发血小板的活化[5]。活化的血小板通过其膜表面的糖蛋白Ib与von Willebrand因子相结合,介导血小板的黏附和聚集,引发血栓的形成[6-7]。因此对血管内皮细胞的保护及抗血小板活化是预防或治疗血栓形成的关键。
榆干离褶伞(Lyophyllum ulmarium),又名大榆蘑,主要分布于我国河北、吉林等地。榆干离褶伞发酵液具有抗氧化[8]、溶血栓[9]等作用。榆干离褶伞溶栓酶(Lyophyllum ulmariumfibrinolytic enzyme,LUFE)是从榆干离褶伞菌丝体中分离纯化的分子质量为50 kDa的溶栓酶,在体外可以水解纤维蛋白及纤维蛋白原[10]。本课题组前期研究表明,LUFE对肝脏[11]、对氧化应激所致的血管内皮细胞损伤具有保护作用[12]。鉴于血管内皮细胞损伤和血小板的活化与血栓形成关系密切,本实验一方面通过建立大鼠颈动脉血栓模型,观察LUFE对血管内皮细胞及血小板活化的影响;另一方面在体外以胶原作为诱导剂,观察LUFE对血小板的功能及其对磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路的影响,初步探讨LUFE的抗血栓机制,为榆干离褶伞的生物学活性提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
80 只清洁级SD大鼠,体质量180~220 g,雌雄各半,由延边大学动物实验中心提供,生产许可证号:SCXK(吉)2017-0003。LUFE及其粗提取物由延边大学医学院生物化学与分子生物学研究室提供。
可溶性血栓调节蛋白(soluble thrombomodulin,sTM)、E-选择素、组织因子(tissue factor,TF)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、血小板活化因子(platelet-activating factor,PAF)、P-选择素、β-血小板球蛋白(β-thromboglobulin,β-TG)和血小板膜糖蛋白IIbIIIa(glycoprotein IIbIIIa,GPIIbIIIa)试剂盒 上海严谨生物科技有限公司;藻红蛋白(p-phycoerythrin,PE)标记的CD61、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD62P、FITC标记的同型对照免疫球蛋白(immunoglobulins G,IgG)1美国B D 公司; 胶原 美国S i g m a 公司;山羊抗兔IgG抗体 纳川科技公司;p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)抗体、phospho-p38 MAPK抗体 艾博抗(上海)贸易有限公司;β-actin 美国CST公司。
1.2 仪器与设备
酶标仪 美国Bio Tek公司;凝胶成像分析仪 美国UVP公司;流式细胞分析仪 美国Beckman公司。
1.3 方法
1.3.1 实验动物分组及处理
将大鼠随机分为5 组,即假手术组、模型组、阳性对照组、LUFE低、高剂量组,每组10 只。阳性对照组按10 mg/kgmb灌胃阿司匹林,LUFE低、高剂量组分别按100、400 mg/kgmb灌胃LUFE粗提取物,连续7 d[10-11]。假手术组和模型组灌胃等量生理盐水。最后一次灌胃30 min后麻醉大鼠(腹腔注射戊巴比妥钠),建立颈动脉血栓模型[13]。颈部正中切口,钝性分离、暴露右侧颈总动脉,其底下垫1 cm×1.5 cm的透明薄膜以保护周围组织。除假手术组外的其余各组均用0.5 cm×0.5 cm浸有质量分数20%三氯化铁溶液的滤纸条包裹该段颈总动脉,假手术组用生理盐水替代三氯化铁溶液。20 min后拿下滤纸条,40 min后结扎透明薄膜两端血管,按照薄膜长度剪下该段血管,并取出血栓,称质量,按下式计算血栓抑制率。

式中:m1为模型组血栓湿质量/mg;m2为LUFE(或阿司匹林)处理组血栓湿质量/mg。
另取病变部位血管用于苏木精-伊红(hematoxylin-eosin,HE)染色。大鼠心脏取血,室温放置1 h后再置于4 ℃冰箱3 h,待凝血后以3 000 r/min离心15 min,分离血清,用于相关指标的检测。
1.3.2 sTM、E-选择素、TF、TNFα、IL-6和PAF水平的测定
用酶联免疫吸附法测定血清TNFα、IL-6、sTM、E-选择素、TF和PAF水平,按照试剂盒说明书进行操作。
1.3.3 血管组织形态学观察
将取下的动脉组织置于体积分数4%多聚甲醛溶液中固定,经体积分数70%~100%乙醇逐步脱水,透明、浸蜡包埋处理,切片后进行HE染色。最后于200 倍光学显微镜下观察其结构变化。
1.3.4 流式细胞术检测血小板CD62P水平
取2 支流式上样管,各加入2 μL的CD61-PE,然后每管分别加入IgG1-FITC(对照)和CD62P-FITC各2 μL,再加入由磷酸盐缓冲液稀释20 倍的大鼠血液100 μL。混匀,室温下避光静置15 min。然后加入预冷的体积分数1%多聚甲醛1 mL,4 ℃暗环境静置30 min后测定血小板CD62P的荧光强度。
1.3.5 血小板血浆P-选择素、β-TG和GPIIbIIIa水平的测定
取成年的健康SD大鼠,心脏采血5 mL,采用质量分数3.8%的枸橼酸钠抗凝血,使血液与抗凝剂的体积比例为9∶1,150×g离心10 min,上层为富含血小板血浆。继续4 000 r/min离心10 min,即为贫血小板血浆,用贫血小板血浆重悬富含血小板血浆,调整血小板数为3×108个/mL。将上述血小板血浆分为4 组:对照组(Control)、胶原处理组(Collagen)、胶原+LUFE低剂量组(Collagen+LUFE-L)、胶原+LUFE高剂量组(Collagen+LUFE-H)。各组处理过程如下:Collagen+LUFE-L组和Collagen+LUFE-H组血小板血浆分别以质量浓度0.8、1.2 mg/mL的LUFE预处理10 min,然后在Collagen、Collagen+LUFE-L、Collagen+LUFE-H组中各加入质量浓度2 μg/mL的胶原,刺激5 min后用酶标仪测定各组的P-选择素、β-TG和GPIIbIIIa水平。
1.3.6 Western blot检测PI3K/Akt信号通路相关蛋白表达
洗涤血小板的制备[14]:同1.3.5节,取血后按体积比1∶1加入台式(Tyrode)缓冲液,稀释抗凝血。加入终质量浓度为50 ng/mL的PGE1,160×g离心15 min,收集上层富含血小板血浆。加入Hepes-Tyrode缓冲液,750×g离心10 min,弃上清液。用无Ca2+的Hepes-Tyrode缓冲液重悬血小板,并调整血小板数,制备3×108个/mL的洗涤血小板悬液。将血小板悬液分为4 组:对照组(Control)、胶原处理组(Collagen)、胶原+LUFE低剂量组(Collagen+LUFE-L)、胶原+LUFE高剂量组(Collagen+LUFE-H)。LUFE-L、LUFE-H组血小板分别以质量浓度0.8、1.2 mg/mL的LUFE预处理5 min后,分别将Collagen、Collagen+LUFE-L、Collagen+LUFE-H组血小板用质量浓度2 μg/mL的胶原刺激10 min,用十二烷基硫酸钠(sodium dodecyl sulfate,SDS)终止反应。在各组血小板中分别加入蛋白裂解液,冰浴裂解30 min,12 000 r/min离心10 min,收集上清液,加入上样缓冲液,样品在沸水中变性5 min。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白、电转至PVDF膜。质量分数5%脱脂奶粉室温封闭2 h,分别加入相应的一抗,4 ℃孵育过夜。用TBST缓冲液洗涤后加入二抗(山羊抗兔IgG),室温孵育1 h,冲洗后显影。
1.4 数据处理与分析
实验数据以平均值±标准差表示,采用SPSS 20.0统计软件进行数据分析。多组间比较采用单因素方差分析,平均值间两两比较采用最小显著差异法-t检验。P<0.05表示有统计学意义。
2 结果与分析
2.1 LUFE对大鼠血栓质量的影响

表1 LUFE对大鼠血栓质量的影响Table 1 Effect of fibrinolytic enzyme from Lyophyllum ulmarium on thrombus mass
如表1所示,模型组血栓质量为3.7 mg,假手术组无血栓形成,表明血栓模型建立成功。阳性对照组和LUFE低、高剂量组血栓质量较模型组显著减小(P<0.05,P<0.01),提示阿司匹林和LUFE在一定程度上能够抑制大鼠动脉血栓的形成。
2.2 LUFE对大鼠血管组织形态学变化的影响
如图1所示,假手术组颈动脉内膜结构完整,内皮细胞排列连续、规整,血管腔内未见血栓形成。模型组血管内膜的完整性被破坏,血管腔内可见红细胞和大量血小板组成的混合血栓,并存在较多的炎性细胞。与模型组相比,阳性对照组和LUFE高剂量组血管内膜较光滑,虽然管腔内仍可见血栓形成,但栓体明显缩小、疏松,血小板聚集程度减轻,炎性细胞数量减少。

图1 LUFE对大鼠血管形态学的影响Fig.1 Effect of LUFE on carotid arterial vascular morphology in rats
2.3 LUFE对炎症因子水平的影响
IL-6作为具有多种生物活性的促炎因子,不仅可以诱导高凝状态,还可以促进内皮素的生成,引起血管壁损伤,从而促进血栓形成。PAF是由血小板、血管内皮细胞和中性粒细胞等在特异性刺激下释放的一种具有广泛生物活性的磷脂。PAF对血小板-中性粒细胞的活化过程有重要作用,是目前发现最强的炎症因子和血小板聚集诱导剂[15]。如表2所示,与假手术组相比,模型组TNF-α、IL-6和PAF水平明显上调,说明三氯化铁溶液作用于血管壁以后能够引起局部的炎症反应。阳性对照组和LUFE高剂量组炎症因子水平显著低于模型组(P<0.05,P<0.01),并且LUFE高剂量组与阳性对照组之间无显著性差异(P>0.05),提示阿司匹林和高质量浓度的LUFE能够抑制炎症因子的产生或释放。

表2 LUFE对TNF-α、IL-6和PAF水平的影响Table 2 Effect of LUFE on the levels of TNF-α, IL-6 and PAF
2.4 LUFE对血管内皮细胞损伤标志物的影响
TM是血管内皮细胞等多种细胞膜表面的跨膜糖蛋白。血浆中TM主要为损伤血管内皮细胞TM的降解产物,其水平可反映血管内皮损伤的程度,作为判断血管内皮损伤的标准[16]。E-选择素主要由内皮细胞合成,当内皮细胞活化或损伤时,其从细胞上脱落而进入血液。因此,可溶性E-选择素也是内皮功能障碍的标志物[17]。TF是一种跨膜糖蛋白,是启动体内凝血过程的重要因子及血栓形成的关键因素。正常情况下,血管内皮细胞和外周血细胞中检测不到TF,但在血管内皮细胞受到损伤或受炎性因子刺激时可诱发性表达TF[18],因此,TF也可以作为内皮细胞损伤的标志。如表3所示,血管内膜受到三氯化铁溶液的刺激会引起血管内皮细胞的氧化损伤,模型组的sTM、E-选择素和TF水平极显著高于假手术组(P<0.01)。而LUFE干预后能够抑制sTM、E-选择素和TF水平的上调,提示溶栓酶对血管内皮细胞具有保护作用。

表3 LUFE对sTM、E-选择素和TF水平的影响Table 3 Effect of LUFE on the levels of sTM, E-selectin and TF
2.5 LUFE对血小板CD62P的影响
CD62P又称P-选择素,主要分布于血小板α颗粒和血管内皮细胞的棒状管小体内,是血小板活化的特异性标志物[19]。在静息状态下,CD62P在血小板上极少表达。当血小板活化时,CD62P随α颗粒释放并与血小板膜融合,大量表达于血小板膜表面。如图2所示,假手术组大鼠血小板CD62P的荧光强度为492.1±68.6,模型组CD62P荧光强度为807.6±127.3,明显高于假手术组;而阳性对照组荧光强度(588.4±109.2)和高剂量组荧光强度(686.4±119.2)明显低于模型组,提示阿司匹林和LUFE能够抑制血管内膜炎症反应所致的血小板活化。


图2 流式细胞仪检测血小板CD62P表达水平Fig.2 Expression level of CD62P on the surface of platelets measured by cytometry
2.6 LUFE对富含血小板血浆P-选择素、β-TG、GPIIbIIIa水平的影响
在体外,以胶原刺激血小板后观察LUFE对血小板活化标志物的影响。当血小板活化时,血小板膜表面的P-选择素表达上调,并有部分释放入血液,导致其水平升高。GPIIbIIIa是血小板膜上的糖蛋白,能够与血管性假血友病因子或纤维蛋白原结合,参与血小板的聚集,促进血栓的形成。β-TG是血小板α颗粒中的特异性球蛋白,在诱导剂的作用下血小板被活化时其释放增多,因此可作为血小板活化的指标[20]。如表4所示,经胶原刺激后,富含血小板血浆中Collagen组P-选择素、β-TG和GPIIbIIIa水平显著高于Control组(P<0.05,P<0.01),而经LUFE处理后能显著降低P-选择素、β-TG和GPIIbIIIa水平(P<0.05,P<0.01),提示LUFE能抑制胶原诱导的血小板活化。

表4 LUFE对富含血小板血浆P-选择素、β-TG、GPIIbIIIa水平的影响Table 4 Effect of LUFE on the levels of P-selectin,β-TG and GPIIbIIIa
2.7 LUFE对血小板PI3K、Akt、p38 MAPK磷酸化水平的影响
PI3K/Akt、p38 MAPK信号通路参与小板活化过程[21]。如图3所示,胶原刺激后,PI3K、Akt和p38 MAPK的磷酸化水平上调。经LUFE处理后可以下调PI3K、Akt和p38 MAPK的磷酸化水平。
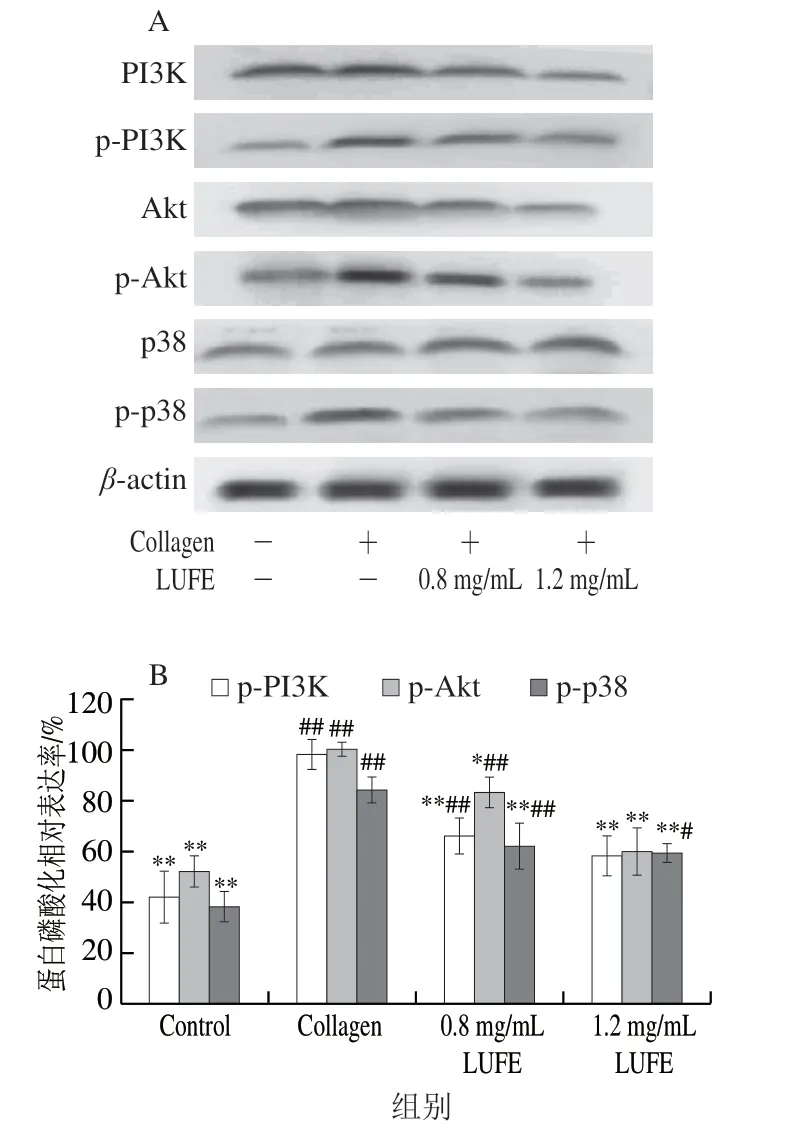
图3 LUFE对血小板PI3K、Akt和p38蛋白磷酸化水平的影响Fig.3 Effect of LUFE on the phosphorylation levels of PI3K, Akt and p38 in platelets
3 讨 论
血栓形成是缺血性心血管疾病和血栓栓塞性疾病的主要病理过程。内皮细胞损伤和血小板的活化是血栓形成的病理基础。本实验通过建立大鼠动脉血栓模型,从保护血管内皮细胞和抑制血小板活化角度探讨了LUFE对血栓形成的抑制作用。
本实验以三氯化铁溶液外敷颈动脉的方法建立动脉血栓模型。三氯化铁溶液中的高价铁能够氧化损伤血管内膜,引起内皮细胞的损伤。HE染色结果显示,模型组血管内膜的完整性遭到破坏,管腔内可见炎症细胞浸润及血栓形成。血栓的形成导致局部缺氧,缺氧进一步加重血管内皮细胞的损伤,导致模型组大鼠sTM、E-选择素和TF等血管内皮细胞特异性指标显著上调。内皮细胞的损伤,一方面使胶原暴露引起血小板的活化;另一方面能引起局部血管的炎症反应。有研究报道,血栓形成过程中并存炎症反应[22-24],而且这种炎症反应和血栓的形成相互联系、相互促进。本实验以三氯化铁溶液诱导血栓形成的过程中,模型组TNF-α、IL-6和PAF水平明显高于假手术组,说明血栓模型建立过程中伴有炎症反应,而且这种炎症反应进一步损伤血管内皮细胞。PAF是由血小板、血管内皮细胞和中性粒细胞等多种细胞产生的一种促炎介质。研究报道,PAF与G蛋白偶联受体结合后通过激活磷脂酶C(phospholipase C,PLC),引起蛋白激酶C的活化和胞浆中Ca2+增加,继而活化血小板并促进血栓的形成[25]。由此认为,模型组大鼠高水平的PAF可以活化血小板,促进血栓形成。流式细胞仪检测结果表明,模型组大鼠的CD62P明显高于假手术组,这可能与高水平的PAF有关(图2)。经LUFE预处理后发现,其可以抑制血栓的形成(表1)、减轻血管内膜的病理改变、下调血管内皮细胞损伤标志物水平和血小板表面CD62P表达水平,提示LUFE可能通抗炎作用来保护血管内皮细胞,抑制血小板的活化和血栓的形成。本课题组前期研究发现,LUFE通过降低细胞内活性氧的水平对氧化应激损伤人血管内皮细胞有保护作用[12],这与本实验结果一致。
在动脉血栓形成过程中血小板的活化起关键作用。当血管发生炎症或血管内膜损伤时内皮下胶原被暴露,血小板通过黏附、聚集作用并释放血栓烷A2等生物活性物质,影响白细胞、血管内皮细胞的功能,并进一步激活血小板,从而促进血栓的形成。在动脉血栓形成的起始过程中,胶原与血小板的结合起关键作用[26]。因此,本实验在体外以胶原诱导血小板的活化,观察了LUFE对血小板活化的特异性指标的影响。结果表明,LUFE能够下调胶原诱导的富含血小板血浆可溶性P-选择素、β-TG和GPIIbIIIa水平,提示LUFE可能抑制血小板黏附、分泌及聚集过程。在胶原诱导的血小板活化过程中PI3K/Akt通路起重要作用[27-28]。血小板膜GPVI作为胶原受体,参与由胶原介导的PI3K/Akt信号传导过程。胶原与GPVI结合后通过Src家族激酶激活免疫球蛋白Fc受体的免疫受体酪氨酸激活基序磷酸化位点,引起脾酪氨酸激酶(spleen tyrosine kinase,Syk)的活化。Syk的活化进一步启动下游信号级联反应,包括活化T细胞跨膜连接蛋白的磷酸化和信号复合体的组装。这种信号复合体包括磷酸化LAT在内的3 种蛋白,而这3 种蛋白与PI3K、三磷酸鸟苷交换因子等许多信号分子相关。这些信号分子对血小板GPVI信号通路中的磷脂酶Cγ2(phospholipase Cγ2,PLCγ2)的募集和激活至关重要。如PLCγ2通过与PI3K产物-磷脂酰肌醇3,4,5-三磷酸结合促进其向质膜的募集。而这种PLCγ2向质膜的转位对其活性很重要[29]。活化的PLCγ2催化磷脂酰肌醇-4,5-二磷酸产生二酰甘油和三磷酸肌醇。这2 种第二信使进一步激活下游信号分子引起血小板从内向外的信号传导,最终作用于GPIIbIIIa,引起血小板的黏附及聚集反应[30]。Akt是PI3K下游的重要信号分子,它的磷酸化是PI3K信号通路的激活标志[31]。结果表明,LUFE抑制PI3K和Akt(Ser473)的磷酸化过程,提示LUFE可能通过PI3K/Akt信号通路,影响血小板PLCγ2的募集和激活过程,继而影响血小板的功能。此外,在胶原诱导血小板激活的过程中,LUFE能降低p38 MAPK的磷酸化水平,提示p38 MAPK也是LUFE影响血小板功能的信号分子之一。
综上,LUFE能够抑制大鼠动脉血栓的形成,抑制机制可能与其抗血小板作用以及对血管内皮细胞的保护作用有关。
