酪蛋白酸钠-大豆油乳化体系的影响因素
2021-01-20彭松林张伊侬赵紫悦李懿璇康梦瑶尚永彪
彭松林,张伊侬,赵紫悦,李懿璇,康梦瑶,尚永彪,2,3*
1(西南大学 食品科学学院,重庆,400715)2(农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆,400715) 3(重庆市特色食品工程技术研究中心,重庆,400715)
在肉糜类制品中添加外源性油脂能够起到增进风味、改善营养结构等作用。但若在肉糜制备的过程中直接添加外源油脂,容易出现油脂析出等质量缺陷。与其他物料斩拌混合前,先以适量蛋白质溶液与外源油脂进行乳化,使蛋白质分散并包裹和吸附在油脂颗粒的表面,这样就能够缓解肉糜在热处理时油脂流失的问题。显然,外源油脂的乳化效果对产品的保油性有着重要的影响,乳化效果好则产品的保油性就好。影响乳化效果的因素有油水混合非均相体系条件以及物理处理方法等[1-3]。蛋白质的添加量一定程度上会影响乳液液滴粒径的大小,从而影响乳液的稳定性,但若添加量过多,两相界面的蛋白吸附量超过临界值,乳液中可能会发生排斥絮凝[4],影响后续加工过程中与肉糜等物料的混合,可能不利于产品口感。而且随着蛋白质含量增加,产品硬度增加、多汁性降低[5]。油脂与水分作为乳化液的主要组成部分,两者的比例对乳液的性质也有很大的影响。TANG等[6]利用大豆分离蛋白纳米颗粒制备乳化液时,发现体系中油相体积的增加能够使乳液更加稳定,不易分层。DICKINSON等[7]研究高脂水比乳化液时有相同结论,并指出乳液剪切黏度的增加与油滴的堆叠程度有关。pH与NaCl浓度是蛋白质功能性质的重要影响因素,对蛋白质的乳化性及乳化稳定性有着显著的影响[8]。LIANG等[9]在研究豌豆蛋白时发现,pH为3时所制备的水包油(oil in water,O/W)型乳状液表现出较好的稳定性。朱振宝等[10]发现,体系中NaCl浓度的变化对乳清蛋白及酪蛋白的乳化液稳定性都有很大影响。除了油水混合非均相体系条件外,物理处理方法如超声波辅助处理[11]、微波辅助处理[12]、高压微射流均质处理[13-14]等对乳化效果也有显著的影响。
本研究以大豆油为外源油脂、以酪蛋白酸钠为乳化剂,研究不同的蛋白添加量、脂水体积比、体系pH环境及NaCl浓度变化对所制得乳化液其乳液黏度、界面蛋白吸附量、乳化液滴粒径及分布和微观结构、zeta-电位指标等的影响,探讨不同体系条件对油脂乳化效果的影响及其原理,为其在后续工艺中的应用提供一定参考。
1 材料与方法
1.1 材料与试剂
酪蛋白酸钠(蛋白质含量≥90.00%),万利达生物科技有限公司;大豆油,九三非转基因一级大豆油;纯净水;NaOH、HCl、NaCl、NaH2PO4、Na2HPO4、SDS,均为分析纯,成都市科龙化工试剂厂。
1.2 仪器与设备
XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司;PHS-4C+酸度计,成都世纪方舟科技有限公司;5810型台式高速离心机,德国Eppendorf公司;MCR302流变仪,奥地利安东帕公司;BX53荧光正置显微镜,日本OLYMPUS公司;ZEN3690马尔文激光粒度分析仪,英国马尔文仪器公司;JT1001 N电子称、FA2004A电子天平,上海精天电子仪器有限公司;DW-25 W518冰箱,青岛海尔电器有限公司。
1.3 试验方法
1.3.1 乳化液的制备
取50 mL烧杯,乳化液总体积为30 mL,将酪蛋白酸钠、大豆油、纯净水混合,采用内切式匀浆机在6 000 r/min条件下进行乳化均质,时间为30 s,间隔30 s,匀浆3次。每个处理组做3个重复。
1.3.2 试验设计
1.3.2.1 酪蛋白酸钠添加量对乳化液乳化效果的影响
在50 mL烧杯中加入15 mL大豆油,15 mL纯净水(脂水体积比为1∶1),添加酪蛋白酸钠的质量分数分别为0.1%、0.2%、0.3%、0.4%、0.5%,室温下操作,将混合液匀浆均质,测定乳化液的相关指标,评价乳化效果。
1.3.2.2 脂水比对乳化液乳化效果的影响
分别将30 mL脂水比为1∶1,1∶2,2∶1,2∶3,3∶2的混合物添加到50 mL的烧杯中,添加0.3%酪蛋白酸钠,将混合液匀浆均质,测定乳化液的相关指标,评价乳化效果。
1.3.2.3 pH对乳化液乳化效果的影响
在50 mL烧杯中加入30 mL脂水比为1∶1的混合物、0.3%酪蛋白酸钠,配制成乳化液。使用0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液调节乳液pH分别为3、5、7、9、11,测定乳化液的相关指标,评价pH对乳化液乳化效果的影响。
1.3.2.4 NaCl浓度对乳化液乳化效果的影响
在50 mL烧杯中加入30 mL脂水比为1∶1的混合物、0.3%酪蛋白酸钠,配制成乳化液。然后加入NaCl,将NaCl浓度分别调至0、0.06、0.12、0.36、0.6、0.84 mol/L,充分振荡溶解并混匀,测定乳化液的相关指标,评价NaCl对乳化液乳化效果的影响。
1.3.3 乳化液黏度的测定
采用流变仪测定乳液黏度。取适量样品置于50 mm平板上,使其均匀分布并防止气泡产生。具体测定参数参考PICOTTI等[15]的方法:测试温度25 ℃,剪切速率1~1 000 s-1,总剪切时间310 s。
1.3.4 界面蛋白吸附量的测定
参考李超[16]的测定方法并稍作改动。将制好的新鲜乳液立即倒入50 mL离心管中,在4 ℃条件下10 000 r/min离心30 min。用注射器将下层清液取出,测定清液中的蛋白质浓度。乳液界面蛋白吸附量按公式(1)计算:
(1)
式中:AP,乳液界面蛋白吸附量;Cinitial,溶液的蛋白质初始浓度;Caq,离心后下层清液中的蛋白质浓度。
1.3.5 油滴粒径大小与分布的测定
使用Image J软件对图像中油滴粒径大小进行测量。每个样品选取3张不同放大倍数的照片,每张照片选取100个较清晰的油滴进行测量,总计300个。油滴平均粒径取平均值,根据所得的测量数据统计分析样品油滴的粒径分布[17]。
1.3.6 微观结构分析
用移液枪吸取1 mL乳化液加入到3 mL SDS溶液中进行稀释,混匀后吸取20 μL样液滴到载玻片上,立即盖上盖玻片,选择10倍目镜,并分别用4倍、20倍、40倍物镜观察样品,选择视野清晰、乳滴分布较均匀的区域进行拍照记录。
1.3.7 zeta-电位的测定
采用马尔文激光粒度分析仪对pH、NaCl乳化液表面电位进行测定。参考孔静[18]的方法,测定前先用10 mmol/L pH 7的磷酸缓冲液将样品稀释。上样体积为1 mL,测量温度25 ℃,平衡时间为1 min,每个样品重复测定3次,取平均值。
1.3.8 数据处理
实验共重复3次,每次实验的每个处理有3个平行样。数据采用平均值±标准偏差表示。用Excel 2016进行数据处理,用Origin 2018软件进行绘图,用SPSS Statistics 17.0进行显著性分析,P<0.05表明结果具有差异显著性。
2 结果与分析
2.1 蛋白添加量对乳化液乳化效果的影响
2.1.1 蛋白添加量对乳液黏度的影响
黏度是影响乳化液稳定性的重要因素,通常乳液的黏度越大,越有利于保持乳化体系的稳定。由图1可见,剪切初期,随着蛋白添加量增加,乳化液初始黏度显著升高,且增长速率不断加大。随着剪切速率的增加,乳化液黏度变稀,各组之间黏度差距逐渐减小,最终趋于平稳。剪切变稀现象说明乳液为假塑形流体[19],而当剪切速率增加到足够克服其中的布朗运动,以及蛋白质-蛋白质或者蛋白质-油脂之间弱键产生的综合效应时[20],乳化液滴在流场作用下变得更加有序,从而剪切抗性降低,黏度下降[21-22]。
乳液黏度越大,液滴运动需要冲破的阻力也就越多,因此乳液失稳的速度会随着蛋白添加量的增加而减缓。李成倍等[23]研究表明,酪蛋白酸钠水溶液会随着蛋白浓度的增加而明显增稠,因此当油相分散在水相后,酪蛋白酸钠溶液自身黏度越大,越能限制油滴运动,阻碍其迁移或聚集。另外,蛋白添加量越多,体系中有足够的蛋白可以吸附在油滴表面将其包裹住,故油滴聚合的趋势减弱。油水界面吸附更多的蛋白质有利于分子间相互作用,使这些小油滴相互桥联形成较为致密的类三维网状结构[24],更有利于乳化体系的稳定。

图1 蛋白添加量对乳化液黏度的影响Fig.1 Effect of protein content on viscosity of emulsion
2.1.2 蛋白添加量对界面蛋白吸附量的影响
由于脂水比一定,蛋白添加量不同直接导致初始蛋白浓度不同,因此本文在测出蛋白吸附百分比(AP%)的基础上还计算了实际的蛋白吸附质量(mg)予以参考。由图2可知,蛋白添加量从0.1%增加到0.3%,其界面蛋白的吸附量(AP%)从19.25%升至33.71%,增长速率较快;而继续增加蛋白添加量至0.5%,AP%仅为38.56%,增长速率减慢。在上述范围内,随着蛋白添加量增加,油水界面实际吸附蛋白量几乎呈直线增长,说明界面蛋白吸附量可能尚未达到饱和。若单考虑蛋白颗粒吸附在油水界面的过程,低浓度时,吸附的蛋白数量不足以完全包裹住油滴;随着浓度的增加,吸附的蛋白越来越多,直至油滴表面被单层颗粒覆盖;浓度继续增加,蛋白间的相互作用则会使更多的蛋白颗粒聚集在界面上,从而形成多层吸附[25],使界面膜强度及乳液黏弹性得以提高,因此乳化液呈越来越稳定的趋势。但需要注意蛋白吸附量的临界值,蛋白添加量过多可能会造成乳滴排斥絮凝。

图2 蛋白添加量对界面蛋白吸附量的影响Fig.2 Effect of protein addition on interfacial protein adsorption 注:组间不同小写字母表示差异显著(P<0.05)(下同)
2.1.3 蛋白添加量对乳液油滴平均粒径与分布的影响
由图3-a可知,随着蛋白添加量的增加,乳液平均粒径降低速度先快后慢。添加量≤0.3%时,每增加0.1%的蛋白质,乳液平均粒径都能降低20 μm左右,变化十分显著;而添加量为0.4%和0.5%的样品组,乳液平均粒径分别为9.34 μm和7.28 μm,减小的速率明显减缓,说明此时蛋白浓度不再是影响平均粒径的主要因素,若继续添加更多的蛋白,乳液粒径不会再明显减小,甚至可能出现因乳液黏度过高,不利于乳液均质的现象。若需进一步降低乳液粒径,则需要调整剪切强度、延长均质时间或者采用其他处理来实现。由图3-b可知,随着蛋白添加量的增加,乳液的粒径分布范围有明显变小、变窄、变均匀的趋势。添加量为0.1%时,粒径分布跨度很大,呈几微米到几百微米的多分散状态,说明此时蛋白添加量不足,乳液中油滴聚合现象很严重。添加量≥0.4%时,油滴粒径分布主要集中在20 μm以下,乳滴分散相对均匀,没有明显聚合的大油滴出现,有利于乳化体系的稳定。

图3 蛋白添加量对乳化液油滴平均粒径(a) 及分布(b)的影响Fig.3 Effect of protein content on average particle size (a) and distribution (b) of oil droplets in emulsion
2.2 脂水比对乳化液乳化效果的影响
2.2.1 脂水比对乳液黏度的影响
由图4可见,随着脂水比的增加,乳液黏度呈增长趋势,尤其是脂水比>1∶1的2个组较其他组黏度更大,其剪切初期黏度为1∶1样品组的4.5~6倍,这与TANG等[6]研究结论一致。乳液黏度升高的原因可能是,油相作为分散相,分布在体积较小的水相中油滴分布空间受限,液滴间需要紧凑排列甚至被压缩,从而导致体系剪切黏度上升[7]。此外,蛋白包裹的油滴可看作乳液体系中形成的类凝胶网络的填充物,而油滴上吸附的蛋白颗粒间的相互联结作用,加强了类凝胶网络的紧密程度,使体系黏度升高[26-27]。

图4 脂水比对乳化液黏度的影响Fig.4 Effect of lipid-water ratio on viscosity of emulsion
2.2.2 脂水比对界面蛋白吸附量的影响
由图5可知,随脂水比的增加,界面蛋白吸附量(AP%)总体上显著增加。其中脂水比2∶3组与1∶1组AP%差别不大,甚至略高于后者。目前尚未有明确的油水比例界限划分乳液类型是O/W还是W/O,本研究中,脂水比3∶2和2∶1 两个样品组,虽然油相体积大于水相体积,但观察到的乳液体系依然为O/W型。因此乳液均质后油水界面浓度随脂水比的增加而增大,为蛋白质的吸附提供了更多的面积,蛋白吸附量也相应增多。但实际上蛋白质在油水界面的吸附并不简单,除蛋白质本身浓度影响外,蛋白在界面的展开速率与其吸附效果等也有一定关系[28]。

图5 脂水比对乳化液蛋白吸附量的影响Fig.5 Effect of lipid to water ratio on protein adsorption in emulsion
2.2.3 脂水比对乳液油滴平均粒径与分布的影响
由图6可知,随着脂水比的升高,油滴平均粒径先减小后又有所增加。

图6 脂水比对乳化液油滴平均粒径(a) 及分布(b)的影响Fig.6 Effect of lipid-water ratio on average particle size (a) and distribution (b) of oil droplets in emulsion
脂水比<1∶1时,乳液液滴的平均粒径及分布差别不大,可能是不同油相体积和相应初始蛋白浓度的协同作用恰好使乳化体系达成相似状态。脂水比继续增大至3∶2,均质后分散在水相中的油滴数量增多,且体系相对增加的蛋白浓度能够较快地将它们包裹住,维持乳滴稳定,因此液滴粒径呈减小趋势。当脂水比为2∶1时,乳化液粒径又有所增加,可能是此时乳液黏度过高,蛋白在油水界面的吸附速率变缓而无法及时将油滴包裹,形成部分较大粒径乳滴,从而提高了粒径的均值;还有可能是因为油相体积的增加,使油滴排列过于紧密相互挤压甚至发生形变,使油滴不再是圆形,而变成多边形,如图7红圈所示,此时蛋白膜强度较弱的油滴可能会发生破乳重聚,导致较大粒径油滴出现。刘洋[24]研究发现,乳液中油相体积分数增大到一定程度时,油滴间空隙很小、相互紧连,若有未吸附的界面会很容易发生油滴的聚结。
2.2.4 脂水比对乳液微观结构的影响
由图7可见,脂水比≤1∶1的3组样品乳化液的分散性较高,但存在油滴聚合成大乳滴的现象。而脂水比>1∶1的2组样品乳化液滴呈紧密的堆叠状态。从这2组的微观结构来看,乳化体系的类型在非严格意义上仍属于O/W型,只不过由于作为连续相的水相体积太少,分散相油滴间距离非常紧凑,形成致密的三维类网络结构,这验证了2.2.3的猜测。脂水比为3∶2时,油滴的粒径大小明显比其他组更均匀,这与其粒径分布范围较其他组窄的结果一致。但是,当脂水比高达2∶1时,使油滴数量进一步增加,连续相持续减少,各油滴相互挤压,导致部分油滴变形甚至破乳,形成许多较大的油脂聚集体。

图7 不同脂水比乳化液的微观结构Fig.7 Micro-structure of different lipid-water ratio pre-emulsions
2.3 pH值对乳化液乳化效果的影响
2.3.1 pH值对界面蛋白吸附量的影响
由图8可知,在pH大于酪蛋白酸钠等电点时(pH>5),界面蛋白吸附量随pH值的升高而增加,pH为9时AP%达到最大值,pH为11时蛋白吸附量比pH 9时低1.37%,差异不显著。碱性条件下,蛋白质分子间静电斥力增加,使离散双电层加厚,溶液界面膜增厚,乳化性也得到提高[29]。当pH接近等电点时,蛋白质溶解度最小,体系中能起到乳化作用的可溶性蛋白含量减少[30];另外,也可能是有一部分吸附的蛋白发生变性沉降[31],从油滴表面脱落,造成蛋白吸附量降低。随着pH值进一步降低,此时蛋白质的溶解度又有所增加,体系中可利用的蛋白质含量增多,可通过蛋白质间相互作用重新吸附到界面蛋白膜上,故AP%又有所增加。

图8 pH对乳化液蛋白吸附量的影响Fig.8 Effect of pH on protein adsorption in emulsion
2.3.2 pH对乳液黏度的影响
由图9可知,pH值从3增至11,乳液初始黏度先增加后保持平稳,且各实验组均呈剪切变稀现象,说明乳滴间发生了絮凝[32-33]。剪切速率为1 s-1时,乳化液的pH从酸性升高至中性,其初始表观黏度从50.6 mPa增加至 82.2 mPa,达到最大值;当乳化液体系pH从中性转变为碱性, pH 9、pH 11乳化液初始表观黏度分别为81.2和79.8 mPa,与pH 7差别不大。但随着剪切速率的增加,剪切变稀后pH 9的乳液最终黏度比pH 7的乳液更高,表现出较好的剪切抗性,可能是因为其界面蛋白的强度与弹性较好。在实际应用中,乳化液加入到肉糜中后需要进一步地滚揉、均质、混匀,因此无法避免继续经受剪切作用力。pH 9的乳化液抗剪切能力较其他组好,在实际应用中可能更能发挥保油的作用。pH对乳化液黏度的影响,可能是通过影响体系中蛋白质特性来实现。蛋白质所带净电荷随体系环境pH变化而改变,而其表面净电荷的数量又会影响蛋白质在溶液中的三维结构,进而影响其溶解度[32]。
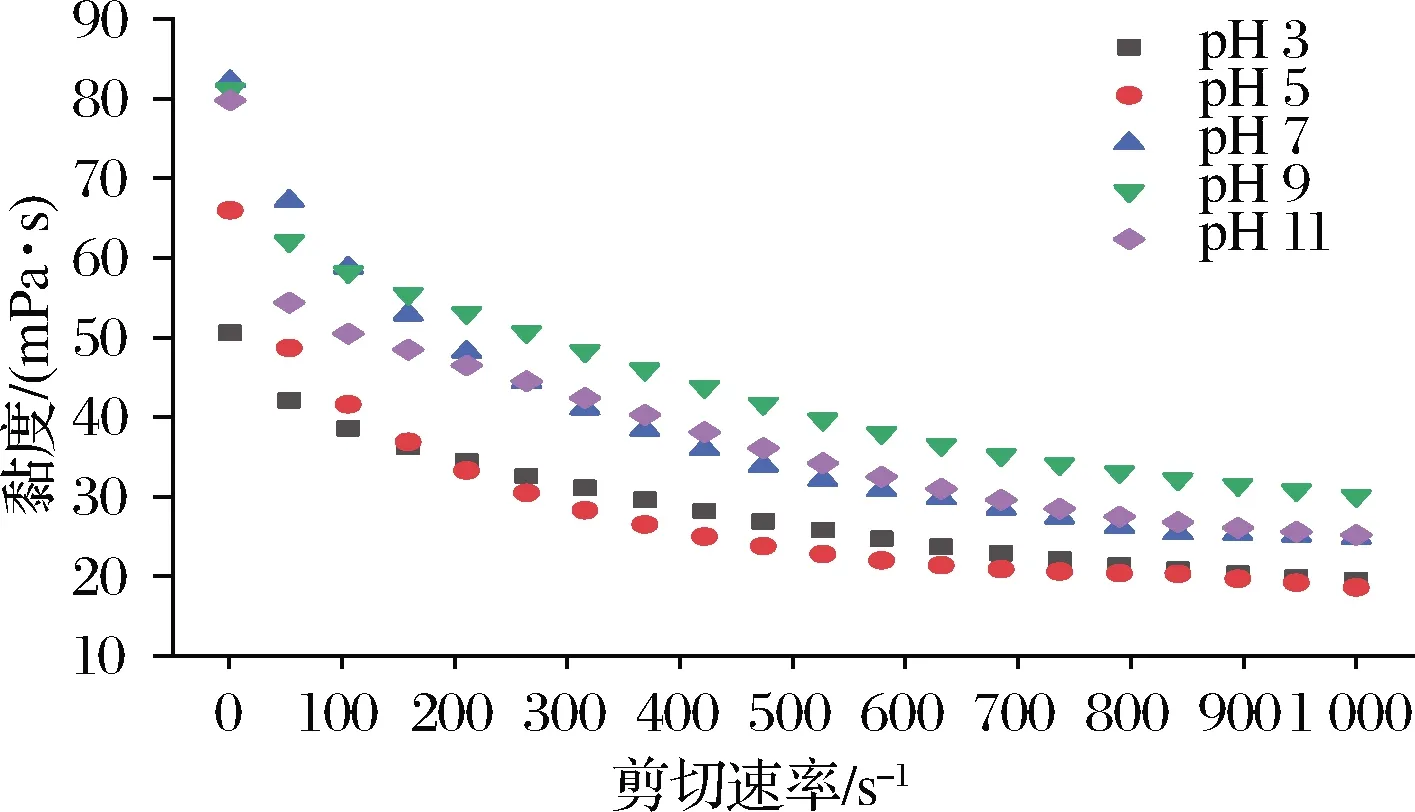
图9 pH对乳化液黏度的影响Fig.9 Effect of pH on viscosity of emulsion
2.3.3 pH对乳化液zeta-电位的影响
zeta-电位广泛用于描述胶体微粒之间的静电相互作用,是表征胶体体系稳定性的重要指标。其表示带电微粒的双电子层中靠近紧密层和扩散层的交界面上的电势,是由微粒表面电荷和周围溶液环境条件共同决定的[34]。其中正负号与电荷数量无关,只表示乳液所带的是正电荷还是负电荷,zeta-电位的绝对值代表乳液所带净电荷数量,一般情况下,该值越大越有利于乳化体系的稳定[31]。
由图10可知,pH 7的中性环境中,由于质子从碱性与酸性功能基上被移除[35],酪蛋白酸钠乳液本身带负电,电位为-20.15 mV。随着pH降低,体系中H+使得蛋白表面净负电荷量减少,且越接近酪蛋白酸钠的等电点(4.5~5.2),蛋白包裹的乳滴表面净电荷越少,zeta-电位越接近于0,乳滴间的静电斥力也相应减小,易发生聚集。当pH进一步下降到酪蛋白酸钠等电点以下后,乳滴表面开始带正净电荷。碱性环境中,随着pH的升高,zeta-电位负值增大,OH-作用加速了蛋白质氨基酸侧链解离,-COO-增多,从而能够产生促进乳状液稳定的静电斥力[35-36]。

图10 pH对乳化液zeta-电位的影响Fig.10 Effect of pH on zeta-potential of emulsion
2.3.4 pH对乳液油滴平均粒径及分布的影响
按理论预期来说,pH 5时接近蛋白质等电点,所制得乳液的油滴粒径应该最大。但图11可见,pH 3时乳化液的平均粒径高达55.76 μm,远超其他几组,说明在pH 3体系中乳滴间发生的聚合现象最为严重。其原因可能是乳液调整pH到3的过程中,经过了蛋白质等电点,且调节pH耗时相对较长,为蛋白质在等电点发生变化影响乳液特性提供了反应时间。当pH处于等电点附近时,蛋白质的溶解度最小,有可能发生变性沉降[31],从而使蛋白膜的强度和黏弹性受到影响,此时乳液zeta-电位值接近于0,乳滴之间几乎不存在静电斥力,受外力作用乳滴间容易发生碰撞而聚结成大油滴,且聚结过程不可逆,不会随着体系pH值继续降低远离等电点而恢复。因此,pH 3组的乳滴平均粒径最大,其粒径分布也说明了乳化液失稳现象严重,将近24%聚合成粒径80 μm以上的油滴。pH 5乳化液平均粒径为45.28 μm,pH 7、pH 9两组乳化液平均粒径都在19 μm左右,pH 11乳化液的平均粒径最小,只有13.19 μm。整体来看,随着pH值的增大,乳化液平均粒径呈减小的趋势,且粒径分布范围也逐渐变窄,油相分散越来越均匀,这与崔珊珊[32]、李超[16]、ZHANG等[37]研究结论一致,说明在非长期放置情况下碱性环境有利于形成乳滴粒径更小、更均一的乳化液。

图11 pH对乳化液油滴平均粒径(a)及分布(b)的影响Fig.11 Effect of pH on average particle size (a) and distribution (b) of oil droplets in emulsion
2.4 NaCl浓度对乳化液乳化效果的影响
2.4.1 NaCl浓度对界面蛋白吸附量的影响
由图12可见,对照组AP%仅为34.56%,而仅将NaCl浓度增加至0.06 mol/L,AP%增加至82.86%,吸附量提高近50%。继续增加NaCl浓度,蛋白吸附量变化不大(P>0.05),但是所有添加NaCl的乳化液其AP%值均显著高于对照组(P<0.05),说明蛋白质利用率大大提高。这可能是因为盐的加入使蛋白质的溶解性提高,体系中发挥作用的蛋白质增多。另外,NaCl的加入使乳液界面吸附蛋白量显著提高,这也验证了2.4.3中对于zeta-电位变化原因的推测。

图12 NaCl浓度对乳化液蛋白吸附量的影响Fig.12 Effect of NaCl concentration on protein adsorption in emulsion
2.4.2 NaCl浓度对乳液黏度的影响
由图13可知,随着离子浓度的不断增加,黏度呈增长趋势,NaCl浓度为0.84 mol/L时乳液黏度最高,从对照组的83.3 mPa增加到125.5 mPa。随着剪切速率的增加,各组呈剪切变稀现象,说明乳液发生了絮凝。当剪切速率增大,絮凝体会发生形变,沿剪切方向排列;当剪切力超过液滴间的聚合力时,聚集体被破坏,发生解聚,体系剪切黏度下降[24]。赵正涛等[38]认为,NaCl的加入一定程度上争夺了蛋白质的水分,使蛋白质浓度间接升高,因此NaCl能显著增加体系的黏度值,与本研究结果一致。另外,盐离子浓度会对蛋白质的溶解性及表面疏水性产生作用,进而影响黏度。添加了Na+的乳化液初始表观黏度虽然比对照组的大得多,但是盐离子会使蛋白质胶体的水化层变薄[32],在剪切过程中,蛋白质更容易出现凝聚现象,因此盐离子浓度越高的乳化液,出现剪切变稀的程度越严重,所以最终各组的黏度差距缩小。

图13 NaCl浓度对乳化液黏度的影响Fig.13 Effect of NaCl concentration on viscosity of emulsion
2.4.3 NaCl浓度对乳液zeta-电位的影响
由图14可知,除对照组,随着NaCl浓度的增加,zeta-电位绝对值逐渐减小,这与叶进富[34]、曹灿[39]等研究结果一致。NaCl浓度为0.06和0.12 mol/L时,乳化液所带净电荷数量高于对照组,原因可能是因为NaCl的加入使界面蛋白膜变得更加致密,蛋白吸附量升高,R基带负电的蛋白增加,而此时低Na+浓度对zeta-电位的影响较弱,因此总体表现为zeta-电位负值增长。但随着NaCl浓度进一步增加,界面蛋白吸附量不再显著变化,带正电的 Na+成为影响zeta-电位的主要因素。由双电层理论可知,带电微粒表面紧密吸附的反离子到达上限后,其他反离子虽然仍继续被微粒吸引,但同时也会受到“紧密层”相同离子的排斥作用,因此只能在紧密层外部,即距离微粒较远处形成扩散层[34]。由此可推测,本研究中NaCl浓度达到0.36 mol/L时,乳滴表面紧密吸附的Na+可能已接近临界值,因此NaCl浓度继续增加后,其对乳液zeta-电位的影响程度相对减小,表现为电位绝对值下降稍显缓慢。

图14 NaCl浓度对乳化液zeta-电位的影响Fig.14 Effect of NaCl concentration on potential of pre-emulsion
2.4.4 NaCl浓度对乳液油滴平均粒径及分布的影响
如图15-a所示,随着NaCl浓度的增加,乳化液平均粒径先减小后增加,在NaCl浓度0.12 mol/L时达到最小值,约为15.36 μm,NaCl浓度为0.06、0.36和0.6 mol/L时,平均粒径相差不大,均在19 μm左右,均小于对照组。这说明在一定范围内,加入NaCl可以降低乳液液滴的平均粒径。结合图15-b, NaCl浓度为0.06~0.6 mol/L时,小粒径的乳滴占比较对照组明显提高,因此乳液整体的平均粒径下降。但NaCl浓度为0.84 mol/L时,乳滴平均粒径上升,并且超过对照组。前文提到,NaCl浓度为0.06和0.12 mol/L时,乳化液所带净电荷数量高于对照组,少量的NaCl使蛋白吸附量升高,R基带负电的蛋白增加,zeta-电位表现为负增长。随着NaCl浓度进一步增加,界面蛋白吸附量不再显著变化,带正电的 Na+成为影响zeta-电位的主要因素。由双电层理论推测,本研究中NaCl浓度达到0.36 mol/L时,该组乳液中粒径在30 μm以上的乳滴占比明显增大,说明小乳滴发生聚合变大,原因可能是此时较多NaCl竞争吸附水分,使蛋白质水化层遭到一定程度地破坏,导致部分乳滴聚合[38]。

图15 NaCl浓度对乳化液平均粒径(a)及分布(b)的影响Fig.15 Effects of NaCl concentration on mean particle size (a) and distribution (b) of emulsion
3 结论
研究发现,大豆油乳化效果与体系条件(蛋白添加量、脂水比、pH、NaCl)密切相关。蛋白添加量的增加使乳液黏度及界面蛋白吸附量均显著提高;液滴平均粒径由60 μm下降至7.28 μm,粒径分布范围变窄,得到更加均一、稳定的乳液。在脂水比1∶2~2∶1范围内,随着脂水比增加,乳液黏度增大;除了脂水比2∶3和1∶1变化不显著外,乳液的界面蛋白吸附量呈上升趋势;在脂水比<1∶1时,乳滴粒径和分布差别不大,随后粒径先减小后又有所增加。乳液pH在3~11范围内,乳液在pH为7、9时黏度较高;pH为3、5时乳滴聚集严重,平均粒径及分布范围较其他组高,在pH为7、9时粒径较小且分布均匀。NaCl可以显著提高乳液黏度和界面蛋白吸附量,NaCl浓度≤0.6 mol/L时,乳液粒径均小于对照组,浓度为0.12 mol/L时达到最小值,在NaCl浓度为0.84 mol/L时,乳滴中出现较大粒径乳滴,NaCl浓度≥0.36 mol/L时,乳液zeta-电位绝对值较对照组小。综上,乳化的适宜条件为:酪蛋白添加量0.5%,脂水比3∶2, pH 7~9, NaCl浓度≤0.6 mol/L。
