浓香型白酒糟醅中酵母Geotrichumsp.的固态发酵特性
2021-01-20游玲谭壹隆清扬陈宏周荣清赵东
游玲,谭壹,隆清扬,陈宏,周荣清,赵东*
1(固态发酵资源利用四川省重点实验室(宜宾学院),四川 宜宾,644000) 2(四川大学 轻工科学与工程学院,四川 成都,610065)
白酒固态自然发酵糟醅中的酵母区系构成明显不同于液态自然发酵,酵母通过影响糟醅中微生物共代谢网络参与白酒风味塑造的途径也更加多样,阐明白酒糟醅中优势酵母的发酵功能是解析白酒发酵机理的关键。研究发现Pichiaanomala、Pichiakudriavzevii、Zygosaccharomycesbailii等与多种香型白酒中风味物质生成有关[1-4]。白地霉(Geotrichumcandidum)作为一种重要的芳香微生物,近年来也在白酒发酵糟醅中检测到[5-7]。尽管关于Geotrichum是否为Dipodascus属仍存在争议[8-9],但这一重要酵母类群在多种香型白酒糟醅中的广泛存在已无争议,但目前对该酵母在白酒糟醅中的发酵特性仍缺乏了解。
本课题组在多粮浓香型白酒发酵40 d糟醅中检测到丰度80%左右的Geotrichumsilvicola,而已有研究表明,多粮浓香型白酒发酵糟醅中后期糟醅的乙醇含量有一次明显的升高[10],且糟醅中并未检测到可产乙醇的细菌[11],推测其可能是在发酵中后期糟醅中起着持续发酵产乙醇的作用。本研究针对分离自多粮浓香型白酒糟醅的2株Geotrichumsp.酵母,研究其在糟醅中的生长特征及主要代谢产物,以初步揭示其在多粮浓香型白酒发酵糟醅中的发酵功能。
1 材料与方法
1.1 实验材料
糟醅:选择正常生产的五粮液生产车间某窖池,采用赵东等[11]取样及DNA提取方法,分别取发酵0、4、12、18、24、30、40、60和68 d的样品各200 g,用于酵母平板计数、菌株分离及DNA提取。
酿酒酵母:“安琪”白酒专用活性干酵母。
1.2 实验方法
1.2.1 两株酵母在原位发酵糟醅中的生长特征
酵母计数:样品经无菌水连续稀释后,分别涂布于添加0.1 g/L氨苄青霉素的WL-琼脂培养基和L-YPD培养基(乳酸调节pH至5.0)。28 ℃培养48 h,选择具有30~100个菌落的L-YPD平板进行酵母计数。
丰度检测:15 g样品与2 g直径为1 mm的无菌玻璃珠和15 mL缓冲液在50 mL离心管中剧烈混合15 min,200 r/min 离心5 min,然后将上清液转移到另一个50 mL离心管中,用无菌水洗涤并沉淀,重复2次。将3次的上清液转移到试管中混合,以14 000 r/min 离心10 min。提取糟醅总DNA,采用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)扩增D1/D2特征序列,将通过琼脂糖凝胶电泳检查合格的PCR产物送至美吉测序公司(上海)测序。将获得的所有OTU与酵母模式菌株的相应序列进行比对,计算与2株酵母分类单位相同的OTU序列数量占总序列数量的比例(即该分类单位的丰度),再乘以糟醅酵母总数得到该分类单位的酵母数量,以此绘制该分类单位酵母在发酵糟醅中的生长曲线。
1.2.2 菌株分离鉴定
分离:根据高通量测序结果,选择发酵12 d及发酵40 d的糟醅,采用WL及L-YPD培养基分离酵母菌株,挑取2种培养基上的纯培养菌株,经3次纯化后,将纯培养菌株接种至L-YPD琼脂培养基上28 ℃培养48 h,4 ℃保藏备用。
形态观察:将活化的酵母菌株接种到YPD培养基平板上,在28 ℃培养箱中培养2 d,观察酵母菌在培养基上的菌落形态,同时制备酵母菌装片,在400倍下观察细胞形态。
生理生化鉴定:以葡萄糖、山梨醇、木糖、甘露醇、肌醇、蔗糖、鼠糖、麦芽糖、阿拉伯糖、乳糖、半乳糖、棉子糖为YNB培养基中的唯一碳源培养酵母,观察其生长情况,评价其对糖的同化能力;将酵母菌接种到尿素培养基上,培养24 h,根据培养基是否变红色评价酵母利用尿素的能力。
序列鉴定:挑取新鲜菌落至1.5 mL EP管,按照E.Z.N.A Yeast DNA试剂盒的步骤提取纯酵母菌株的DNA,随即按照1.2.1小节中方法扩增其26S rDNA序列,扩增产物送至派森诺公司(上海)测序,获得的序列提交至GenBank进行BLASTN(www.ncbi.nlm.nih.gov/BLAST)比对。
1.2.3 温度、乙醇、pH对酵母生长的影响
菌株活化:用乳酸调节YPD培养基pH为5.0,挑取平板菌落接种,28 ℃下100 r/min振荡培养24 h。
温度对酵母生长的影响:5 mL菌悬液转接到pH 为5.0(乳酸调节)的YPD培养基中,分别在20、24、28、32、36、40 ℃下以100 r/min振荡培养36 h,测OD560值。
乙醇对酵母生长的影响:5 mL菌悬液转接到乙醇体积分数分别为1%、2%、3%、4%、5%、6%、7%、8%的YPD培养基(乳酸调节pH至5.0)中,28 ℃、100 r/min振荡培养36 h,测OD560。
pH对酵母生长的影响:5 mL菌悬液转接到pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0的YPD培养基(乳酸调节pH)中,28 ℃、100 r/min培养36 h,测OD560。
1.2.4 模拟发酵实验
固态发酵:以多次煮沸清洗并灭菌的糠壳基质作为固态载体,吸附按生产工艺配比的五粮粉,添加不同强度的关键生长胁迫因子,调节水分含量至55%,灭菌后接种由0.5%的根霉菌剂干粉制备的液体菌剂,分装到已灭菌的2 kg容量的呼吸袋,分别接种在乳酸YPD培养基中活化24 h的2株酵母菌株,25 ℃发酵20 d,期间于0、4、8、12、16、20 d分别取样检测糟醅理化指标及酵母菌数量,发酵起始及结束时取样检测糟醅中风味物质含量。
液态发酵:在固态发酵糟醅中同时添加2倍体积的无菌水,装入2.5 L广口瓶发酵,其余步骤同上。
1.2.5 糟醅成分分析
取100 g糟醅或发酵液,加入200 mL蒸馏水,常压蒸馏,收集馏出液至100 mL,采用气相色谱法(配FID检测器)测定糟醅蒸馏液中的乙醇及主要风味物质含量[12]。
按照国标[13]第一法——直接滴定法测定糟醅中还原糖含量;采用pH计测定糟醅pH;糟醅酸度、淀粉及水分含量测定方法根据《白酒理化分析检测》[14]。
1.2.6 数据处理
采用SPSS 19.0软件进行显著性分析。
2 结果与分析
2.1 Geotrichum sp.酵母在原位发酵糟醅中的生长特征
由图1可知,Geotrichumsp.酵母主要活跃在浓香型白酒4~60 d的发酵糟醅中,在发酵12、40 d时各有一个数量高峰期,在浓香型白酒发酵旺盛期(12 d前后)数量达到105CFU/g,可能参与乙醇的生成,但此时该酵母在群体中的丰度很低,推测Geotrichumsp.不是主发酵期间产乙醇的主要种属。在发酵24~40 d内该酵母数量维持在104CFU/g以上,特别是在发酵40 d的浓香型白酒糟醅中,此时其他种属酵母大幅减少,Geotrichumsp.酵母在酵母群体中的丰度达到70%以上,但此时糟醅中乙醇含量上升已不明显[15],表明Geotrichumsp.酵母并未在这一阶段增加乙醇的生成。发酵中后期该酵母在酵母群体中的丰度迅速增加,推测其对缺氧环境更加耐受,但此时其绝对数量已低至103CFU/g以上,与这一时期大量增殖的细菌群体相比完全不占优势,很难在这样复杂的微生物共代谢体系中准确辨析Geotrichum酵母的作用,因此需分离纯培养菌株研究其发酵特性。
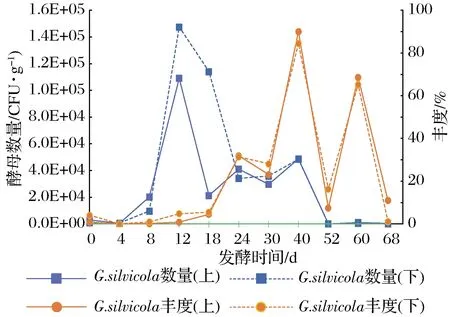
图1 Geotrichum sp.酵母在原位发酵糟醅中的丰度 及数量变化趋势Fig.1 Trend of relative abundance and quantity of Geotrichum sp.in fermented grains
2.2 Geotrichum sp.酵母的分离鉴定
根据Geotrichumsp.酵母在糟醅中的生长特征,采用2种培养基分别在窖池发酵12 d及发酵40 d的糟醅中各分离到1株Geotrichumsp.酵母,其26S rDNA部分序列与模式菌株对应序列相似性大于99%,且与高通量测序方法检测到的仅有的2个OTU完全吻合,分别编号为LB0-2、WA5-4。
通过NCBI检索,发现这2株酵母的26S rDNA部分序列分别与G.silvicola、Geeotrichumcandidum(同G.candidum)、G.bryndzae、G.geotrichum标准菌株对应序列的相似性均高于99%,仅通过26S rDNA序列比对无法将其准确鉴定到种,系统发育分析也证实了这一点(图2)。

图2 两株Geotrichum sp.酵母基于26S rDNA序列的 系统发育分析图Fig.2 Phylogenetic analysis of 26S rDNA sequence of two Geotrichum sp.strains 注:邻接点法,自展数1 000
从菌落形态特征来看,2株酵母的菌落及细胞形态略有差异(图3),WA5-4酵母在L-YPD琼脂培养基上28 ℃培养2 d,形成米白色、辐射状、边缘绒毛状的湿润微凸菌落,容易挑取,略带烘焙香气;LB0-2在同样条件下培养,形成白色、绒毛状的湿润平铺菌落,容易挑取,有典型酵母香气。但2株酵母在乳酸YPD及WL固体及液体培养基中培养2~10 d均未见假菌丝形成,糖利用实验表明,2株酵母均可同化葡萄糖、山梨醇、木糖、甘露醇,不能同化肌醇、蔗糖、鼠糖、麦芽糖、阿拉伯糖、水杨素、乳糖、半乳糖、棉子糖,能够利用尿素,类似于地霉属[16-17],因此暂将其鉴定为Geotrichumsp.。
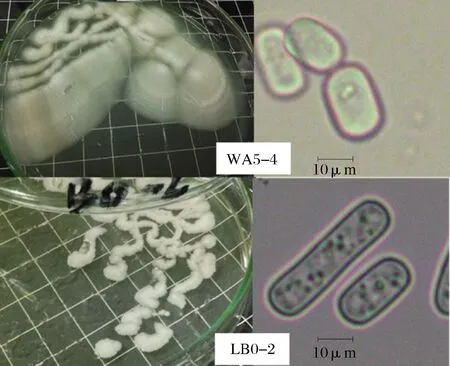
图3 Geotrichum sp.酵母的菌落及细胞形态Fig.3 Colonies and cells of two Geotrichum sp.strains 注:L-YPD培养基,28 ℃培养3 d
2.3 两株Geotrichum sp.酵母菌株的生长特征
在L-YPD液体培养基中,Geotrichumsp.酵母菌株的生长特征见图4。2株酵母接种至pH 5.0的液体培养基中,28 ℃培养4 h后即进入对数生长期,其中LB0-2菌株在培养10 h时数量达到最高,WA5-4菌株增殖较为缓慢,在培养18 h才达到最大值,表明WA5-4菌株的增殖能力似乎不如LB0-2菌株。
在乳酸YPD培养基中测试糟醅中主要生长胁迫因子对2株酵母生长的影响,发现2株酵母对温度、低pH、乙醇的耐受性也存在一定差异。浓香型白酒发酵糟醅的温度从窖池边角处的20 ℃左右到窖池中心点逐渐升高,极端情况下可能升高至50 ℃,在本研究条件下,2株酵母的最适生长温度均为28 ℃,但LB0-2菌株对高温的耐受性更好,在40 ℃时仍有明显生长,可能更耐受糟醅发酵过程中的高温;浓香型白酒糟醅中的最高乙醇体积分数为6 mL/100 g左右,液态培养基中,2株酵母均可耐受4%乙醇,且LB0-2菌株在乙醇体积分数达到8%时仍生长良好,WA5-4菌株乙醇体积分数达到6%时也有明显生长,表明乙醇体积分数达到8%(白酒糟醅中的最高乙醇含量为6 mL/100 g左右)时仍生长良好,表明糟醅中的乙醇不是这2株酵母的主要生长限制因子;浓香型白酒糟醅中的pH为3.0~3.5左右,液体培养基中,2株酵母在pH 4.0时均生长良好,随着pH下降到3.0时,WA5-4菌株的生长明显受到抑制,但LB0-2菌株受影响较小,在pH 3.0时仍有明显生长。
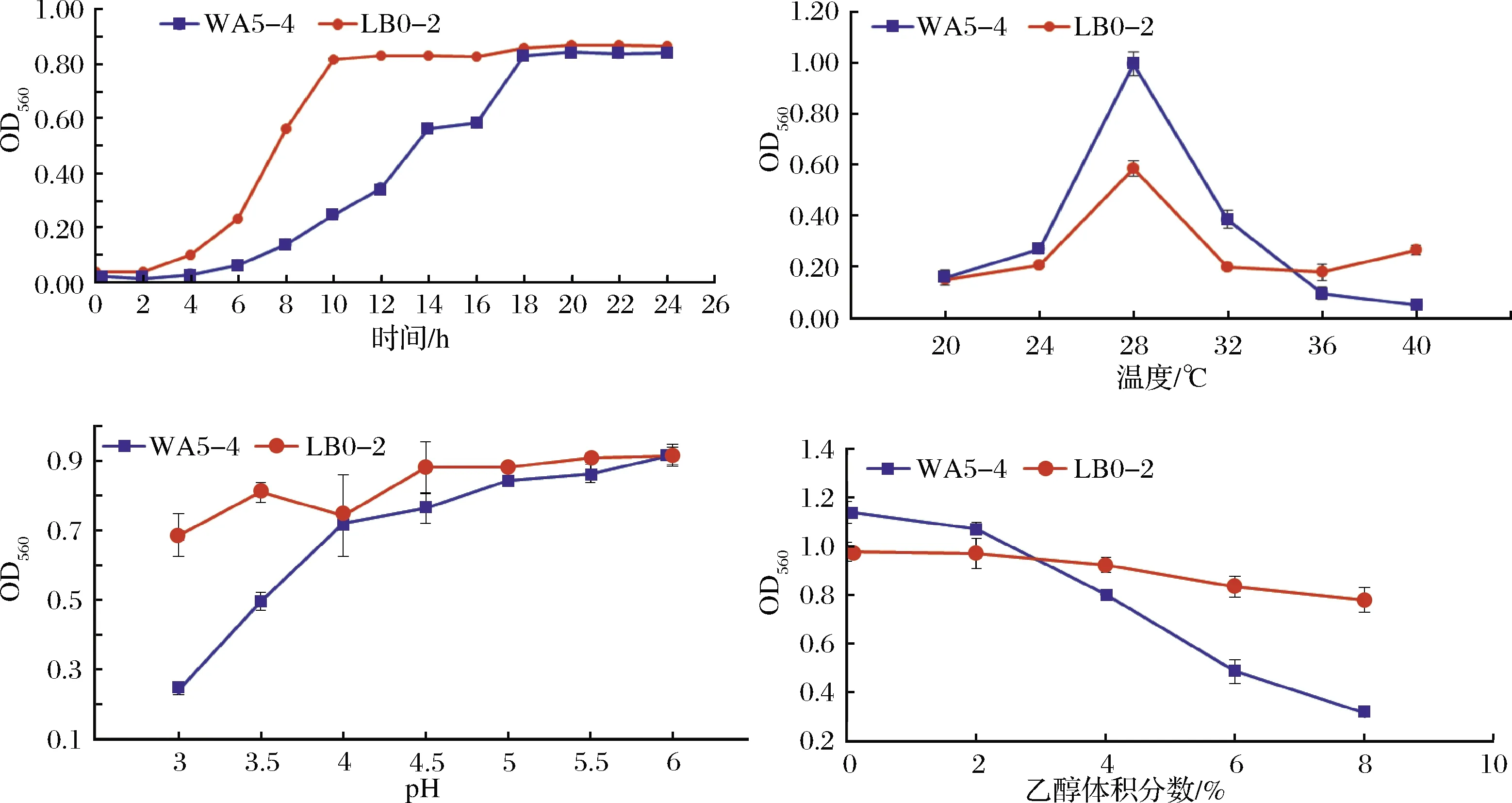
图4 两株Geotrichum sp.酵母菌株的生长特征Fig.4 Growth characteristics of two Geotrichum sp. strains
2.4 两株酵母在固态发酵糟醅中的产乙醇特征
图5显示2株酵母及酿酒酵母接种至模拟糟醅发酵过程中糟醅中淀粉的转化情况,接种WA5-4、LB0-2及酿酒酵母的糟醅中淀粉分别消耗了22%、16%和13%,发酵结束时糟醅中的还原糖含量分别为1.4%、4.3%和3.7%,因此WA5-4、LB0-2及酿酒酵母实际分别消耗糟醅中的淀粉20.6%、11.7%和9.3%,可见同等条件下,2株Geotrichumsp.酵母可发酵糟醅中更多淀粉,特别是WA5-4,其利用淀粉的量甚至超过酿酒酵母的2倍,但从乙醇生成情况来看,2株Geotrichumsp.酵母都没有产生比酿酒酵母更多的乙醇,推测其消耗相同的碳源生成了更多的发酵副产物。

图5 2株Geotrichum sp.酵母对糟醅中淀粉及还原糖转化的影响Fig.5 Effects of two Geotrichum sp.strains on the transformation of starch and reducing sugar in fermented grains
如图6所示,WA5-4、LB0-2及酿酒酵母在浓香型白酒糟醅中发酵24 d时的乙醇产量分别为7.91、6.71和7.03 mL/100 g,其中WA5-4菌株显著高于其他2株酵母,并且,考虑在发酵16 d时糟醅中的乙醇含量因酯化等原因有不同程度的下降(图8),其实际乙醇产量可能更高。从产乙醇速率来看,酿酒酵母启动发酵更快,在发酵4 d时其乙醇产量已达5.40 mL/100 g,占其最终产量的77%,随后增长较缓慢,而2株Geotrichumsp.酵母体现出明显的长时间持续发酵特征,特别是WA5-4菌株,在发酵20 d后仍能持续产生乙醇,这在发酵周期长达70 d的浓香型白酒发酵过程中可能更具实际意义。
同时,分别比较2株酵母在固液态糟醅中的乙醇产量,发现LB0-2、WA5-4菌株在固态发酵糟醅中的乙醇产量(6.63、5.31 mL/100 g)均显著高于其分别在液态发酵糟醅的产量(3.09、1.48 mL/100 g),方差也显著小于液态发酵糟醅,表明这2株酵母在固态发酵糟醅中产乙醇更多更稳定,且WA5-4在固态或液态发酵糟醅中产乙醇量均显著高于LB0-2。
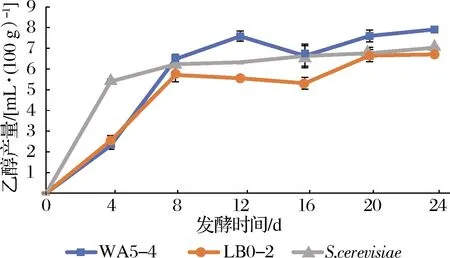
图6 两株Geotrichum sp.酵母在固态发酵糟醅 中的产乙醇特征Fig.6 Ethanol producing of Geotrichum sp.strains in solid state fermentation grains
2.5 Geotrichum sp.酵母对糟醅水分及酸度的影响
糟醅水分变化在一定程度上反应了微生物代谢旺盛程度,由图7可知,接种WA5-4菌株的糟醅发酵过程中水分含量增加更多,特别是在发酵第4~8 d内增加尤为迅速,8~24 d期间也在持续缓慢增加,且一直高于LB0-2及酿酒酵母,观察也可发现呼吸袋内壁凝结的水雾更密集,表明该酵母在糟醅中的代谢更加旺盛。
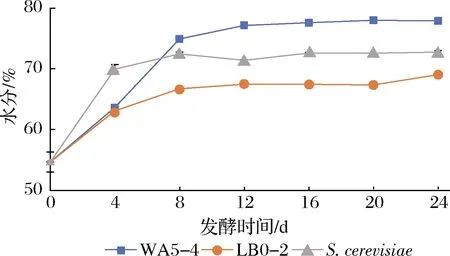
图7 两株Geotrichum sp.酵母对糟醅水分的影响Fig.7 Effect of two Geotrichum sp.strains on water content of fermented grains
图8可知,2株Geotrichumsp.酵母菌株的产酸能力有很大差异。WA5-4菌株产酸较酿酒酵母晚,但其在发酵4~8 d期间及整个发酵阶段的产酸量均显著高于其他2株酵母,LB0-2在0~16 d期间的产酸量与酿酒酵母没有显著差异,但其最终产酸量显著低于酿酒酵母,可能是由于发酵后期因酯化等有所损失。从糟醅pH变化来看,接种酿酒酵母的糟醅pH显著低于接种2株Geotrichumsp.酵母的糟醅,这可能是由于酿酒酵母所产有机酸更容易电离出H+,而2株Geotrichumsp.酵母产有机酸的种类较多,反而有利于维持糟醅pH平衡,这在一定程度上更有利于维持固态发酵糟醅的酸环境。
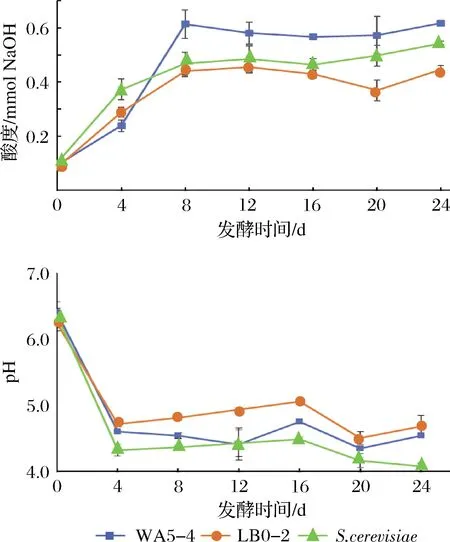
图8 两株Geotrichum sp.酵母对糟醅pH及酸度的影响Fig.8 Effect of two Geotrichum sp.strains on pH and acidity of fermented grains
2.6 Geotrichum sp.酵母固液态发酵产风味物质情况
如表1所示,2株Geotrichumsp.酵母在固液态糟醅中主要产13种风味物质,其中,WA5-4菌株在固态糟醅中的风味物质总产量达2.7 g/kg,其中产量超过100 mg/kg的物质包括乙酸乙酯、异丁醇、乙酸异戊酯、β-苯乙醇。LB0-2在固态糟醅中的风味物质总产量甚至高达4.4 g/kg,其产量超过100 mg/kg的物质包括乙酸乙酯、乙酸异戊酯、β-苯乙醇。因此推测Geotrichumsp.酵母在浓香型白酒发酵过程中的主要贡献是产乙酸乙酯、乙酸异戊酯、β-苯乙醇,且乙酸乙酯是浓香型白酒中重要的风味物质,主要呈花果香,这2株菌在糟醅中的乙酸乙酯产量分别为1.5、3.0 g/kg,同样且呈花果香且风味阈值较低的乙酸异戊酯产量也高达216、573 mg/kg,呈玫瑰花香的β-苯乙醇产量分别为658、477 mg/kg,因此,Geotrichumsp.酵母可能有助于强化浓香型白酒的花果香气。
值得注意的是,WA5-4菌株、LB0-2菌株在固态发酵糟醅中的风味物质总产量均显著高于液态发酵糟醅,分别为液态发酵糟醅的91倍及340倍,其中WA5-4菌株在固态发酵糟醅中的乙醛、乙酸乙酯、异丁醇、异戊醇、乙酸异戊酯、糠醇、β-苯乙醇产量显著高于液态发酵糟醅,LB0-2菌株在固态发酵糟醅中的乙醛、乙酸乙酯、异丁醇、正丁醇、乙酸、异戊醇、乙酸异戊酯、正己醇、糠醇、β-苯乙醇产量显著高于液态发酵糟醅,体现出Geotrichumsp.酵母对固态发酵糟醅的特殊适应性。
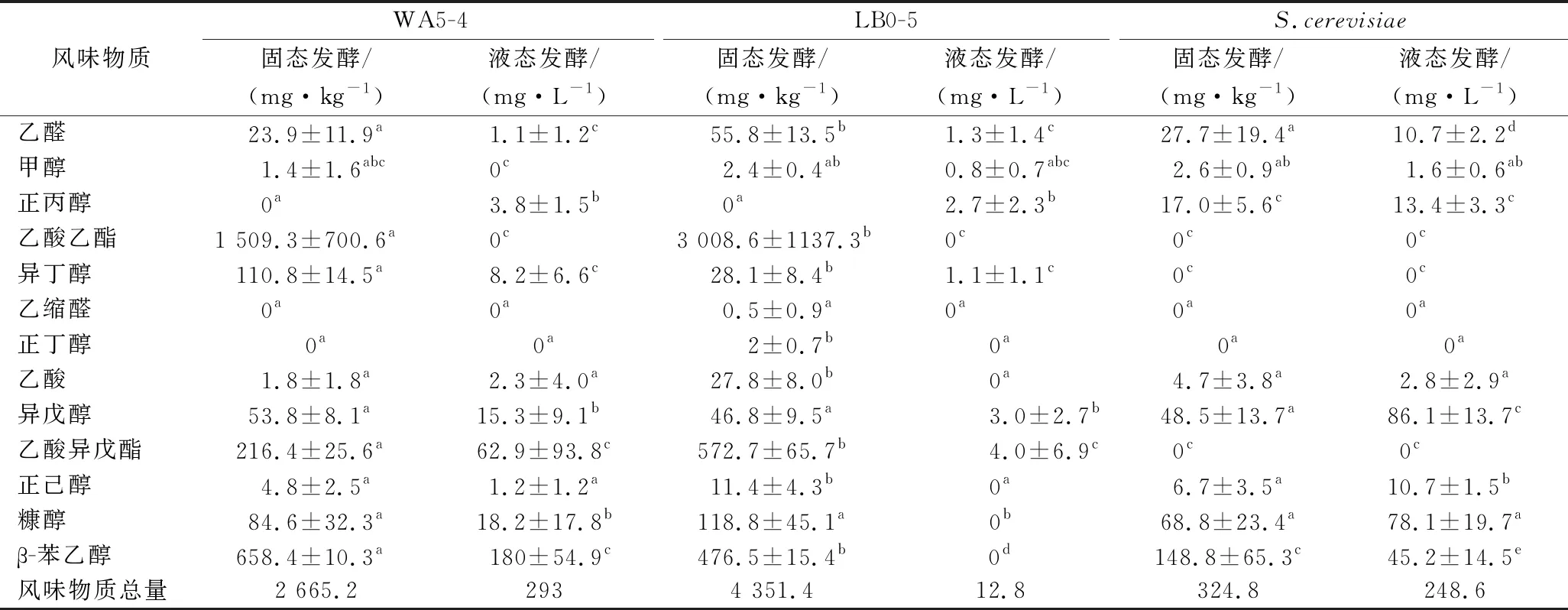
表1 两株酵母在固态及液态发酵糟醅中的主要挥发性产物Table 1 Volatile products of two yeast strains in fermented grains of solid and liquid fermentation
3 讨论
Geotrichum属的典型特征是形成假菌丝,本研究涉及的2株酵母仅与本属内4个种的26S rDNA序列相似性大于99%,与其他真菌或酵母的序列相似性均低于98%,但在多种培养基中培养均未形成菌丝,怀疑是该属内的1个新种,有待进一步研究。
从发酵功能来看,Geotrichum属的多个种与水果香风味特征联系紧密,如高产酯类物质及苯乙醇的Galactomycesgeotrichum(G.candidum)[18-19],高产乙酸乙酯的G.penicillatum[20],部分菌株还可通过降解葡萄酒中的高级醇生成酯类物质改善葡萄酒风味的[21],但总体上关于Geotrichum属发酵产乙醇的报道较少,本研究发现Geotrichumsp.酵母对浓香型白酒固态发酵糟醅适应良好,在固态发酵糟醅中可通过高产乙酸乙酯、乙酸异戊酯、β-苯乙醇强化浓香型白酒的花果香气,可长时间持续发酵,具有开发为新型白酒商业酵母的潜力。
