榨菜发酵过程中原核微生物群落结构及其理化因子的动态演替
2021-01-20吴晓红高生平蒋彩云王清政
吴晓红,高生平,蒋彩云,王清政
1(江苏经贸职业技术学院,江苏 南京,211168) 2(南京工业大学 浦江学院,江苏 南京,211134)
榨菜是我国主要的腌制加工蔬菜,是世界三大酱腌菜之一,通常作为配菜或开胃菜。榨菜的传统制作工艺用盐量高,抑制了高品质的乳酸菌活性,同时对产品的风味、营养及安全性等品质产生诸多不良影响[1-2]。而低盐腌制榨菜不仅可以改善榨菜的品质、安全性及营养价值,同时也符合当今世界蔬菜腌制向营养、天然和绿色方向发展的趋势[3]。
近年来,分子生物学免培养技术被广泛用于研究传统酿造食品的微生物群落组成。LIANG等[4]采用高通量测序技术发现乳酸菌是榨菜发酵过程中最为重要的微生物之一,呈先迅速增加后维持稳定的变化趋势,且在前期以明串珠菌属(Leuconostoc)和魏斯氏菌属(Weissella)为主,中期以乳杆菌属(Lactobacillus)为主,而后期则以乳杆菌属和片球菌属(Pediococcus)为主。此外,张锐等[5]利用单链构象多态性技术发现肠膜明串珠菌(Leuconostocmesenteroides)为榨菜发酵初期的优势茵种,随着发酵环境条件的变化,乳杆菌属为榨菜发酵中后期的优势茵群。乳酸菌可能来源于发酵原料和自然环境,其可将原料中的小分子糖类物质转化为酸类化合物,从而赋予榨菜柔和的酸感;部分糖类物质可被转化为醇类化合物,这些醇类物质和酸类代谢物反应形成酯类物质,进而赋予产品具有酯香和醇香的特征[6]。乳酸菌通过蛋白水解系统将发酵基质中的可溶性蛋白分解成短肽和氨基酸等小分子代谢产物,从而赋予产品独特的鲜味特征[7]。目前,很多乳酸菌,如肠膜明串珠菌、短乳杆菌和植物乳杆菌,已被用作发酵剂,以加快榨菜的发酵过程,提高产品品质[8-10]。
本研究采用16S rRNA高通量测序技术全面解析榨菜发酵过程中原核微生物群落的演替规律,并基于冗余分析探究影响微生物菌群变化的理化因素,以期揭示榨菜发酵过程不同时期原核微生物群落形成原因。
1 材料与方法
1.1 材料与试剂
样品:取四川省某调味品有限公司2个不同发酵池发酵1、7、14、21、35、50、65和80 d的榨菜发酵液,将每个发酵池的发酵液分为2份,于-20 ℃下贮藏,1份用于理化指标分析,1份用于DNA提取。
试剂:NaOH、酚酞、邻苯二甲酸氢钾、盐酸萘乙二胺等(分析纯),国药集团化学试剂有限公司;乳酸、丙酮酸、柠檬酸、苹果酸、乙酸、酒石酸、琥珀酸、草酸等(色谱纯),上海阿拉丁生化科技股份有限公司;E.Z.N.A.®水样DNA 提取试剂盒,美国Omega公司。
1.2 仪器与设备
紫外可见分光光度计(UV BlueStar A),北京莱伯泰科仪器股份有限公司;pH计(PB-10),德国Sartorius公司;高速冷冻离心机(TGL-20M),上海卢湘仪离心机仪器有限公司;高效液相色谱仪(1260),美国Agilent公司。
1.3 实验方法
1.3.1 理化性质分析
用pH计测定酸菜发酵液样品的pH;使用滴定法测定总酸含量[11];采用菲林试剂滴定法测定还原糖含量[12];采用盐酸萘乙二胺法测定亚硝酸盐含量[13]。
采用高效液相色谱仪检测有机酸含量。取适量酸菜发酵液,加入等体积的硫酸锌和亚铁氰化钾,摇匀,10 000 r/min离心20 min,保留上清液过0.45 μm水系滤膜后待用。色谱条件:进样量10 μL;流动相为0.02 mol/L的NaH2PO4溶液;柱流速 0.7 mL/min;检测波长210 nm;柱温30 ℃[14]。
1.3.2 DNA提取与Illumina高通量测序
使用DNA 提取试剂盒对发酵液样品进行总DNA提取。使用Qubit 2.0荧光定量仪测定其溶度和纯度。将合格的DNA委托南京诺唯赞生物科技有限公司完成建库及Illumina Miseq 双端测序。其中16S rDNA扩增子引物对为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),扩增区域为16S rDNA扩增子的V3~V4区。
1.3.3 测序数据处理与统计学分析
采用FLASH软件[15]对测序的原始数据进行拼接,利用QIIME软件[16]对低质量的拼接序列进行过滤,使用UCHIME软件[17]去除嵌合体,得到优质序列。根据UCLUST软件[18]在相似性97%的水平上对优质序列进行聚类,得到各可操作分类单元(operational taxonomic unit, OTU),以各OTU中丰度最高的序列作为代表序列。在80%置信水平下,通过Silva 132数据库[19]对OTU进行分类学注释,将蓝藻门和不能注释到门水平的OTU删除。基于OTU得到分析结果,采用随机抽平的方法,利用QIIME软件[16]对样品进行多样性分析。基于OTU的主坐标分析、样本聚类分析、Venn图绘制、热图绘制、冗余分析均通过R软件实现。
2 结果与讨论
2.1 榨菜发酵过程中理化因子变化
如图1所示,随着发酵的启动,榨菜发酵液的pH值在发酵1~35 d内迅速降低,从pH 6.31下降至pH 3.78;此后,pH值随发酵时间的延长而缓慢下降,于发酵80 d稳定在pH 3.61,其结果与杜书等[7]研究结果相似。此外,总酸含量则与pH值的变化呈相反的趋势,在整个发酵过程中持续上升,于发酵65 d达到稳定,其含量为10.81 g/L。酸性环境不仅会影响不耐酸的微生物生长繁殖,还可促进部分抗酸微生物的繁殖,导致总酸含量持续增加,赋予榨菜具有柔和的酸味[6]。
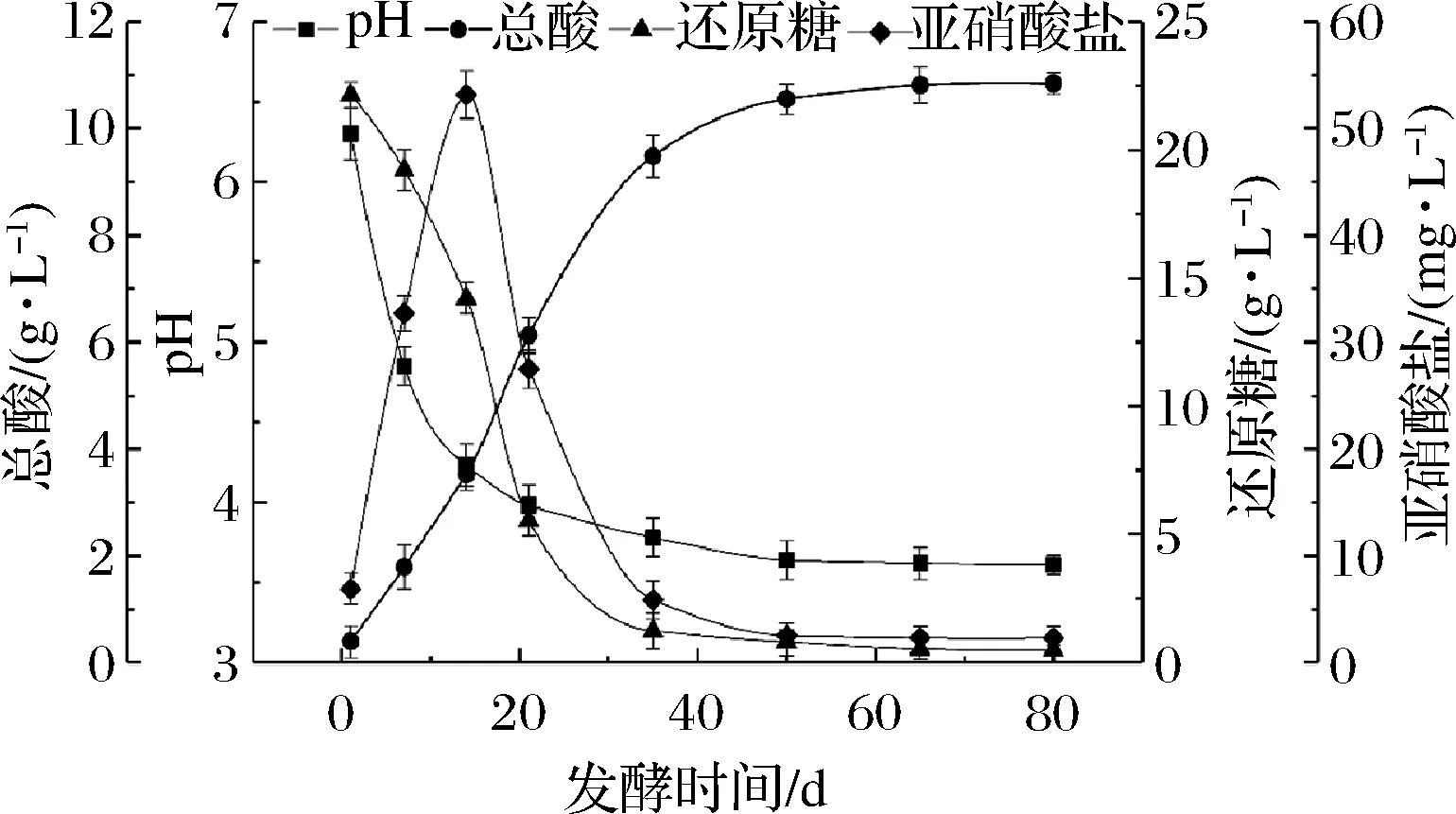
图1 榨菜发酵过程中pH、总酸含量、还原糖含量及 亚硝酸盐含量的动态变化Fig.1 Dynamic changes of pH and the contents of total acid, reducing sugar and nitrite during the fermentation of Zhacai
还原糖是微生物生长繁殖主要的能源物质之一,而榨菜发酵是将原料中的还原糖生成醇、酸和酯等风味物质的过程。由图1可知,还原糖含量的变化趋势与pH值的变化相一致,在整个发酵过程中持续下降。发酵1~35 d,还原糖含量快速降低;随后还原糖含量随发酵的持续进行而缓慢降低,于发酵65 d达到稳定,维持在0.5 g/L左右。说明较高的还原糖含量可使微生物大量繁殖,将还原糖转化为酸、醇和酯等风味物质[20]。发酵原料及发酵器具中含有的肠杆菌科、假单胞菌属和黄杆菌属等革兰氏阴性菌会分泌硝酸还原酶,可将植物体内的硝酸盐转变为亚硝酸盐[21]。榨菜发酵液中亚硝酸盐含量在整个发酵过程中呈先升后降的趋势,于发酵14 d达到最大值,为53.16 mg/L,50~80 d达到稳定,含量维持在2.31~2.53 mg/L,远低于国标规定泡菜中的亚硝酸盐含量为20 mg/kg的限量标准[22]。
有机酸不仅是榨菜发酵主要的呈味物质,也是指示发酵进程的一个重要指标。由图2可知,在榨菜发酵过程中检测到8种有机酸,分别为草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸和丙酮酸,并监测其在整个发酵过程中的动态变化。在发酵1 d时,草酸、乙酸、柠檬酸、琥珀酸和丙酮酸是主要的有机酸,占整个有机酸的97%,但随着发酵的不断进行,除丙酮酸外其他 4种有机酸的含量均在逐渐增加,在发酵80 d时可分别达到0.88、0.73、1.31和0.26 g/L。此外,乳酸、苹果酸和酒石酸的含量在整个发酵过程也呈增加的趋势,分别从0.006、0.01和0.001 g/L增加至7.25、1.17和0.25 g/L,其中乳酸含量的变化最显著,增加了12 082倍之多。在发酵80 d时,乳酸含量占整个有机酸比例的60.79%,说明乳酸是影响榨菜口感的主要有机酸,且具有酸味柔和、浓厚等特征。
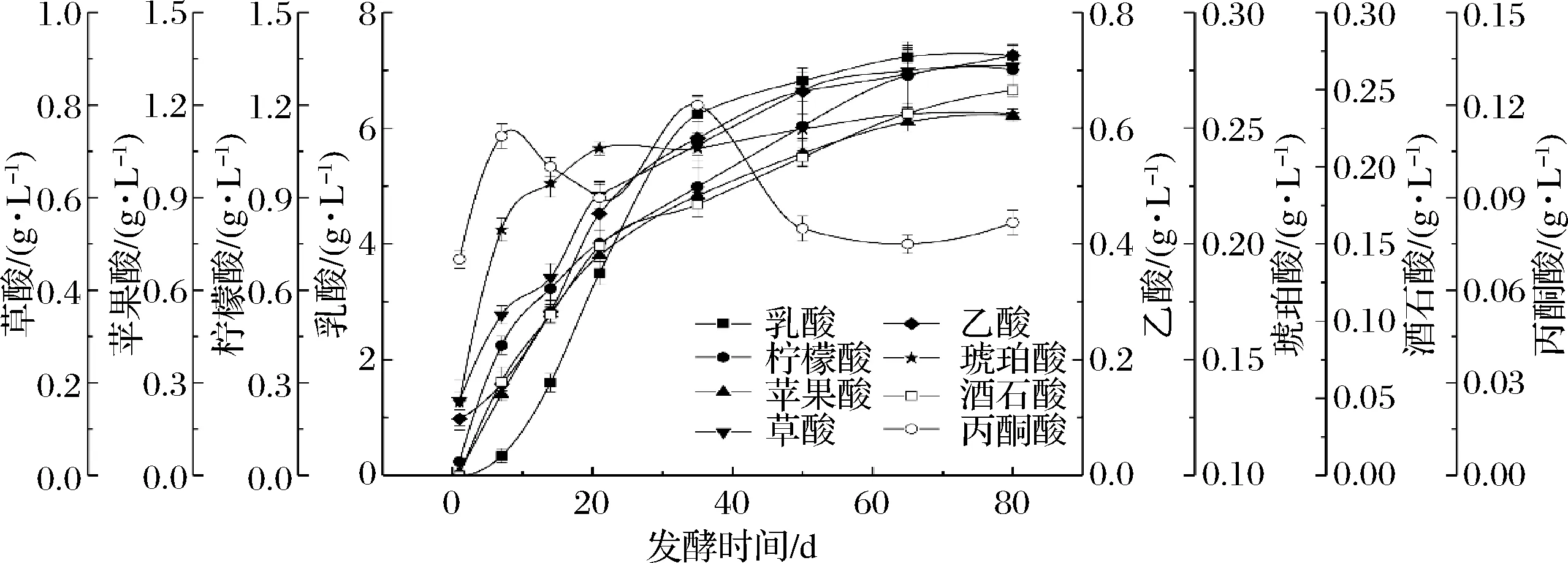
图2 榨菜发酵过程中有机酸含量的动态变化Fig.2 Dynamic changes of organic acid contents during the fermentation of Zhacai
2.2 榨菜发酵过程中原核微生物群落α多样性分析
如图3所示,当测序深度超过10 000条时,稀释曲线进入平台期。由于本研究测序深度(≥33 798条)远大于10 000条且覆盖率均超过97%(表1),说明本次测序深度足够覆盖整个榨菜发酵的群落,从而获得绝大多数微生物信息。
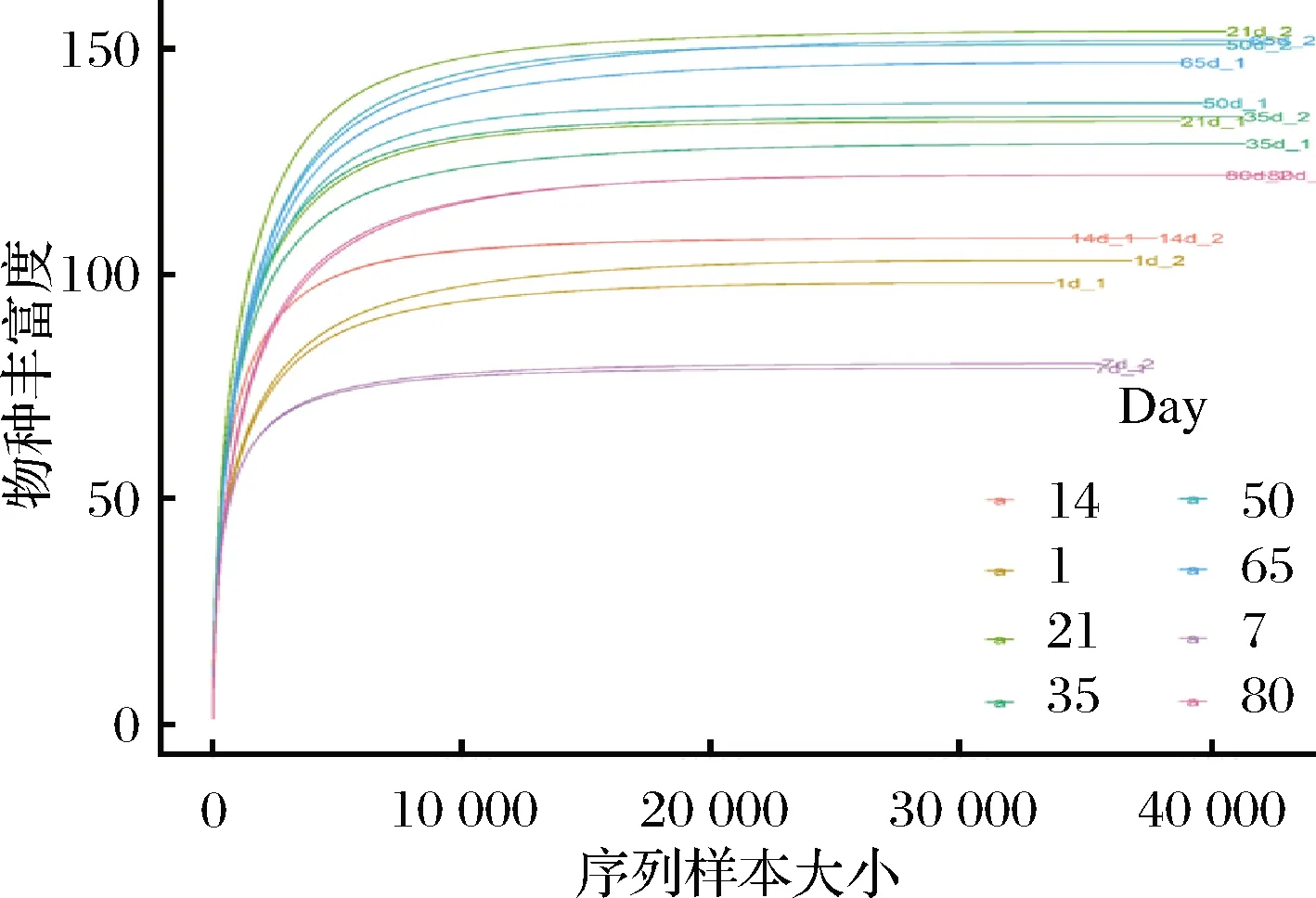
图3 基于榨菜微生物群落OTUs 观察的稀释曲线Fig.3 Rarefaction curves of Zhacai microbial communities based on observed OTUs 注:不同颜色的曲线代表不同的发酵时间;同一颜色的曲线分别代表 两个不同发酵池的样品,_1代表发酵池1,_2代表发酵池2(下同)
由表1可知,利用Illumina Miseq高通量测序技术可得到620 685条优质序列,平均33 798~42 358条/样本。根据样本的最低序列数对所有样本进行抽平,并进行后续分析。通过OTU聚类(97%相似度)后可得到364个OTU,OTU平均91~151个/样本。Shannon指数、Simpson指数和Pielou指数是评价群落多样性、丰富度和均匀度的常用指数。在整个发酵过程中,样品中原核微生物群落的Shannon指数、Simpson指数和Pielou指数均呈先增后降的变化趋势,且都在发酵14 d时达到最大,分别为3.04、0.92和0.65,说明该发酵时间的群落多样性和均匀度最高。上述结果说明发酵原料、器具及环境中的原核微生物可快速适应低盐和低酸的发酵环境,从而迅速生长繁殖,抢占有利生态位。随着发酵的不断进行,发酵环境逐渐酸化,pH不断减低,样品中原核微生物群落的Shannon指数、Simpson指数和Pielou指数均逐渐下降。
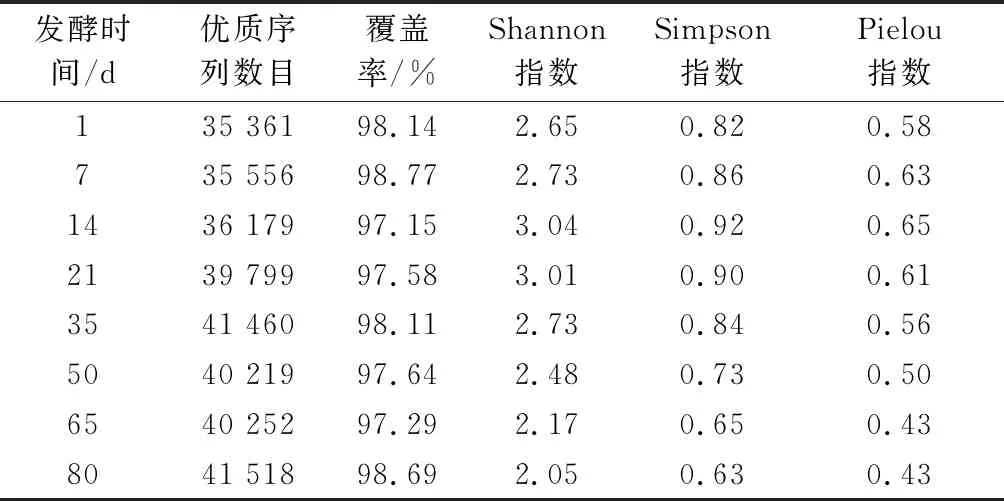
表1 榨菜发酵过程中原核微生物群落序列 数量和α多样性参数Table 1 Sequence numbers and α-diversity indices of prokaryotic microbial communities during the fermentation of Zhacai
这种现象主要是与榨菜发酵环境有关,由于pH和总酸是影响酿造原核微生物群落α多样性(Shannon指数、Simpson指数和Pielou指数)的主要因素,pH和总酸会显著影响微生物群落结构,从而改变群落α多样性[23]。说明酸性环境会抑制大部分微生物的生长繁殖,但不会影响某些耐酸微生物的生长繁殖,这些耐酸微生物在群落中的比例逐渐增大,从而造成微生物多样性和均匀度的下降。本研究中的榨菜发酵液的pH从6.31下降至3.61、总酸从0.4 g/L增加至10.81 g/L,这可能是导致不同发酵时间原核微生物群落α多样性差异的主要原因。
2.3 榨菜发酵过程中原核微生物群落β多样性分析
基于OTU组成对16个榨菜发酵液样品进行层次聚类分析。如图4所示,这些榨菜发酵液样品被划为2个簇,发酵1~7 d的样品单独聚为1簇(Ⅰ),其他发酵时间的样品聚为另一簇(Ⅱ);第Ⅱ簇又可以分为两个亚簇,发酵14~35 d的样品聚在第ⅰ亚簇,发酵50~80 d的样品聚在第ⅱ亚簇,故可将整个榨菜发酵分为3个不同的阶段,分别为发酵前期、发酵中期和发酵后期。上述结果表明不同发酵时间的发酵液样品中原核微生物群落呈现出显著的时间异质性。这可能是由于发酵环境逐渐酸化(图1),LIU等[24]研究结果表明总酸会显著影响泡菜发酵过程中微生物群落结构。此外,还发现2个不同发酵池的原核微生物群落变化具有一致性,说明榨菜发酵具备较强的批次稳定性。只有稳定的微生物群落变化才能造就产品口感、品质及功能的稳定。因此,进一步解析不同发酵时间的榨菜发酵液样品中原核微生物群落组成有助于深入揭示榨菜微生物群落时间异质性的形成原因。
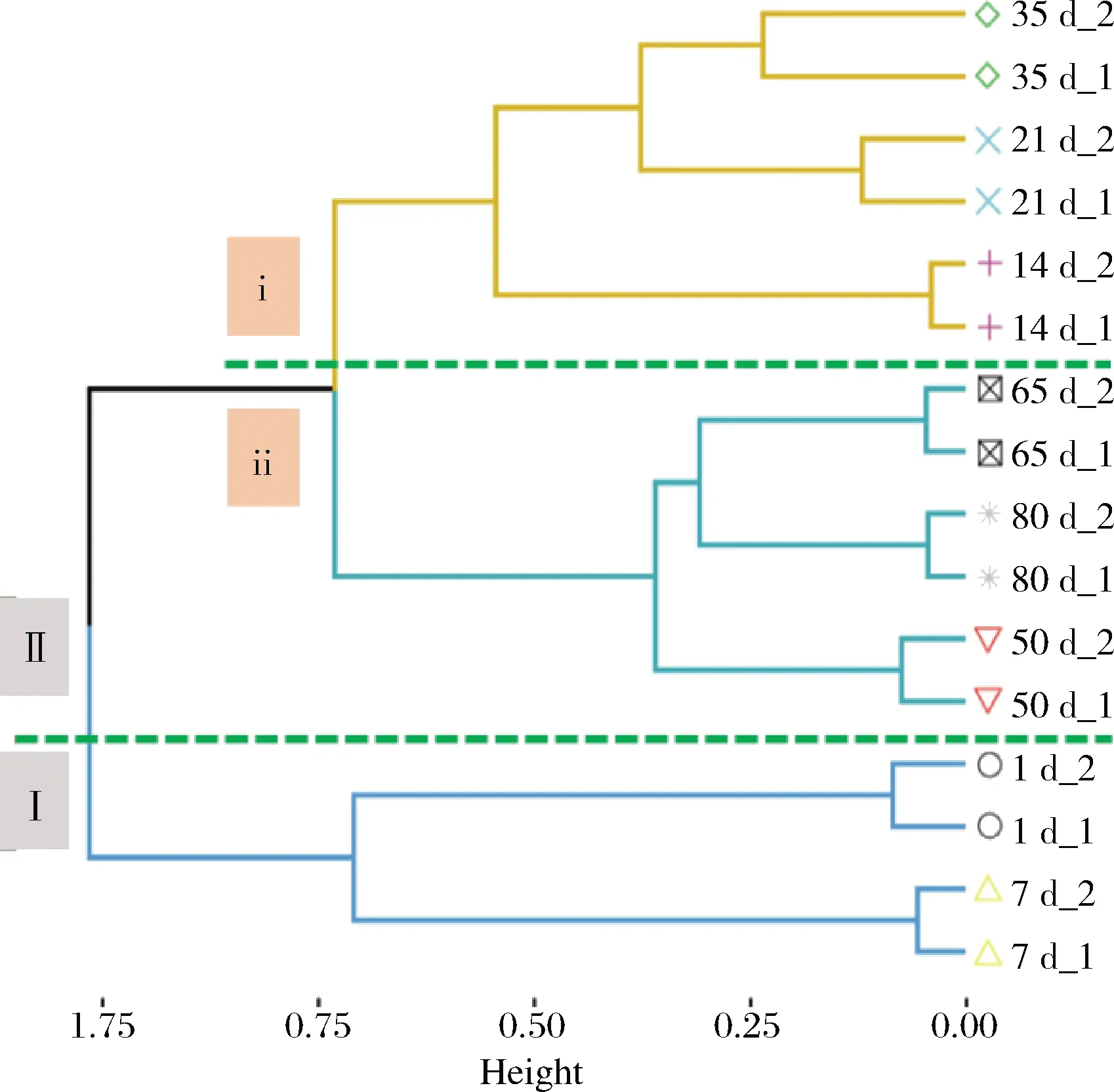
图4 榨菜发酵过程中不同发酵时间样品的层次聚类Fig.4 Hierarchical clustering of samples with different fermentation time during the fermentation of Zhacai
2.4 榨菜发酵过程中原核微生物群落结构和演替分析
线经OTU注释,所有样品中共检测到12个可鉴定门。如图5所示,4个优势菌门(至少在2个样品中相对丰度 > 1%的门),占每个样品总相对丰度的99%以上。在整个发酵过程中,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)的平均相对丰度持续降低,分别从74.49%和4.33%降低至6.01%和0.37%;而厚壁菌门(Firmicutes)的平均相对丰度持续升高,从15.59%升高至92.77%。结果说明厚壁菌门主导了榨菜发酵的成熟。
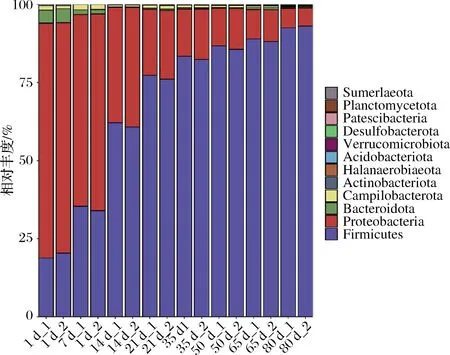
图5 榨菜发酵过程中原核微生物群落在门水平的演替Fig.5 Succession of prokaryotic microbial communities in samples at phylum level during the fermentation of Zhacai
所有样品中共检测到134个属,其中发酵7 d的样品属水平微生物数量最少(28个),发酵50 d的样品属水平微生物数量最多(77个)。柱状图进一步展示了19个优势属在榨菜发酵过程中的动态变化。由图6可知,柠檬酸杆菌属(Citrobacter)、Cobetia、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、鞘氨醇杆菌属(Sphingobacterium)和魏斯氏菌属(Weissella)主要在发酵1 d样品中富集,随着发酵的不断进行,这些微生物的平均相对丰度逐渐降低。其中假单胞菌属在发酵1 d的平均相对丰度可达39%之高,而肠杆菌属的平均相对丰度为1%左右,说明假单胞菌属和肠杆菌属存在于新鲜蔬菜和发酵器具中,生存能力强,适应环境范围广[25]。正是由于这些具有硝酸还原酶的革兰氏阴性菌存在,导致榨菜发酵前期亚硝酸盐含量增加。此外,明串珠菌属(Leuconostoc)在发酵1 d的平均相对丰度可达3.61%,其在整个发酵过程中呈先增后降的变化趋势,与张锐等[5]研究结果相一致,说明明串珠菌属是附着在新鲜榨菜上的主要乳酸菌。在低盐的环境下,榨菜表面渗出的汁液非常适合明串珠菌属的生长繁殖,其产生的CO2和酸使pH迅速下降,从而阻止其他有害微生物的生长繁殖[5]。同时,明串珠菌属可将多余的糖转化为甘露醇和葡聚糖,而这2种物质非常适合乳酸菌的发酵[26]。明串珠菌属的生长繁殖可迅速改变发酵环境,更适宜其他乳酸菌按一定的顺序生长,从而起到发酵启动剂的作用[5]。不动杆菌属(Acinetobacter)、乳球菌属(Lactococcus)、嗜冷杆菌属(Psychrobacter)、盐弧菌属(Salinivibrio)和弧菌属(Vibrio)的平均相对丰度的变化趋势和明串珠菌属的变化相一致。其中乳球菌属在发酵35 d的平均相对丰度最高,可达21.43%,说明乳球菌属可在该发酵环境中迅速生长繁殖,占领足够多的生态位,且可与明串珠菌属互利共生。此外,芽孢杆菌属(Bacillus)、盐单胞菌属(Halomonas)、乳杆菌属(Lactobacillus)、Oceanobacillus、片球菌属(Pediococcus)和四联球菌属(Tetragenococcus)的平均相对丰度在整个发酵过程中持续增加,尤其是乳杆菌属的平均相对丰度从0.92%增加至74.77%,说明乳杆菌属对榨菜发酵起着主导作用,且这些微生物均可以和乳杆菌属互利共生。盐单胞菌属和片球菌属具有耐盐的特性,能分解葡萄糖,产生多种风味物质,推测具存在与生产泡菜“盐渍”这一步骤有关[27]。四联球菌属广泛存在与含盐的腌制类发酵食品中,可参与氨基酸的合成及生成醛、醇、酮和酯等挥发性风味物质,从而提升发酵食品的风味和口感[28]。
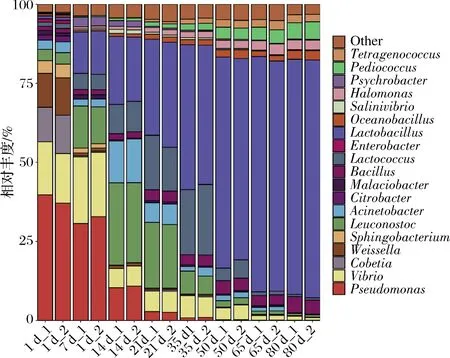
图6 榨菜发酵过程中原核微生物群落在属水平的演替Fig.6 Succession of prokaryotic microbial communities in samples at genus level during the fermentation of Zhacai
由图7可知,整个发酵过程中共有的OTU数为78个,但随着发酵的不断进行,不同发酵阶段之间的共有微生物和特有微生物的数量逐渐增加,彰显榨菜发酵过程中微生物群落结构的复杂性和特殊性。上述结果说明有些微生物只能在特定的环境下才能激活其生长繁殖,而在其他环境下处于休眠的状态。
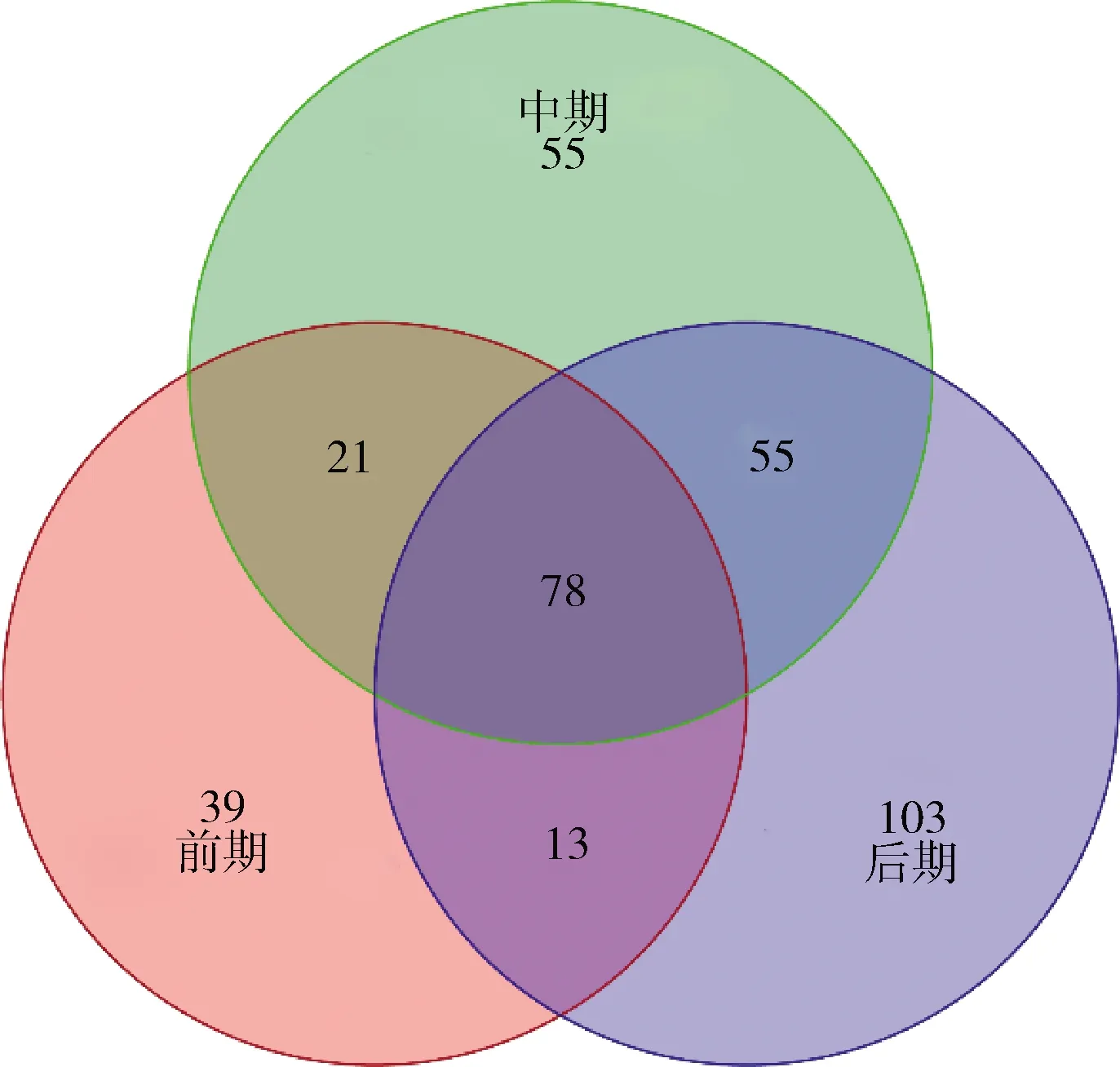
图7 榨菜发酵过程中不同发酵阶段的原核微生物群 落在OTU水平的Venn图Fig.7 Venn diagram of prokaryotic microbial communities in samples of different fermentation stages at OTU level during the fermentation of Zhacai
2.5 榨菜发酵过程中不同发酵阶段标志性微生物分析
线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)是一种用于发现和解释高维度数据生物标识的分析工具,用于发现不同生物条件或环境下的多组样本中最能解释组间差异的物种特征,以及这些特征对组间差异的影响程度。因此,使用LEfSe分析鉴定出不同发酵阶段的标志性微生物。由图8可知,发酵前期的样品中标志性微生物有5个,分别来自鞘氨醇杆菌属、魏斯氏菌属、Cobetia、弧菌属和假单胞菌属;发酵中期的样品中标志性微生物也有5个,分别来自气微菌属(Aeromicrobium)、上地杆菌属(Pedobacter)、明串珠菌属、乳球菌属和不动杆菌属;而发酵后期的样品中标志性微生物同样也有5个,分别来自芽孢杆菌属、四联球菌属、乳杆菌属、片球菌属和盐单胞菌属。这些标志性微生物的鉴定结果与图6中的变化规律一致。
2.6 榨菜发酵过程中理化因子与原核微生物群落的冗余分析
根据冗余分析可将19个优势属大致分为3个类群(图9-a阴影区域),每个类群对应不同发酵阶段的榨菜发酵液样品(图9-b)。结合图6和图8发现每个类群在其对应发酵阶段中的相对丰度最高,如图9-a中蓝色阴影区域的8个属的相对丰度在发酵前期最高;黄色阴影区域的5个属的相对丰度则在发酵中期最高;紫色阴影区域的6个属的相对丰度则在发酵后期最高。榨菜发酵过程中理化因子对优势属菌群结构的总解释贡献度为91.23%(图9),其中RDA1轴的贡献度为72.67%,可将发酵前期和发酵后期这2个阶段的样品较好的区分开;RDA2轴的贡献度为18.56%,可将发酵中期与其他两个阶段的样品较好的区分开。根据图9-b可知,多个理化因子共同影响榨菜发酵过程中原核微生物的群落结构,如发酵前期的微生物群落与pH和还原糖呈正相关,与总酸和其它有机酸呈负相关;发酵中期的微生物群落与亚硝酸盐、丙酮酸和琥珀酸呈正相关;而发酵后期的微生物群落与总酸和大部分有机酸呈正相关。
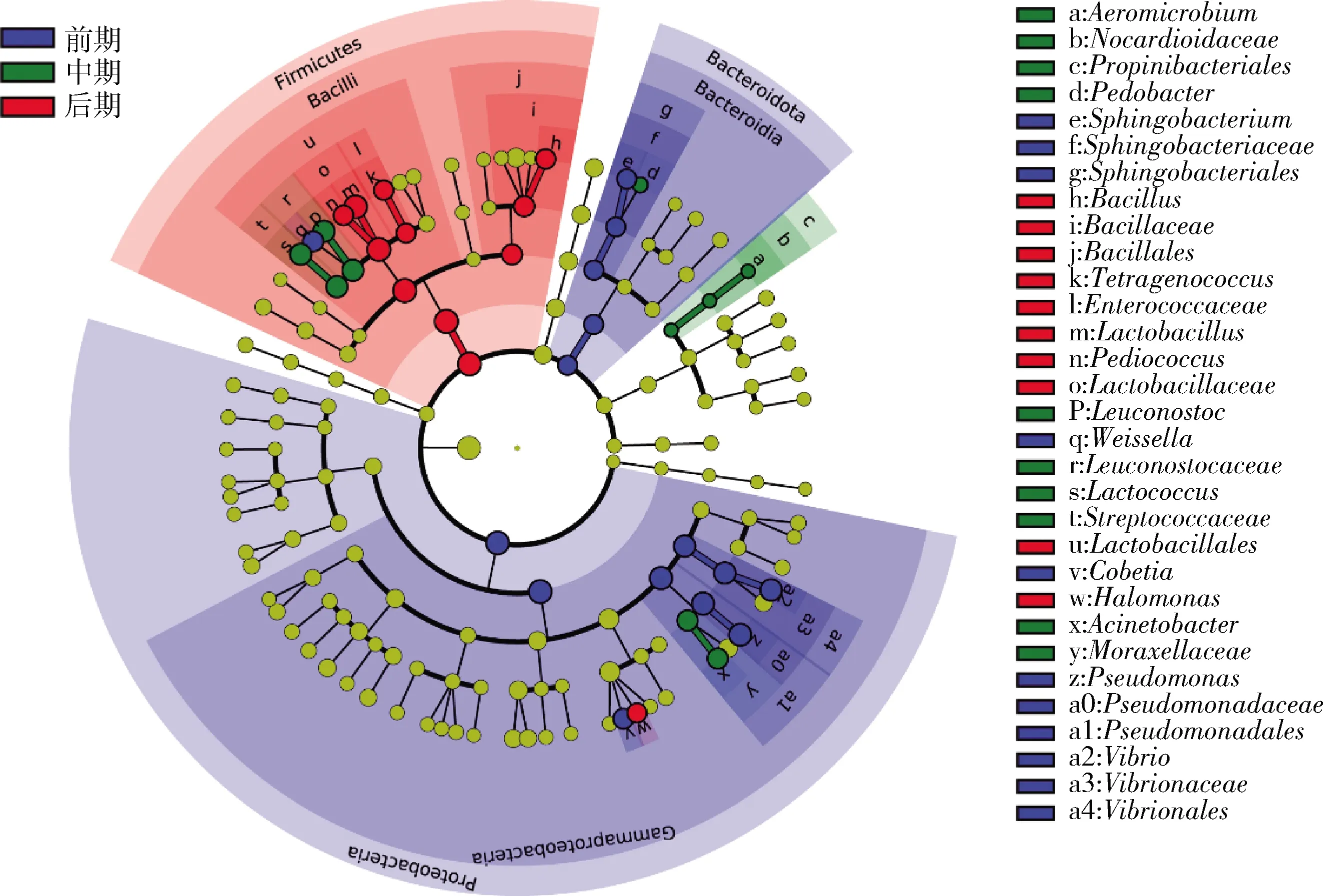
图8 榨菜发酵过程中不同发酵阶段生物标志性微生物的分析Fig.8 Analysis of biomarker microorganism in different fermentation stage during the fermentation of Zhacai
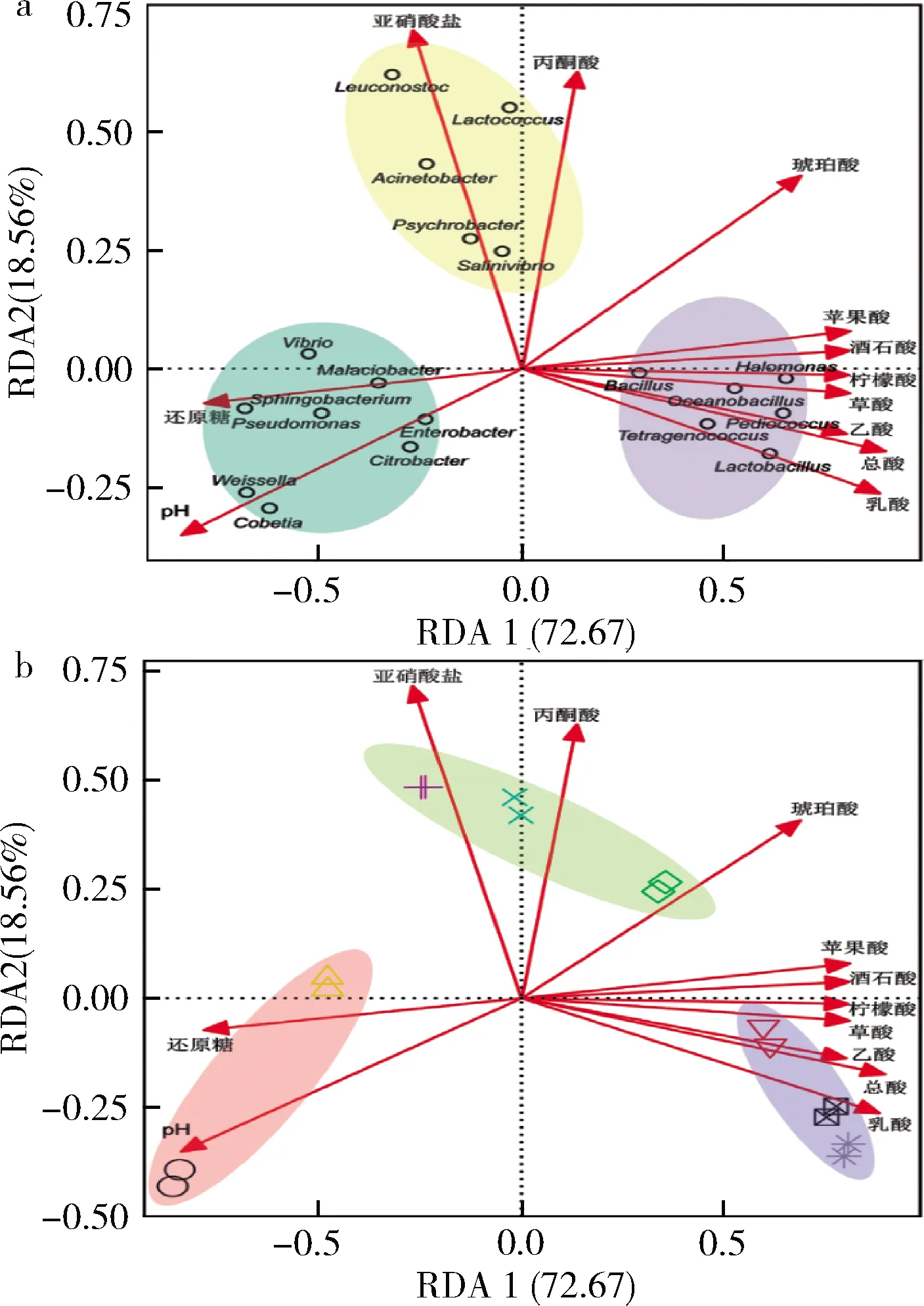
图9 酸菜发酵过程中理化因子分别与优势属及 样品的RDA关系图Fig.9 Redundancy analysis between physicochemical factors and dominant genera and samples during the fermentation of Zhacai 注:a-不同颜色的阴影区域代表不同的类群;b-不同颜色的 阴影区域代表不同的发酵阶段,与图7和图8的颜色标识相一致; 不同类型的符合代表不同发酵时间的样品,与图4中的标识相一致
利用条件限制分析揭示每个理化因子对榨菜发酵过程中原核微生物群落结构的影响程度,其中乳酸(9.55%)和pH(9.33%)对菌群的影响较大,其他理化因子均都在6%以上,说明多个理化因子共同决定榨菜发酵微生物群落的变化。此外,相关研究表明乳酸和乙酸与中国辣白菜的微生物群落进行呈显著正相关[24]。综上,榨菜发酵过程中原核微生物群落受多种理化因子的共同影响,这些理化因子共同驱动了群落结构的稳定,从而保证榨菜的品质和口感。
3 结论
本研究利用16S rRNA高通量测序技术揭示榨菜发酵过程中原核微生物群落的组成和演替规律,同时分析发酵过程中理化因子的变化。随发酵的不断进行,pH和还原糖含量下降,总酸含量上升,而亚硝酸盐含量呈先增后减的变化趋势。乳酸是其主要的有机酸,占总有机酸的60%之多。原核微生物群落的多样性和均匀性均呈先增后降的变化趋势。根据微生物群落的信息,可将发酵过程分为3个不同的阶段,且每个阶段的标志性微生物均不同。乳杆菌属是发酵过程中处于绝对优势微生物,其相对丰度从0.92%增加至74.77%。此外,冗余分析表明:发酵初期的群落与pH及还原糖含量呈正相关;发酵中期的群落与亚硝酸盐、丙酮酸和琥珀酸含量呈正相关;而发酵后期的群落与总酸和其他有机酸含量呈正相关。本研究为进一步精确人工调控提供理论依据和筛选特性菌种提供了参考。
