金属与盐溶液的反应
2021-01-18张芸
张芸
金属与盐溶液的反应是中考题中常见类型,也是中考压轴题之一,本文就这类题有关题型及解题方法进行归纳和总结。
一、金属与盐溶液的反应条件及有关注意点:
金属与盐溶液的反应条件:在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们盐溶液里置换出来。金属的活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
有关注意点:1.金属钾钙钠太活泼,在盐溶液中一般先和水反应生成碱,很难和盐发生反应。
2.铁在置换反应中通常只生成正二价的铁溶液(即亚铁盐)。
如:Fe + CuSO4== FeSO4+ CuFe + CuCl2== FeCl2+ Cu
3.金属只有在盐溶液里才能反应,如铁和固体的硫酸铜很难反应。
4.盐要能溶于水且已溶于水中,难溶性盐(如AgCl)不具有此性质。
口诀:金属前换后,盐必须可溶:钾钙钠例外,铁换亚铁盐。
二、金属与盐溶液反应的有关题型及解题方法
(一)判断两种或多种金属活动性的强弱。
1.检验未知的金属活动性强弱的方法:可把未知金属丝打磨后放入某盐溶液中,根据反应现象来判断金属活动性的强弱。如把相同粗细的金属丝X,Y打磨后分别插入硫酸铜溶液中。Y表面有红色国体生成,X表面无明显现象。则X Y Cu的金属活动性强弱顺序为Y>Cu>X
2.检验已知的三种金属活动性强弱的方法:先把几种金属按活动性由强到弱排序,再选用其两边的金属和中间的盐溶液反应;或选用其两边的盐溶液和中间的金属反应。如,怎样检验金属Al Fe Cu的活动性强弱?可分别将打磨后的Al丝 Cu丝插入FeSO4溶液中,也可将打磨后的Fe丝分别插入硫酸铝和硫酸铜的溶液中,根据反应现象来判断。
(二)一种金属和一种盐的溶液的反应,虽然只有一个反应,但反应结果分三种情况,可按金属的质量由少到多进行分析。如:将一定量的铁粉加到硫酸铜溶液中充分反应,反应后的滤液和滤渣分三种情况讨论:
①Fe粉较少,硫酸铜未完全反应,滤液中就有硫酸铜和生成的硫酸亚铁,滤渣只有铜;
②Fe和硫酸铜都恰好完全反应,滤液中就只有硫酸亚铁,滤渣只有铜;
③Fe粉过量,滤液中就只有硫酸亚铁,滤渣有铜和铁。
若反应后向滤渣中加稀盐酸有气体生成,则为上述第③种情况;若无气体生成,则为上述第①、②种情况:滤液中一定有硫酸亚铁,可能有CuSO4,滤渣中只有Cu。
(三)一种金属和二种盐的溶液的反应:
判断反应先后顺序的方法:金属和盐中金属在金属活动性顺序里的位置相差越远越先反应。
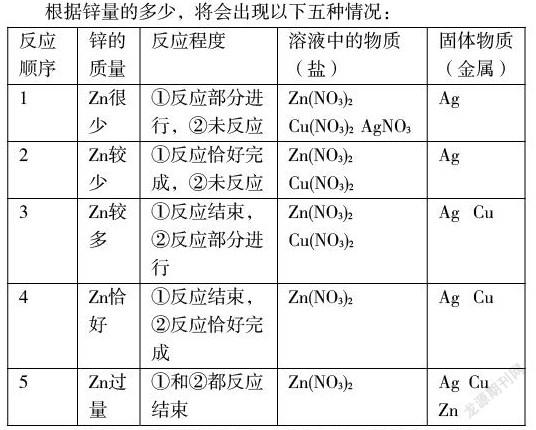
如将锌加到硝酸铜和硝酸银的混合液中,锌和硝酸银先反应,只有当硝酸银反应完了还有多余的锌才能和硝酸铜反应。即:第一个反应:① Zn +2AgNO3== Zn(NO3)2+2Ag ;,
第二个反应:② Zn + Cu(NO3)2===Zn(NO3)2+ Cu
根据锌量的多少,将会出现以下五种情况:
1.反应结果根据滤液分析:若反应后向滤液中加稀盐酸有沉淀生成,则为上述第1种情况;若无沉淀生成,则为上述第2,3,4,5种情况;滤液中一定有Zn(NO3)2可能有Cu(NO3)2。一定没有AgNO3,滤渣中一定有Ag,可能有Cu和Zn
若反应后滤液为蓝色,则为第1,2,3种情况,滤液中一定有Zn(NO3)2和Cu(NO3)2。可能AgNO3,滤渣中一定有Ag,可能有Cu,一定没有Zn。若反应后滤液为无色,则为第4或第5种情况,滤液中只有Zn(NO3)2,滤渣中一定有Ag和Cu,可能Zn。
2.反应结果根据滤渣分析:若反应后向滤渣中加稀盐酸有气体生成,则为上述第5种情况;若无气体生成,则为上述第1,2,3,4种情况:滤液中一定有Zn(NO3)2,可能Cu(NO3)2和AgNO3,滤渣中一定有Ag,可能有Cu,一定没有Zn。
(四)二种金属和一种盐的溶液的反应
判断反应先后顺序的方法:两种金属中较活波的金属先与盐溶液反应
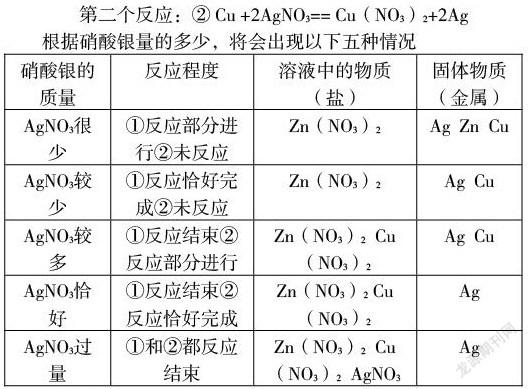
如将锌和铜的粉末状混合物加到硝酸银的溶液中,锌和硝酸银先反应,只有当锌反应完了还有多余的硝酸银才能和铜反应。即:第一个反应:① Zn +2AgNO3== Zn(NO3)2+2Ag
第二个反应:② Cu +2AgNO3== Cu(NO3)2+2Ag
根据硝酸银量的多少,将会出现以下五种情况
学生练习:
1.(2021.黄石模拟)现有Al,Cu,Ag三种金属丝,限用一种试剂一次性就可以验证它们的金属活动性强弱,则该试剂是()
A.CuSO4溶液 B.稀H2SO4C.AgNO3溶液 D.AlCl3溶液
2.(2021.孝感模拟)将一定量金属M加入到ZnSO4和CuSO4的混合溶液中,充分反应后,过滤,得到固体滤渣,滤液为无色,向滤渣中加入滴入稀盐酸有气泡产生,下列有关判断正确的是()
A.金属活动性:M>Zn>CuB.滤液中可能只含一种金属化合物
C.滤渣中一定含有金属MD.该过程一定发生了如下反应M + CuSO4=== Cu + MSO4
3.(2021.咸宁模拟)向盛有氯化亞铁和氯化铜混合溶液的烧杯中加人一定量的锌粉,充分反应后,得到固体M和溶液N。下列叙述错误的是()
A.锌有剩余时,M中一定有Fe、Cu和ZnB.锌有剩余时,N中一-定没有FeCl2和CuCl2
C.锌无剩余时,M中一定有Cu,可能有FeD.锌无剩余时,N中一定有FeCl2和ZnCl2
4.(2021.黄孝咸改编)将一定质量的锌粉、铁粉混合物加入到CuSO4溶液中,充分反应后过滤,得到滤渣和滤液,下列有关分析错误的是()
A.若滤液为无色,则可以证明锌的金属活动性大于铜
B.若滤液为有色溶液,则滤液中至少含有2种金属离子
C.若向滤渣中加入稀盐酸没有气泡产生,则滤液中可能含有三种金属化合物
D.若向滤渣中加入稀盐酸有气泡产生,则滤渣中一定含有铜、铁、锌
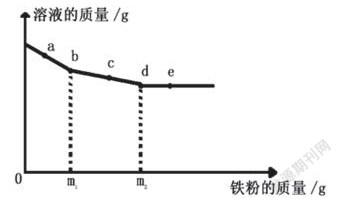
5.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,反应过程中,测得混合物中溶液的质量与加入铁粉的质量关系如图所示。有关该反应过程中的下列说法正确的是()
A. b点,溶液中的阳离子有Fe2+、Cu2+、Ag+
B. c点,向过滤后得到的固体中滴加稀盐酸,无气泡产生
C. d点,溶液中含有Fe(NO3)2和Cu(NO3)2
D. e点,过滤后得到的固体中只含有2种物质
附:答案:1,A 2,B 3,D 4,D 5,B
