rhEGF联合组织瓣修复口腔颌面部创伤性缺损畸形
2021-01-16陈丽荣窦春波李金超高晓佩
陈丽荣 窦春波 李金超 高晓佩






[關键词]重组人表皮生长因子;组织瓣;口腔颌面部创伤性缺损畸形;生长因子
[中图分类号]R782.2 [文献标志码]A [文章编号]1008-6455(2021)12-0111-05
rhEGF Combined with Tissue Flap to Repair Traumatic Oral and MaxilloFacial Defects
CHEN Li-rong1, DOU Chun-bo2, LI Jin-chao2, GAO Xiao-pei1
(1.Department of Prosthodontics; 2. Department of Oral and Maxillofacial Surgery, Dongfeng Stomatological Hospital Affiliated to Hubei University of Medicine, Shiyan 442001,Hubei,China)
Abstract: Objective Analyze the effect of recombinant human epidermal growth factor (Recombinant human epidermal growth factor, rhEGF) combined with tissue flap to repair traumatic defect deformity of oral and maxillofacial region. Methods From January 2017 to January 2020, 21 patients with traumatic oral and maxillofacial defects in our hospital were selected as the subjects. According to the random digital table method, 11 cases were divided into the combined group and 10 cases in the control treatment group. Control group patients were treated with tissue flap, combined group on the basis of control group rhEGF treatment. The expression levels of growth factor, facial function, pain, psychology, quality of life, clinical efficacy and satisfaction were compared between the two groups. Results The TNF-α、IL-1、IL-6 expression level in the combined group decreased compared with the control group (P<0.05). The expression of VEGF、bFGF、EGF in the combined group increased compared with the control group (P<0.05). The rate of facial nerve dysfunction in the combined group was lower than that in the control group (P>0.05), and the facial disability index in the combined group was higher than that in the control group (P<0.05). Compared with the control group, the pain and psychological score in the combined group decreased and the quality of life score increased (P<0.05). Compared with the control group, the total effective rate of the combined group was higher (P>0.05). Compared with the control group, the total satisfaction of the patients in the combined group was higher (P>0.05). Conclusion Combined application of rhEGF、 tissue flap in the repair of traumatic defects in oral and maxillofacial regions can significantly reduce local inflammation, increase the content of growth factors, promote the repair of defects, improve facial function, and improve the quality of life of patients. The application effect is ideal.
Key words: recombinant human epidermal growth factor; tissue flap; oral and maxillofacial traumatic defect; growth factor
口腔颌面部创伤性缺损畸形属于一种临床上较为常见的疾病,颌面部位置较为突出且暴露,较易出现创伤性损伤,不仅造成患者口腔颌面部外观异常,还在一定程度上对其心理、生活带来较大影响[1]。临床上多以止血、功能恢复为口腔颌面部创伤性缺损畸形的治疗原则,并在最大程度上促进缺损畸形的修复,恢复患者容貌。目前,随着社会经济、交通的不断发展,导致口腔颌面部创伤性缺损畸形的发生率呈逐年上升趋势,且患者对于缺损畸形和功能重建的期望度较高,给目前的治疗带来了挑战[2-3]。笔者科室采用rhEGF联合组织瓣修复口腔颌面部创伤性缺损畸形并分析其作用,以期为临床上口腔颌面部创伤性缺损畸形的修复提供参考。
1 资料和方法
1.1 一般资料:选取2017年1月-2020年1月笔者医院收治的21例口腔颌面部创伤性缺损畸形患者为研究对象,按照随机数字表法分为联合组11例和对照组10例。联合组:男6例,女5例,年龄25~41.5岁,平均年龄(30.67±5.12)岁;伤口长度4~12.6cm,平均伤口长度(8.00±2.15)cm。创伤缺损部位:唇部6例,颊部2例,下额3例。致伤原因:交通事故7例,坠落3例,切割1例;对照组:男5例,女5例;年龄25~42.9岁,平均年龄(31.02±5.26)岁;伤口长度3~12.5cm,平均伤口长度(7.89±2.20)cm。创伤缺损部位:唇部5例,颊部3例,下额2例。致伤原因:交通事故6例,坠落2例,切割2例。两组患者基本资料比较差异无统计学意义,患者家属均知情同意,且经医院伦理委员会批准。
1.2 纳入标准:患者均因外界创伤所致的口腔颌面部缺损畸形,全身生命体征平稳,伤口无感染,未合并其他急慢性化脓性感染,自愿参与本次研究。
1.3 排除标准:①非外伤所致的口腔颌面部创伤性缺损畸形者;②不愿接受组织瓣修复者;③合并心理障碍、沟通障碍及精神障碍者;④合并糖尿病、高血压者;⑤妊娠或哺乳期女性;⑥合并恶性肿瘤者。
1.4 方法
1.4.1 治疗方法:对照组患者采用组织瓣治疗,术前对患者营养状态、生命体征行常规评估处理,做针对性的措施干预。彻底清除患者创面、创面周围异物、创面坏死组织以及炎性肉芽组织,对瘢痕组织彻底切除,在无张力的状态下行复位处理,关闭部分创面,并尽可能将患者创面周边健康组织、结构进行保留。根据患者创面缺损的大小、形态及结构等选择供区,设计与其相匹配的邻近组织瓣,进行组织瓣修复,根据受区形态塑形,带有骨折的患者在恢复正确咬合关系的情况下做钛板坚固内固定。术后行常规抗感染,密切监测患者局部血运情况;联合组在对照治疗组的基础上采用rhEGF外用溶液(深圳市华生元基因工程发展有限公司,国药准字S20010038,规格为2 000IU/ml,15ml)治疗,在患者创口缝合前喷约4 000IU/10cm×10cm(每次喷约200 IU rhEGF)1次,縫合后重复喷一次,之后每日喷2次,直至拆线。
1.4.2 血清炎症指标表达水平检测:取患者治疗前1d、治疗后7d清晨空腹静脉血3ml分离出上层血清,采用酶联免疫吸附试验法(Enzyme linked immunosorbent assay,ELISA法)测定血清炎症指标肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白介素-1(Interleukin-1,IL-1)、白介素-6(Interleukin-6,IL-6)表达水平,TNF-α ELISA试剂盒、IL-1 ELISA试剂盒均购自武汉益普生物科技有限公司,IL-6 ELISA试剂盒购自北京索莱宝科技有限公司。
1.4.3 生长因子表达量检测:抽取患者治疗前1d、治疗后7d清晨空腹静脉血3ml分离出单个核细胞,单个核细胞总RNA使用Trizol法提取,Takara逆转录试剂盒获得cDNA,采用实时荧光定量PCR法检测患者外周血单个核细胞生长因子血管内皮生长因子(Vascularendothelial growth factor,VEGF)、碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)、上皮细胞生长因子(Epithelial cell growth factor,EGF)表达量,2-△△Ct方法计算。引物序列:VEGF上游:5’-AACTTTCTCTGCTGTCTTGGGT-3’,下游:5’-TCTCGATTGGATGGCAGTA-3’;bFGF上游:5’-AGCCGGGAGCATCACCA-3’,下游:5’-CCCAGTTCGTTTCAGTGCC-3’;EGF上游:5’-TGGCAGATGCTGGAATATCA-3’,下游:5’-TCTCTTGCCTTGTCCCATTC-3’;内参β-actin上游:5’-ATCATGTTTGAGACCTTCAACA-3’,下游:5’-CATCTCTTGCTCGAAGTCCA-3’。
1.4.4 面部功能评价:采用Huuse-Brack-mann(H-B)面神经功能、面部残疾指数(Facial disability index,FDI)评价患者治疗前1d、治疗后7d面神经功能。其中H-B分为5个等级,Ⅰ级为正常,Ⅱ级为患者面神经功能存在轻度功能障碍,Ⅲ级为患者面神经功能存在中度功能障碍,Ⅳ级为患者面神经功能存在重度功能障碍,Ⅴ级为患者面部完全麻痹。FDI指数分为躯体功能(Somatic function,FDIP)、社会功能(Social function,FDIS)两个子量表,FDIP、FDIS各包括5个条目,FDIP总分为40分,FDIS总分为37.5分,分数越高说明患者面部残疾程度越轻。
1.4.5 疼痛、心理及生活质量评价:分别采用疼痛数字评分法(Pain digital scoring method,NRS)、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)、华盛顿大学生活质量问卷(University of Washington quality of life questionnaire,UW-QOLv4)评价患者治疗前1d、治疗后7d疼痛情况、心理焦虑、心理抑郁、生活质量,其中NRS评价采用数字式0~10表示疼痛程度,患者根据自身疼痛程度在0~10数字上画圈,0表示无痛记为0分,10表示剧痛记为10分,分数越高说明患者疼痛越严重。HAMA评价总分≥7分表示存在心理焦虑情绪,<7分表示无心理焦虑情绪。HAMD评价总分≥8分表示存在心理焦虑情绪,<8分表示无心理焦虑情绪。UW-QOLv4包括12个条目,采用Likert计分法,总分为100分,分数越高说明患者生活质量越高。
1.4.6 临床疗效评价:根据患者治疗后1个月缝合伤口愈合程度、瘢痕、面部功能恢复情况评价临床疗效,分为显效、有效、无效三个等级。患者治疗后1个月缝合伤口愈合良好,无明显瘢痕,面部功能恢复正常为显效;患者治疗后1个月缝合伤口愈合存在轻度的缺损,存在少量的瘢痕,面部功能基本恢复正常为有效;未达到上述标准判定为无效。治疗总有效率=(显效+有效)例数/总例数×100%。
1.4.7 满意度评价:患者治疗后1個月,采用笔者医院自制的口腔颌面部畸形修复满意度量表对患者口腔颌面部畸形修复满意度进行评价,评价内容包括面部功能恢复情况、缺损部位愈合情况、瘢痕形成情况等,总分为10分,分为3个等级,其中非常满意为得分≥8分,满意为得分6~8分,不满意为得分<6分。总满意度=(非常满意+满意)例数/总例数×100%。
1.5 统计学分析:采用SPSS 21.0统计软件进行分析处理。计量资料采用均数±标准差(x¯±s)描述,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料采用频数和百分比表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
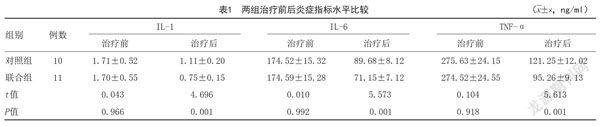
2.1 两组炎症指标水平比较:两组治疗前炎症指标水平比较,差异无统计学意义(P>0.05);与治疗前比较,两组治疗后炎症指标水平降低,且联合组炎症指标水平低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 两组患者生长因子表达量比较:两组治疗前VEGF、bFGF、EGF表达量比较,差异无统计学意义(P>0.05);与治疗前比较,两组治疗后VEGF、bFGF、EGF表达量均升高,且联合组VEGF、bFGF、EGF表达量高于对照组,差异具有统计学意义(P<0.05)。见表2。
2.3 两组患者面部功能比较:治疗前两组面神经功能障碍率、面部残疾指数比较,差异无统计学意义(P>0.05);与治疗前比较,两组治疗后面神经功能障碍率均降低,且联合组面神经功能障碍率低于对照组,但差异无统计学意义(P>0.05);与治疗前比较,两组治疗后面部残疾指数升高,且联合组面部残疾指数高于对照组,差异有统计学意义(P<0.05)。见表3。
2.4 两组患者治疗前后疼痛、心理及生活质量评分比较:两组治疗前疼痛、心理、生活质量评分比较,差异无统计学意义(P>0.05);与治疗前相比,两组治疗后疼痛、心理评分降低,生活质量评分升高,且联合组疼痛、心理评分低于对照组,生活质量评分高于对照治疗组,差异有统计学意义(P<0.05)。见表4。
2.5 两组患者临床疗效比较:治疗后,与对照组比较,联合组治疗总有效率较高,但两组比较差异无统计学意义(P>0.05)。见表5。联合组典型病例见图1。
2.6 两组患者对口腔颌面部畸形的修复满意度比较:治疗后,两组满意度比较,联合组患者对修复的总满意度较高,但两组比较差异无统计学意义(P>0.05)。见表6。
3 讨论
口腔颌面部是人体中裸露面积最大且突出的部分,在日常生活工作中,较易因外界意外而导致口腔颌面部创伤的发生,且较为常见的为交通伤,目前随着我国社会经济、交通运输等快速发展,导致多种意外事件的发生率升高,而口腔颌面部创伤性缺损畸形的发生率随之升高[4]。口腔颌面部创伤性缺损畸形的出现不仅会损伤患者容貌,降低美观度,也给患者日常生活、工作带来了一定的焦虑、抑郁情绪,进而降低患者生活质量,因此,寻找修复此类患者缺损畸形的有效手段,对改善患者面部形态,提高生活质量具有重要的意义。
目前,临床上多采用组织瓣修复对口腔颌面部创伤性缺损畸形患者进行治疗,此种治疗方式是指在治疗过程中将带有神经、血管、皮肤、软组织等皮瓣移植至缺损部位,可有效促进患者创伤感觉、神经恢复,且组织瓣来自患者自身组织,不具有自身排异性,安全性较高[5-6]。江灿洋等[7]在其研究中将组织瓣应用于口腔颌面部严重创伤性缺损畸形的整复治疗中,结果显示,选择合适的游离血管化组织瓣可保证其整复效果。基于上述背景,在本文研究中将邻近组织瓣应用于口腔颌面部创伤性缺损畸形患者的缺损修复中,结果发现根据创面缺损的大小、形态、结构等选择供区组织瓣,可保证缺损修复的效果。目前,虽然有研究证实,手术具有良好的缺损畸形修复效果,但有研究发现,在患者手术后结合药物辅助治疗,可促使临床疗效最大化,促进伤口愈合,抑制术后瘢痕的形成,可得到优良的面部修复效果[8]。rhEGF属于一种生长因子,广泛存在于人体中,对内皮细胞、上皮细胞产生刺激作用,促进其生长,发挥其促进皮肤新陈代谢的作用[9-11]。rhEGF具有有丝分裂原促进细胞增殖的作用,其可在一定程度上促进成纤维细胞、血管内皮细胞、角质形成细胞等多种细胞迁移至创伤部位,以抑制创伤后瘢痕的形成,可促进创面修复[12]。另外,rhEGF应用后可形成一道药物保护膜,为创伤缺损部位的预后提供优良的环境,阻碍细胞的生长、繁殖,提高机体非特异性免疫功能,预防创伤部位感染的发生[13]。目前,临床上已有研究将rhEGF应用于创伤面的治疗中,且已经取得了良好的效果[14-15]。在本文研究中,在患者做组织瓣修复后联合应用rhEGF,结果显示与未使用rhEGF的患者相比,使用rhEGF的患者修复效果理想,患者局部炎症明显被抑制,面部功能恢复良好,且疼痛明显减轻,生活质量随之提高,此结果可能与组织瓣修复后应用rhEGF形成保护膜,抑制细菌生长、繁殖,进而抑制局部感染,减轻疼痛,促进缺损愈合相关。
创面缺损修复为一个较为复杂但有序的过程,其中血管生长是创面修复的基础,其可为创面修复提供较为充足的养分,利于组织新生,VEGF属于一种与新生血管形成相关的生长因子,其可经作用于血管内皮细胞增加血管通透性、改变细胞外基质成分发挥上述作用[16-17]。研究显示,在血管内皮细胞的转录过程中VEGF的含量较低,但在创面愈合过程中其含量明显升高[18]。bFGF为一组活性多肽,广泛存在于生物体中,在创面中具有重要的意义,参与神经再生、毛细血管、肉芽组织形成等相关,可促进成纤维细胞、内皮细胞向创面迁移,进而促进肉芽组织细胞中DNA、RNA复制和蛋白质的合成,进而发挥其增强上皮细胞、成纤维细胞增殖、分化,最终促进创面愈合[19-20]。EGF与VEGF、bFGF相同,均属于生长因子,为具有促进或者抑制多种类细胞生长的多肽,存在于细胞膜上,当其与自身受体相结合后可形成复合物,经磷酸化促进创面修复[21-22]。本文研究结果显示,联合应用rhEGF修复治疗的患者,EGF、VEGF、bFGF含量明显升高,此结果提示,在组织瓣修复的基础上采用rhEGF治疗具有较为理想的修复效果,表现为EGF、VEGF、bFGF等生长因子含量升高。
综上所述,口腔颌面部创伤性缺损畸形患者采用rhEGF、组织瓣联合治疗可明显提高修复效果,其作用机制可能与改善患者局部炎症、促进生长因子分泌相关。
[参考文献]
[1]Mosaddad SA,Gheisari R,Erfani M.Oral and maxillofacial trauma in motorcyclists in an Iranian subpopulation[J].Dent Traumatol,2018,34(5):347-352.
[2]Moreira Falci SG,Duarte-Rodrigues L,Primo-Miranda EF,et al.Association
between epilepsy and oral maxillofacial trauma: A systematic review and meta-analysis[J].Spec Care Dentist,2019,39(4):362-374.
[3]Lovich-Sapola J,Johnson F,Smith CE.Anesthetic considerations for oral, maxillofacial,and neck trauma[J].Otolaryngol Clin North Am,2019,52(6):1019-1035.
[4]Ologunde R,McLeod NMH.Use of patient-reported outcome measures in oral and maxillofacial trauma surgery: a review[J].Br J Oral Maxillofac Surg,2018,56(5):371-379.
[5]張彤媚,杨锟,沈军,等.采用组织瓣修复上颌骨缺损36例临床分析[J].天津医药,2020,48(3):195-199,前插3,前插4,前插5.
[6]吴苏州,华栋,方小魁,等.皮瓣在面部病灶切除术后软组织缺损修复中的应用[J].组织工程与重建外科杂志,2020,16(1):46-47,53.
[7]江灿洋,施斌,黄建平,等.游离血管化复合组织瓣在口腔颌面部严重创伤性缺损畸形整复中的应用:11例临床分析[J].中国口腔颌面外科杂志,2020,18(2):155-159.
[8]孙浩博,吕国忠.重组人表皮生长因子对深Ⅱ度烧伤患者创面愈合效果及相关炎症因子水平的影响[J].中国美容医学,2020,29(10):75-78.
[9]张楠.重组人表皮生长因子修复雀斑激光术后创面的疗效及安全性观察[J].实用医院临床杂志,2020,17(1):174-176.
[10]王强,段云飞,徐燕,等.重组人表皮生长因子包涵体的表达、纯化及复性[J].生物技术通讯,2018,29(6):743-747.
[11]华若岳.重组人表皮生长因子在面部深Ⅱ度烧伤创面修复中的应用研究[J].中国美容医学,2019,28(2):36-38.
[12]王鹏,高鹏,张超.重组人表皮生长因子凝胶在急诊创伤患者中的疗效分析[J].贵州医药,2018,42(3):308-310.
[13]Techapichetvanich T,Wanitphakdeedecha R,Iamphonrat T,et al.The
effects of recombinant human epidermal growth factor containing ointment on wound healing and post inflammatory hyperpigmentation prevention after fractional ablative skin resurfacing: A split-face randomized controlled study[J].J Cosmet Dermatol,2018,17(5):756-761.
[14]Yang Q,Zhang Y,Yin H,et al.Topical recombinant human epidermal growth factor for diabetic foot ulcers: a meta-analysis of randomized controlled clinical trials[J].Ann Vasc Surg,2020,62:442-451.
[15]Dwivedi C,Pandey I,Pandey H,et al.In vivo diabetic wound healing with nanofibrous scaffolds modified with gentamicin and recombinant human epidermal growth factor[J].J Biomed Mater Res A,2018,106(3):641-651.
[16]靳丽丽,王瑞萍,孙梦,等.外源性VEGF促进大鼠Ⅱ度烫伤创面中晚期愈合[J].中国组织化学与细胞化学杂志,2019,28(3):221-227.
[17]王晓腾,甘慧,刘晓亚,等.载VEGF及bFGF泊洛沙姆温敏凝胶的制备及其对大鼠皮肤创伤修复的促进作用[J].国际药学研究杂志,2019,46(8):597-605.
[18]Pikuła M,Langa P,Kosikowska P,et al.Komórki macierzyste i czynniki wzrostuw gojeniu ran Stem cells and growth factors in wound healing[J]. Postepy Hig Med Dosw (Online),2015,69(1):874-85.
[19]Ong HT,Dilley RJ.Novel non-angiogenic role for mesenchymal stem cell- derived vascular endothelial growth factor on keratinocytes during wound healing[J].Cytokine Growth Factor Rev,2018,44(1):69-79.
[20]谢心军,张博,张雄,等.象皮生肌膏对外伤创面修复及BFGF表达的影响[J].西部中医药,2020,33(4):121-123.
[21]刘明,唐乾利,李杰辉,等.烧伤湿润暴露疗法及湿润烧伤膏治疗糖尿病足的效果及对创面组织血管内皮生长因子和表皮细胞生长因子水平的影响[J].广西医学,2018,40(11):1157-1160,1171.
[22]Choi SM,Lee KM,Kim HJ,et al.Effects of structurally stabilized EGF and bFGF on wound healing in type I and type II diabetic mice[J].Acta Biomater,2018,66(1):325-333.
[收稿日期]2021-01-13
本文引用格式:陈丽荣,窦春波,李金超,等.rhEGF联合组织瓣修复口腔颌面部创伤性缺损畸形[J].中国美容医学,2021,30(12):111-115.
