寇氏隐甲藻生产DHA的研究进展
2021-01-15杨晓辉贾晓强
杨晓辉,贾晓强
(天津大学 化工学院 系统生物工程教育部重点实验室,天津 300354)
脂肪酸是由烃链和羧基组成的有机化合物,多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)是其中的一类[1]。多不饱和脂肪酸中的二十二碳六烯酸(Docosahexaenoic acid,DHA,C22∶6)在预防心血管疾病、炎症、自身免疫性疾病等方面发挥着重要作用[2]。以往获取DHA的传统来源是深海鱼油[3],然而,这些来源的DHA具有鱼腥味重、稳定性差的问题[4]。研究表明,海洋鱼类中DHA的积累主要来源于微藻,因此,可以开发利用生产DHA的微藻的技术来实现DHA的微生物生产[5]。
海洋微生物细胞中含有大量的DHA,且被认为是生产这种重要脂肪酸的潜在微生物来源。异养非光合微藻——寇氏隐甲藻(Cryptheccodiniumcohnii)可积累较高比例的脂质(约为细胞干重的40%)和高质量的DHA,近年来备受关注[6-8],且因其产生的脂质中,其他多不饱和脂肪酸(PUFA)的含量相对于DHA的含量来说非常少,故非常有利于后期DHA的纯化。但与许多其他微藻一样,脂质积累效率和生物量是阻碍其工业化生产的两个限制因素[9]。
为了解决这些问题,已有多种方法被报道,包括诱变育种[10]、发酵条件的优化[11-12],寻找最适氮源等[13-14]。但在这些努力下,隐甲藻的脂质产量依旧低于其他的产油微生物[15-16]。与此同时,利用基因工程方法提高藻类微生物的脂质含量及生物量也被广泛研究,又因为缺乏全基因组序列信息,限制了这种方法的深入应用。因此,研发DHA生产水平较高的工程藻株,探索高产DHA的发酵技术具有重要的经济意义。
1 隐甲藻概况及其DHA的合成途径
寇氏隐甲藻(C.cohnii)是有鞭毛的异养海生甲藻,形态多样,一般为单细胞。它作为单细胞真核微生物,既可以进行无性繁殖,也可以进行有性繁殖。图1(a)为Parrow等[17]通过扫描电镜得到的隐甲藻电子显微镜照片,图1(b)为本实验室活化培养的隐甲藻ATCC 30772的普通光学显微镜照片。
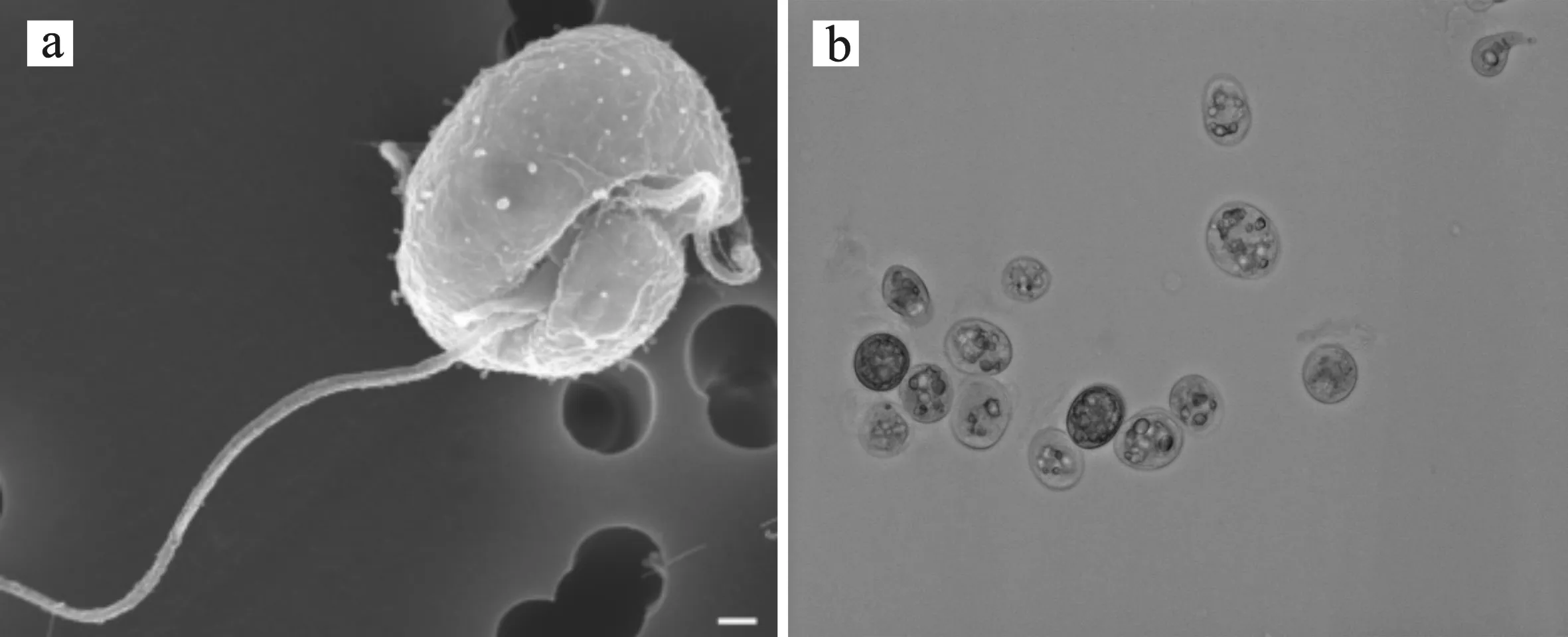
图1 电子显微镜和普通光学显微镜下的隐甲藻Fig.1 Crypthecodinium cohnii observed in electron microscope and optical microscope
目前,已发现的可以生产DHA 的海洋菌大部分是低级藻状菌,在这其中研究比较多的有两种,分别是破囊壶菌和裂殖壶菌[18-19]。具有DHA生产能力的微藻种类繁多且常见的是甲藻,如C.cohnii。寇氏隐甲藻有较高的DHA生产能力,见表1,且在其产生的脂质中,其他多不饱和脂肪酸(PUFA)的含量相对DHA的含量来说非常少,含量低于 1%,这非常有利于后期的DHA纯化。由于人们对医药或食品原料的要求非常高,而且多不饱和脂肪酸容易被降解或氧化,所以分离与纯化的过程在微生物生产 DHA 的过程中非常关键。C.cohnii因其PUFA含量较少的特点使它成为众多DHA生产藻中的优势藻株[20]。

表1 不同微生物中DHA的百分含量的比较Table 1 Comparison of percentages of DHA in the lipids of different microorganisms
隐甲藻中ω-3多不饱和脂肪酸和DHA的总含量超过了30%,但是,隐甲藻中DHA详细的合成途径目前仍是不明确的。
1.1 FAS途径
根据以往研究,人们通常认为 DHA 的合成最开始是利用长链不饱和脂肪酸作为底物的,然后再在细胞质内的微粒体中进行合成,之后再通过一系列的碳链延伸及去饱和过程获得,这种途径被称为脂肪酸合成(Fatty Acid Synthesis,FAS)途径[21],见图2[22]。

图2 脂肪酸合成途径及碳链延伸/去饱和途径[27]Fig.2 Fatty acid synthesis(FAS)pathway and carbon chain elongation /desaturation pathway
然而对于通过该途径合成DHA的合理性还存在很大争议,主要问题在于Δ4去饱和酶(Δ4 Desaturase,Δ4 Des)是否存在于该途径中,因为人们在较长一段时间内很难在DHA的合成过程中表征Δ4去饱和酶的活性,它的存在只是一个假设[23]。Qiu等[24]通过把破囊壶菌(Thraustochytrium sp.)中编码Δ4去饱和酶的两段cDNA(Fad4和Fad5)在酿酒酵母中表达,证实了Δ4去饱和酶参与破囊壶菌中DHA的合成,但是Δ4去饱和酶在寇氏隐甲藻中的作用机制还未有详细报道。Beach等[25]用14C标记的乙酸盐和辛酸盐培养隐甲藻时,在所有的脂肪酸中都可以检测到同位素,而当用14C标记的C10-C18脂肪酸(十八碳一烯酸(18∶1)和二十二碳六烯酸(22∶6)合成的前体物质)培养隐甲藻时,只有(18∶1)中检测到同位素,而在(22∶6)中没有检测到。Sonnenborn 和 Kunau[26]则认为隐甲藻中的 FAS 途径为 DHA 的合成提供了前体物质。
1.2 PKS途径
James等[27]在裂殖壶菌细胞中发现了DHA合成的另一条途径,称为聚酮合酶合成(Polyketide Synthases,PKS)途径。迄今为止,已鉴定的所有多不饱和脂肪酸合成酶都是分子结构极大的多功能酶复合物,由三至四个亚基组成。每个亚基可能含有多个结构域,如丙二酰辅酶A:ACP酰基转移酶(MAT),酰基载体蛋白(ACP),3-酮酰基合酶(KS),3-酮脂酰-ACP还原酶(KR),酰基转移酶(AT),链长度因子(CLF),烯酰还原酶(ER)和3-羟基酰基-ACP脱水酶(DH)。结构域的数量,位置和顺序都决定了从酶复合物中释放的最终代谢产物。Fisch等和Liu等进行了PKS酶的合理结构域交换,成功改变了其产物的链长并有效地产生了新的聚酮化合物,见图3。Ratledge[28]认为隐甲藻类似于裂殖壶菌,也利用 PKS 途径合成 DHA,且是隐甲藻中其他多不饱和脂肪酸产生的唯一途径。
但是由于目前隐甲藻没有完整的基因组信息,利用基因信息使用分子操作对其进行改造实现高产的研究十分受限。因此目前对隐甲藻产DHA的研究,大多是通过外界宏观培养条件和发酵条件的改变使DHA产量提高,并利用代谢组学手段分析引起产量提高的内在机制,继而通过理性改造相关基因实现DHA产量的提高。在下一节的隐甲藻高产DHA的理性设计和改造研究中将进行相关叙述。

图3 聚酮合酶合成途径Fig.3 Polyketide synthese(PKS)pathway
2 隐甲藻高产DHA的理性优化和改造研究
代谢组学(Metabolomic)的概念早在1999年由Nicholson提出,通过代谢组学手段的分析我们可以确定代谢途径中的关键节点,并对相关代谢路径进行优化和调节。
通过对常见的外界宏观条件的改变,如碳氮源、pH、温度、溶氧水平和化学诱导剂;利用代谢组学分析得到的结果在分子水平上对相关辅酶进行调节和基因进行改造以及发酵法生产DHA,综合叙述通过理性优化和改造提高隐甲藻DHA产量的研究进展。
2.1 碳氮源、pH和温度
人们研究发现,寇氏隐甲藻可以在营养丰富的海水中具备非常好的生长能力,可以达到很高的生物量。后来的研究人们又注意到寇氏隐甲藻可以利用的碳源的种类非常多,例如葡萄糖、乙酸和乙醇等[29-30]。研究表明,寇氏隐甲藻对自身所处的培养环境非常敏感,且细胞内的脂肪酸组成更是会受培养条件的影响而产生明显变化。寇氏隐甲藻生长的基本培养基中的初始葡萄糖浓度为9 g/L,Li等[31]通过实验室驯化得到了一株高葡萄糖浓度耐受的隐甲藻,耐受葡萄糖浓度达到54 g/L,但驯化株在45 g/L葡萄糖浓度下油脂产量最高。利用加权关联网络代谢数据分析模型(WGCNA)对所得数据进行分析,认为谷氨酸、甘油、丙二酸和琥珀酸是和驯化株高度相关的核心化合物。Waseem等研究了不同氮源[(NH4)2SO4,(NH2)2CO,NH4HCO3和NaNO3]及其浓度对隐甲藻生产DHA的影响。结果表明,0.8 g/L的NaNO3作氮源能够获得较高的DHA产量,且认为柠檬酸裂解酶、葡萄糖-6-磷酸脱氢酶、苹果酸酶、NADP和NAD+对N有显著的响应。陈峰等[32]发现隐甲藻细胞生长及DHA积累的最适pH在6.0~7.5 之间;当pH低于3.96或高于9.75时,细胞基本不发生生长,处于被抑制的状态。但pH在5.5~8.0之间时,pH对菌体生长与脂质的生产影响不大。郭小婧等[33]研究了隐甲藻在15,20,22,25,28 ℃下条件下以摇瓶发酵培养方式获得的最大生物产量和最高DHA产量,结果表明,最适温度为 22 ℃,由此获得的生物产量为234.85 mg/(L·d),DHA产量为17.45 mg/(L·d),DHA含量为74.36 mg/g 菌体。
2.2 不同溶氧水平和化学诱导剂
氧的供应在隐甲藻生产DHA的发酵期间是非常重要的外界因素。然而,关于溶解氧(Dissolved Oxygen,DO)与细胞代谢之间的内在相关性研究报道很少。Diao等[34]评估了隐甲藻对不同DO水平的反应,表明在高供氧条件下,隐甲藻的生长速率和对葡萄糖的消耗速率要高得多。此外,基于GC-MS的比较代谢组学分析用于区分与不同DO水平相关的响应代谢物的结果表明,在指数期高DO水平下,参与糖酵解途径和TCA循环的中间代谢物上调。在稳定期,在高DO水平下,涉及三酰基甘油代谢的代谢物被上调,而OPP途径的中间产物核糖-5-磷酸被下调。
Bose等[35]的研究表明,多种化学分子可用于增强脂质的积累,包括来源于生长素、细胞分裂素、赤霉素、信号转导物和胺等的化学物质。为了明确这些化学诱导剂增强DHA生产的效果和机制,Li等[36]研究了来自生长素、赤霉素、细胞分裂素、信号转导物和胺的化学诱导剂对隐甲藻中脂质积累的影响。结果表明,萘氧基乙酸(BNOA)、2-氯二十二酸、水杨酸(SA)、脱落酸(ABA)和乙醇胺(ETA)使隐甲藻中的脂质积累增加了10.00%~18.78%。此外,采用靶向代谢组学方法来解释导致脂质积累增加的机制,结果表明糖酵解和TCA循环中的代谢增强以及PPP途径中代谢减少对于脂质的积累具有重要作用。
2.3 分子水平改造
通常,核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)是参与碳固定的第一个关键步骤的酶,但RuBisCO在非光合作用的隐甲藻中的特定作用尚未明确阐明。然而就细胞代谢而言,在异养条件下,涉及CO2固定和光呼吸的途径可能不是必需的。删除这些高丰度但非必需基因如RuBisCO,可以优化碳通量并重定向能量流动(ATP和NADPH)。Diao等[37]选择在自养条件下可能参与CO2固定的RuBisCO作为构建突变株的靶标。与野生型相比,RuBisCO基因的缺失促进了细胞的生长且在异养条件下增加了隐甲藻中脂质的含量。基于液相色谱-质谱(LC-MS)的代谢组学分析也表明,RuBisCO基因的缺失有助于更多的碳或能量向细胞生长和脂质积累流动。
2.4 发酵法生产DHA的研究现状
1962年,Javornick首次在海边采集得到寇氏隐甲藻。美国哥伦比亚的Mertek公司已用该菌种实现了规模化生产。2003年,Swaaf等[38]用葡萄糖为底物在生物反应器中通过分批补料的发酵方式培养寇氏隐甲藻ATCC 30772,在培养400 h之后,Swaaf等获得的最大菌体生物量达到109 g/L,总脂质含量为61 g/L,DHA的含量为19 g/L。
目前,国内针对发酵法进行DHA生产的研究主要是集中于藻株诱变和发酵条件的优化等方面。2001年,王菊芳等[39]研究了3种无机盐(NaCl、MgSO4和KH2PO4)对隐甲藻生长及DHA产量的影响,结果表明隐甲藻可在NaCl为唯一无机盐的培养基中生长,DHA产量达到499.93 mg/L。2010年,梅志刚等[40]利用响应面法优化隐甲藻生产DHA的培养基配方,在优化后的培养基条件下,DHA产量达0.91 g/L,是优化前产量的2.48倍。2012年,孙中贯等[41]利用亚硝基胍对隐甲藻ATCC 30556进行诱变处理,最后得到的突变株的DHA产量达到1.057 g/L。 任路静等[42]利用流加策略实现了隐甲藻生产DHA的高密度发酵,结果表明,在葡萄糖浓度为4 g/L左右时,流加碳氮比为30∶1的营养液对隐甲藻的生长和脂肪酸积累最有利,DHA产量达到4.08 g/L。2015年,王澍等[43]又对寇氏隐甲藻突变株产DHA的发酵培养基进行响应面优化。优化后在50 L发酵罐上进行放大实验得到的DHA的产量为5.65 g/L,比优化前提高了10.35%。2016年,王澍等[44]又通过探究不同补糖时间和不同补糖量对寇氏隐甲藻突变株产DHA的影响,最后使DHA的产量可达到11.94 g/L。
3 总结
近年来,虽然对寇氏隐甲藻的改造和发酵的生产研究投入了大量的精力,但DHA生产过程中的产量低、成本高等瓶颈问题仍然存在,解决这些问题依旧迫在眉睫。除了传统的学科知识和研究手段,合成生物学、系统生物学和CRISPR(规律间隔成簇短回文重复序列)等学科技术的兴起,使人为控制微生物代谢从而提高目标代谢物产量成为现实。因此,构建高产DHA的工程藻株可以在这些学科的支持下进一步开展。本文为寇氏隐甲藻的下一步的研究方向作了三点展望:
(1)转录组学分析。通过转录组学分析研究隐甲藻发酵期间不同生长阶段的代谢状态。功能注释后,鉴定与隐甲藻中脂肪酸和DHA生物合成潜在相关的基因和途径。并基于气相色谱-质谱(GC-MS)的代谢组学分析定义细胞中的小分子多样性,这种手段有助于更好地了解隐甲藻的整体代谢,可以对隐甲藻中DHA生物合成的关键基因有深入了解。
(2)关键酶的研究。全面了解DHA生物合成途径中的关键酶对高产DHA的寇氏隐甲藻工程藻株的构建具有非常重要的意义,并通过对其进行分子生物学研究达到人工构建的目的。同时我们还需要进一步研究寇氏隐甲藻生产DHA 途径中的各种酶活性的变化,从而找到代谢关键节点,为调整代谢流等工作奠定基础。
(3)基因组重测序。首先需要完善寇氏隐甲藻的全基因组信息,由于寇氏隐甲藻是真菌藻类,基因组信息庞大,因此需要长期仔细的分析全基因组信息来构建DHA完整的代谢网络,然后再利用代谢组学等手段对DHA合成的整个代谢途径进行分析,在确定了DHA在生物合成过程中的代谢限速步骤和关键控制基因之后,对与DHA生物合成相关的关键基因进行改造、重排或者修改,从而获得可以高产DHA的人工寇氏隐甲藻工程藻株。
