初始pH值对植物乳杆菌LIP-1抗冷冻干燥性能的影响
2021-01-15张晓宁麻丽丽鄂晶晶王俊国
陈 境,张晓宁,麻丽丽,鄂晶晶,王俊国
(内蒙古农业大学食品科学与工程学院 乳品生物技术与工程教育部重点实验室 呼和浩特010018)
益生菌有助于维持宿主肠道菌群的组成和良好的平衡,可增强宿主对病原体侵入的抵抗力,对肠道健康、代谢紊乱和大脑健康等具有多种有益作用[1-2]。为了更好地利用益生菌,可通过真空冷冻干燥技术制备益生菌菌粉与益生菌发酵剂等。此技术是在低温且真空状态下,具备酶活性丧失少,保存期长等优点[3-5]。然而,在此过程中,要经受冷冻和干燥脱水两个极端环境,不可避免地易造成部分细胞损伤[6],如关键酶的失活、细胞膜损伤等因素,导致生理活性丧失甚至死亡[7-8]。益生菌需在肠道内以足够的丰度存活才能起到一定作用[9],通常是不低于7 lg(CFU/mL),而提高菌株的抗冷冻干燥活性,减少冷冻干燥对益生菌的酶活及细胞膜的损伤是关键。研究发现:通过改变培养基成分[10],添加冻干保护剂及调整冷冻干燥工艺条件等方式可提高冻干乳酸菌的活力[11-12]。尽管有研究表明通过改变培养条件可以提高冻干乳酸菌的活力,但鲜有研究解析其内在机理。
本试验中探究了不同初始pH 值培养条件对植物乳杆菌LIP-1 抗冷冻干燥性能的影响,并测定冻干后植物乳杆菌LIP-1 的关键酶活性和细胞膜脂肪酸含量的变化以及细胞膜损伤,探究改变初始pH 值培对植物乳杆菌抗冷冻干燥的影响机理,为进一步提高乳酸菌的抗冷冻干燥活性提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
植物乳杆菌LIP-1 (Lactobacillus plantarum LIP-1)是一株分离自新疆地区酸马奶中,具有降血脂功能的益生菌植物乳杆菌[13]。由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。
优化MRS 培养基:蔗糖33.35 g,大豆蛋白胨2.95 g,酵母粉2.95 g,酪蛋白胨4.91 g,K2HPO43.3 g、乙酸钠8.25 g、柠檬酸钠3.3 g,VB10.04g,L-半胱氨酸0.05 g,MnSO4·5H2O 0.12 g,MgSO4·7H2O 0.3 g,吐温80 1 g。
脱脂乳粉,恒天然有限公司;MRS 液体培基、MRS 琼脂培养基,英国Oxoid 试剂公司;LIVE/DEAD BacLight Bacteiral Viability Kit L7012 试剂盒;酶活性测定试剂盒,索来宝试剂公司;脂肪酸提取试剂(氯仿有机色谱纯、甲醇、甲醇钠-甲醇、正己烷等)。
1.2 仪器与设备
MLS-3750 型灭菌锅、STAC-S45F 型恒温培养箱,日本三洋公司;KDC-1044 型低速离心机,安徽中佳科仪有限公司;高速离心机,德国Eppendorf 公司;恒温培养箱(DHP-9272 型),上海一恒公司;超低温冰箱,中国海尔集团公司;pH 计,瑞士Mettler Toledo 公司;莱卡荧光显微镜DM4000B,上海徕卡显微系统贸易有限公司;ZHJH-1214B 超净工作台,南京依贝仪器设备有限公司;高压蒸汽灭菌锅,日本三洋MLS-3750;真空冷冻干燥机,Labconco FreeZone;全自动干热灭菌器(ADVANTEC SP-650 型),广州绿百草科学仪器有限公司。
1.3 方法
1.3.1 菌种的活化培养 将植物乳杆菌LIP-1 接种于脱脂乳培养基中,37 ℃培养活化。待凝乳后再以2%的体积分数接种于优化培养基中,37 ℃静置培养18 h。然后在植物乳杆菌LIP-1 经37 ℃活化培养2 代。
1.3.2 菌种的冻干处理 将活化培养好的菌样进行预冻处理,预冻温度及预冻时间为-80 ℃,10 h,保护剂与菌体(菌体浓度调整为1010CFU/g 左右)比例6∶1。真空冷冻干燥18 h 后即为冻干样。
1.3.3 最适初始培养pH 值的确定 以优化培养基为基础,用1 mol/L 的盐酸和1 mol/L 的氢氧化钠对优化培养基进行初始培养pH 值的调节[14]。利用单因素试验,将优化后的培养基初始培养pH值分别调至5.0,5.6,6.2,6.8,7.4。在37 ℃下,将培养的第2 代菌株在不同初始pH 值的优化培养基中发酵培养18 h。通过计算活菌数以确定发酵活菌数最高的最适初始培养pH 值 (将冻前菌样与冻后菌样分别进行精确计数,冻后活菌数与冻前活菌数之比即为菌样的冻干存活率)。在此得到发酵菌数相似,但冻干存活率存在显著差异的2 组(P<0.05),由此选取试验组与对照组后,进行后续试验。本研究对发酵培养的菌株进行不同时间下培养pH 值的测定,直至18 h 收获菌样(测定培养过程中pH 值变化趋势)。
1.3.4 菌发酵培养过程中pH 值、生长量及菌体密度的变化 利用优化后的不同pH 值培养基分别对植物乳杆菌LIP-1 进行发酵培养,每3 h 测定一次pH 值,根据结果绘制折线图。在这些时间点(即3,6,9,12,15,18 h)分别对菌进行菌体密度及生长量的测定并绘图。
1.3.5 细胞膜脂肪酸的提取与测定
1)细胞膜脂肪酸的提取 本试验利用Bligh&Dyer 法提取菌体细胞膜的脂肪酸[15],甲酯化后进行萃取。按照步骤,首先用无菌去离子水对经不同pH 值处理的冻干后菌样 (试验组与对照组)复水后离心洗涤3 次 (4 000 r/min,4 ℃,10 min)。弃上层清液后,分别称取菌泥0.5 g,向其中加入1.9 mL 氯仿-甲醇溶液(以氯仿∶甲醇体积比为1∶2 的条件制备溶液),剧烈振荡15 min。加入0.625 mL 氯仿及0.625 mL 无菌去离子水,充分振荡15 min 后,离心10 min(4 ℃,8 000 r/min)。此时溶液分层,吸取下层液相,分别移至无菌离心管内。氮吹30 min 后,以甲醇钠-甲醇溶液(1 mol/L)做催化剂,分别加1 mL 于离心管内,在冰浴条件下振摇5 min 进行甲酯化。用0.625 mL 正己烷萃取脂肪酸甲酯,离心5 min(4 ℃,8 000 r/min),吸取上层清液后经有机系过滤器移至气相瓶后进行细胞膜脂肪酸含量的测定。
2)细胞膜脂肪酸含量测定 气相色谱条件:PEG 毛细管填充柱(60 m×0.22 mm,0.25 μm film,Restek);载气:氮气;流速:35 mL/min;总流量:18.8 mL/min;柱压:20 kPa;柱温箱由初始6.5 ℃/min 的速率增至40 ℃/min,此时温度为230 ℃并在230 ℃保持35.58 min。脂肪酸的峰面积、各自的保留时间和质谱范围根据标样进行比对(西格玛37 种脂肪酸标样和环丙烷脂肪酸标样),对每个样品进行3 次重复测定。
1.3.6 细胞膜完整性的测定 利用LIVE/DEAD BacLight Bacterial Viability 试剂,将荧光染料PI和SYTO9 等体积混合均匀,取2 μL 混合染料,分别加至1 mL 菌液中,振荡混合均匀,在室温避光孵育10~15 min。取5 μL 染好色的菌悬液,滴加至洁净的载玻片后在荧光显微镜下进行观察。
1.3.7 酶活性测定 用β-半乳糖苷酶 (β-GAL)试剂盒、乳酸脱氢酶(LDH)试剂盒、ATP 酶试剂盒、己糖激酶(HK)试剂盒、丙酮酸激酶(PK)试剂盒对2 组样品进行测定。
1.3.7.1 无细胞提取液的制备 将冷冻干燥后的试验组与对照组细菌菌液离心,离心洗涤2 次后弃上清液,加入1 mL 细胞提取液 (500 万细胞数),以功率20%,超声3 s,间隔10 s,重复30 次进行超声波破碎。8 000×g,4 ℃离心10 min 取上清液,置于冰浴中待测。
1.3.7.2 酶活力的测定 用β-半乳糖苷酶 (β-GAL)活性检测试剂盒、乳酸脱氢酶(LDH)活性检测试剂盒、ATP 酶活性检测试剂盒、己糖激酶(HK)活性检测试剂盒、丙酮酸激酶(PK)活性检测试剂盒分别对经不同初始pH 值进行培养后的冻干菌样样品进行测定,每个酶活单位用U 表示。
1.3.8 数据的处理 所有数据每组各3 个平行样,使用R 统计软件对各试验数据采用Wilcox 检验法统计分析其显著性,P≤0.05 为显著。并使用Graph Pad 7.0 软件完成相关图的绘制。
2 结果与分析
2.1 不同初始培养pH 值对植物乳杆菌LIP-1抗冷冻干燥性能的影响
如图1可知,在培养基不同起始pH 值的条件下,植物乳杆菌LIP-1 的高密度发酵活菌数随起始pH 值的升高呈现先增大后减小的趋势,表明不同起始pH 值对菌株的生长及代谢有显著影响。
当初始培养pH 值分别为6.8 与7.4 时,发酵活菌数较高,分别为9.79,9.70 lg(CFU/mL),且无显著性差异变化(P>0.05),但冻干存活率分别为81.76%,72.43%,具有显著性差异(P<0.05)。为了减少影响因素,本研究选择发酵菌数相似,但冻干存活率存在显著差异的2 组进行后续试验,即以初始pH 值为6.8 培养的LIP-1 作为试验组,以初始pH 值为7.4 的LIP-1 作为对照组,来进一步探究不同初始pH 值对乳杆菌抗冷冻干燥活性的内在影响机制。
2.2 发酵培养过程中pH 值和菌体生长量的变化
对试验组(初始pH 值为6.8)与对照组(初始pH 值为7.4)发酵过程中pH 值的变化、菌的生长量进行了测定,结果如图2所示。
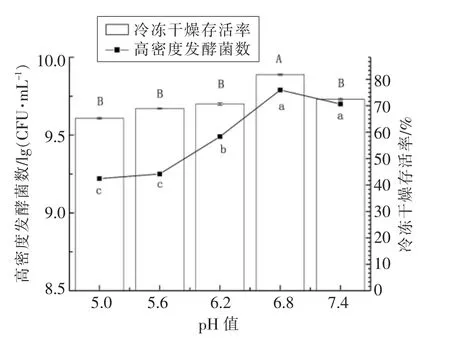
图1 不同初始pH 值培养对植物乳杆菌LIP-1抗冷冻性的影响Fig.1 Effect of different initial pH on the anti-freezing property of Lactobacillus plantarum LIP-1
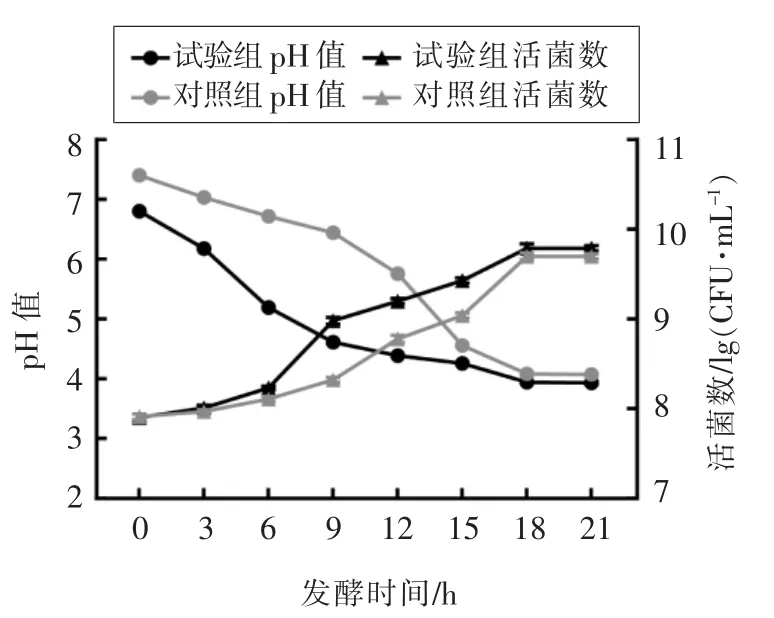
图2 经不同初始pH 值培养的菌株其发酵过程pH 值及生长量的变化Fig.2 Effect of different initial pH on medium fermented pH and cell growth of Lactobacillus plantarum LIP-1
当初始pH 值为6.8 和7.4 时,发酵液pH 值和菌株活菌数的动态变化趋势一致,pH 值在培养后呈现下降趋势而活菌数呈现上升趋势。发酵第3 h 后,与对照组相比,试验组pH 值降低得更快,活菌数增长更多,最后均趋于稳定。研究发现初始pH 值对菌株生长的影响与酶的活性密切相关[16],适宜的初始pH 值,可以使酶活性增加,促进菌株的生长。我们认为pH 6.8 作为最适初始pH 值,可以使植物乳杆菌相关的酶活性增加,促进其生长。与本研究相似,詹兰兰等[17]研究发现,初始pH 值能显著影响乳酸菌菌株E2和D2的生长。
在6 h 之后至发酵终点18 h,试验组所处pH值均在5.2 以下,而对照组在14 h 以后pH 值才达到5 以下水平,且发酵终点试验组pH 值低于对照组,这表明试验组的pH 值下降更快,植物乳杆菌LIP-1 所处低酸生长环境时间更长。研究发现持续的低酸环境能激起菌株的胁迫耐受机制,菌株因此获得抗应激性,从而能使细胞更好地抵抗冷冻和脱水[17],因此与对照组相比,试验组长时间的酸胁迫引起了植物乳杆菌LIP-1 的胁迫耐受机制,从而提高了其抵御冷冻干燥的能力,试验组的冻干存活率也因此明显高于对照组 (参见图1)。
与本研究结果相似,Streit 等[18]对保加利亚乳杆菌冷胁迫耐受的研究发现,经pH 5.25 低酸性环境培养后,细胞对冷冻胁迫的耐受能力显著提高(P<0.05)。Li 等[19]对酒类酒球菌(O.oeni)抗冻干性能的研究发现酸性条件的培养促进了酒类酒球菌的抗冻干作用,因此有较高的冷冻干燥存活率。此外,Chu-Ky 等[20]研究发现,当酿酒酵母UP3OY5 菌株在低酸环境下培养再进行冷冻干燥处理,酸环境培养细胞(79.9%)的活力显著高于未经酸环境培养细胞(40.5%)的活力,且在冷冻干燥处理后能更好地存活。所以对植物乳杆菌LIP-1而言,经初始pH 6.8 培养所营造的低酸环境提高了其对冷冻干燥的耐受性,从而提高了冻干存活率。
2.3 不同初始培养pH 值对植物乳杆菌LIP-1细胞膜脂肪酸的影响
如表1所示,植物乳杆菌LIP-1 细胞膜的脂肪酸组分主要有8 种,分别是C12:0(月桂酸)、C14:0(肉豆蔻酸)、C16:0(棕榈酸)、C16:1(棕榈油酸)、C18:0(硬脂酸)、C18:1(油酸)、19cyc (环丙烷脂肪酸)和C18:2(亚油酸),这些脂肪酸约占总脂肪酸含量的86%以上,除此之外还检测到一些其它脂肪酸(C4:0,C6:0,C8:0,C10:0,C14:1,C15:0,C17:0,C18:1t,C18:3),因所占比例较少所以未列入表中。
由表1可知,试验组与对照组的细胞膜脂肪酸含量不同,特别是不饱和脂肪酸及环丙烷脂肪酸的含量,除C16:1不显著以外,其余试验组均显著高于对照组(P<0.05)。发酵过程中的pH 值变化使细胞膜上的脂肪酸成分发生改变[20]。有研究表明低pH 值的生长环境可促进细胞膜环丙烷脂肪酸的合成并提高不饱和脂肪酸的含量[21-25],这与本试验结果相一致,较对照组而言,试验组适宜的初始pH 值(6.8)促进了菌的生长代谢,并使pH 值快速下降(见图2),使植物乳杆菌LIP-1 长期处在低pH 值的生长环境,进而提高了细胞膜环丙烷脂肪酸和不饱和脂肪酸的含量。脂肪酸含量的改变是菌株LIP-1 在低pH 值的生长环境中所发生的应激反应。
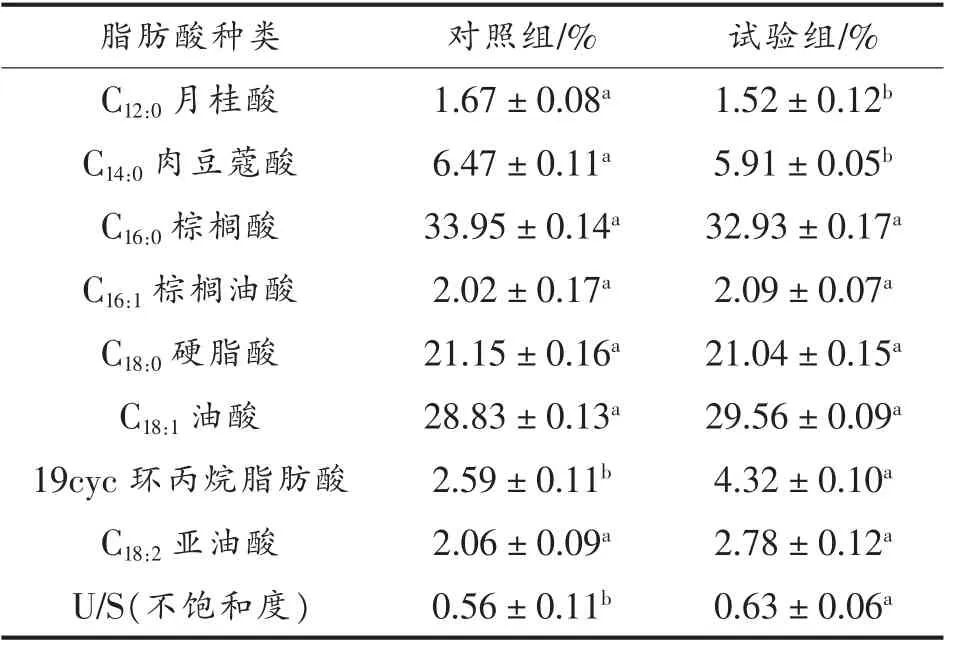
表1 不同初始pH 值培养下植物乳杆菌LIP-1冷冻干燥后细胞膜脂肪酸的相对含量Table 1 The relative contents of fatty acids in cell membrane after freeze-drying of Lactobacillus plantarum LIP-1 under different initial pH values
在低温下保持细胞膜的流动性是微生物耐冷机理中的关键,而脂肪酸的种类和组成是细胞维持膜流动性的要素[26],细胞膜脂肪酸含量变化的不同使菌株对冷冻干燥有不同耐受性[27],环丙烷及不饱和脂肪酸的增加会使细胞膜维持较好的流动性水平,增强菌株的冷冻干燥抗性[28-30]。
Smittle 等[31]提出环丙烷脂肪酸可以防止脂质在细胞膜中紧密的堆积,使其在暴露于低温时更具弹性和灵活性。也有研究的结果与本试验结果相符,因为环丙烷脂肪酸的增加提高了菌株的抗冷冻干燥活性[28],Jesus 等[32]证实了环丙烷脂肪酸升高对恶臭假单胞菌抗冷冻干燥性能影响的重要性。Li 等[19]研究证明酒类酒球菌的冷冻干燥存活率升高,与C19cyc11 的富集显著相关。Wang 等[33]也发现冷冻贮藏期间嗜酸乳杆菌细胞的高抗性与环丙烷脂肪酸高浓度有关。同时也有研究发现高含量的不饱和脂肪酸可以提高细胞膜对冷冻干燥的抵抗力[33],张筠等[34]发现当德氏乳杆菌保加利亚亚种FL6 细胞膜不饱和脂肪酸含量显著增加(P<0.05),U/S 比值升高时,菌株对冻干的抵抗力增强。陈声明等[35]的研究表明,在低温干燥条件处理后,酿酒酵母 (Saccharomyces cereuisiae)F159自身调节了脂肪酸的不饱和度,增加了细胞膜不饱和脂肪酸含量使细胞膜保持流动状态以此更好地维持了细胞活性,提高了抗冷冻干燥性能。

图3 不同初始pH 值培养对植物乳杆菌LIP-1 冷冻干燥后膜脂肪酸总离子图Fig.3 The total ionic figure of membrane fatty acids after freeze - drying of Lactobacillus plantarum LIP-1 cultured at different initial pH values
据此,初始pH 6.8 的培养可以使植物乳杆菌LIP-1 长期处在低pH 值的生长环境,促进细胞膜环丙烷脂肪酸的合成以及饱和脂肪酸向不饱和脂肪酸的转化,提高了脂肪酸的不饱和度。通过改变细胞膜脂肪酸的组成保持了菌株细胞膜在低温环境下的流动性,从而提高了菌体抗冷冻干燥活性。
2.4 细胞膜完整性的测定
LIVE/DEAD BacLight 试剂盒中包含2 种染料SYTO-9 和PI,SYTO-9 可对具完整细胞膜的细菌进行染色并呈现绿色,而PI 染料由于细胞膜破损进入细胞内使其呈现红色,因此通过染色可以说明经冷冻干燥处理后菌体细胞膜完整性的保持情况[36]。研究已经证明细胞膜的破损直接会导致菌株的死亡[37-38],对经过冷冻干燥后的植物乳杆菌LIP-1 进行染色,如图4所示,红色荧光代表经真空冷冻干燥处理后已死亡的菌,而绿色荧光代表依然存活的菌。
试验组的菌株比对照组的存活率更高,即发绿色荧光更多,红色荧光较少。这一结果与冻干后细胞存活率相一致,试验组显著高于对照组。这说明经冷冻干燥处理后,试验组的菌体细胞膜完整性保持得较好;而对照组细胞膜的完整性遭到破坏,细胞活性降低。
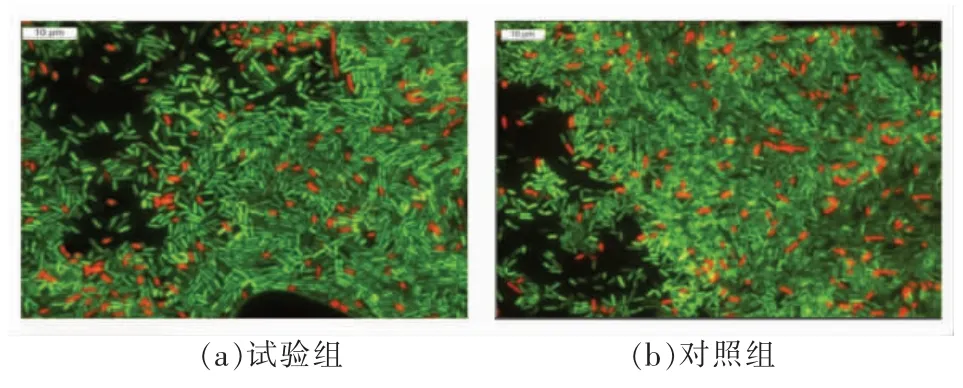
图4 不同初始pH 值培养对冷冻干燥后LIP-1细胞膜完整性的影响Fig.4 Effect of different initial pH on the cell membrane integrity of LIP-1 after freeze-drying
因为试验组经初始pH 6.8 的培养,LIP-1 长久处于低酸生长环境下,促进了环丙烷脂肪酸和不饱和脂肪酸的合成,使菌株细胞膜维持了良好的流动性,保持了细胞膜较好的完整性,有效减轻了冷冻干燥对菌株细胞造成的损伤,因此乳酸菌的抗冷冻干燥活性得到提高。Jin 等[39]研究发现,当细菌面临低pH 值环境时,细胞壁完整性会增强,这与本试验结果相一致。
2.5 不同初始培养pH 值对冻干植物乳杆菌LIP-1 细胞酶活性的影响
2 种不同初始pH 值的培养对冷冻干燥菌体的各种关键酶的酶活力有不同程度的影响,试验组与对照组具体结果如下。
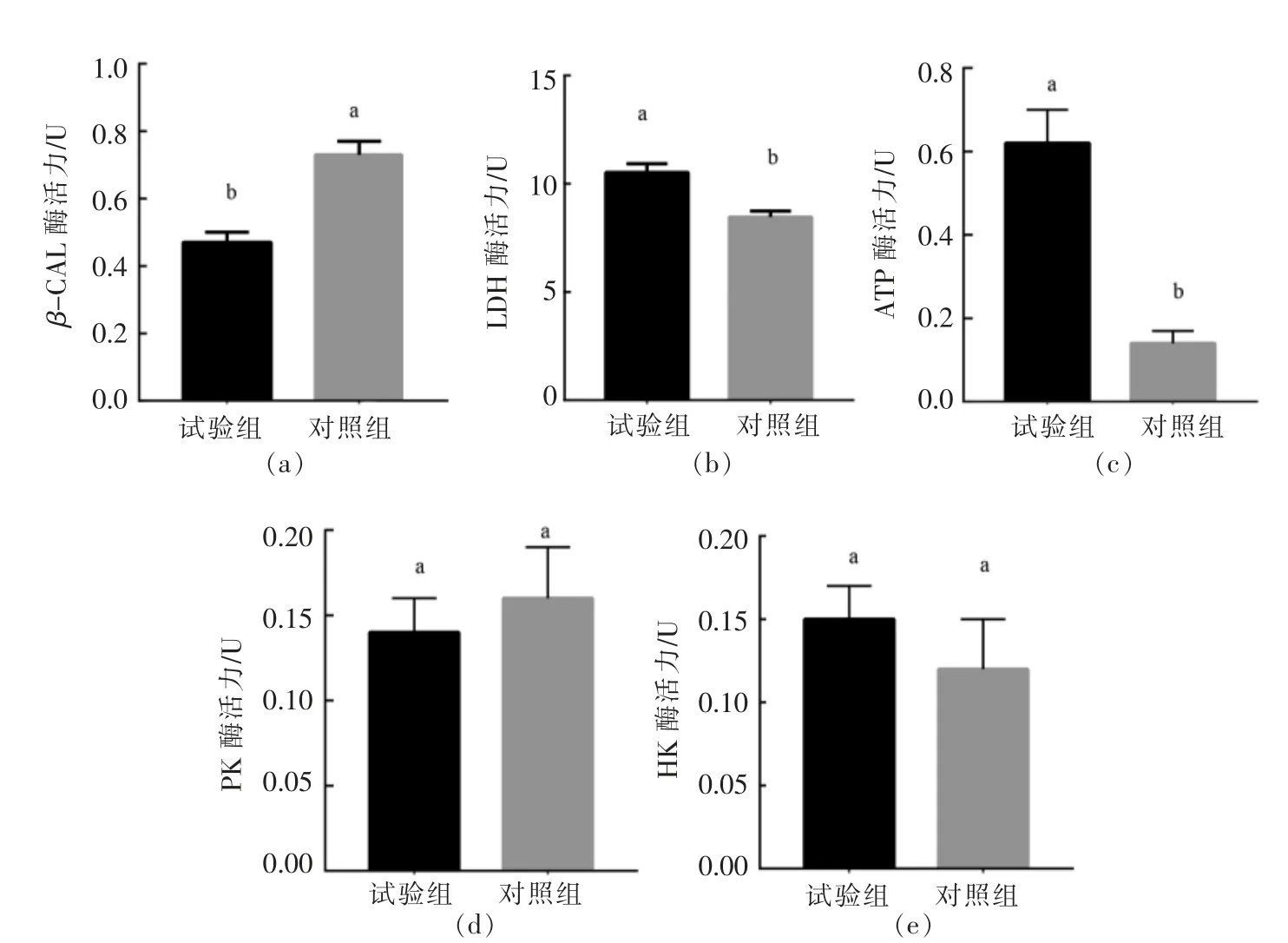
图5 不同初始pH 值培养对冷冻干燥后植物乳杆菌LIP-1 酶活力的影响Fig.5 Effects of different initial pH cultures on enzyme activity of Lactobacillus plantarum LIP-1 after freeze drying
β-半乳糖苷酶(β-GAL)是胞内酶,与菌株的发酵速率以及细胞膜通透性相关[40],它是反映细胞冷冻干燥损伤的关键酶。如图5a 是在冻干处理后β-半乳糖苷酶泄漏到细胞膜外的情况,结果发现,对照组显著高于试验组,约为1.5 倍,即试验组胞外的β-GAL 泄漏量较少,说明经初始pH 6.8培养的LIP-1 细胞膜的完整性维持较好,这与图4试验结果相一致。
乳酸脱氢酶(LDH)是乳酸菌代谢的关键酶,LDH 可催化丙酮酸还原为乳酸,其活力的大小可以从侧面反映出菌体活力的大小。经测定可知试验组活性为10.52 U,显著大于对照组8.46 U,说明初始pH 6.8 的培养维持了LDH 的活力。此外,H+-ATP 酶对维持细胞的正常生理功能起着极其重要的作用,本试验也测定了不同初始pH 值培养后的试验组与对照组ATP 酶的活力,发现试验组与对照组相比较具有显著性差异(P<0.05)。试验组的H+-ATP 酶活性约是对照组的4.4 倍。与对照组相比,试验组菌株在低酸环境中,为响应酸胁迫,LIP-1 保持了更高的H+-ATP 酶活性,通过消耗胞内ATP,排出胞内H+,更好地保持了胞内pH值的动态平衡从而维持细胞活性。在Matsumoto等[41]的研究中,乳酸菌在低酸环境培养一定时间后发现,H+-ATP 酶活性得到提高,与本研究结果一致。此外,有研究证实菌的冻干存活和LDH 与ATP 酶活性之间存在正相关性[42],本试验中试验组的2 种酶活性显著高于对照组,冻干存活率也更高。
由图5可知,经不同初始pH 值对菌进行培养,经冷冻干燥处理后,试验组的丙酮酸激酶(PK)活力0.14 U 和对照组的酶活力0.16 U 相比无显著性差异。这说明虽经不同初始pH 值培养,但冷冻干燥后PK 的活力变化不大,可能由于PK并不是影响乳酸菌在冷冻干燥过程中损伤的关键代谢酶[43],pH 的改变并未对PK 的活力有所调节。对己糖激酶(HK)活性进行测定发现,试验组与对照组HK 活力分别为0.15,0.12 U。虽有所不同,但无显著性差异,这一结果说明,不同初始pH 值的培养对冻干菌体细胞的HK 活性影响不大。
综上所述,经初始pH 6.8 培养的LIP-1 维持细胞活性的相关酶活显著高于经初始pH 7.4 组。因为试验组的细胞完整性更强,为细菌细胞抵御外界恶劣环境提供重要的保护,减少了冷冻干燥过程对植物乳杆菌LIP-1 胞内酶的影响,因此更好地保持了细胞内酶活性及菌体细胞的正常生理功能,从而有效提高了菌株的抗冷冻干燥活性。
3 结论
利用不同初始培养pH 值,在优化培养基的基础上对植物乳杆菌LIP-1 进行培养,经真空冷冻干燥处理,结果发现:在初始pH 6.8 的培养条件下(试验组),植物乳杆菌LIP-1 的抗冷冻干燥活性更强。其高密度发酵活菌数为9.79 lg(CFU/mL),经冷冻干燥后的存活率达到81.76%,与对照组相比显著提高了9.33%。通过对比分析菌体细胞膜脂肪酸成分含量的变化可知,试验组细胞膜有更高的环丙烷脂肪酸含量及更高的不饱和度。同时对相关酶活性的测定表明,试验组与对照组的己糖激酶和丙酮酸激酶的活性并无显著变化,但对于冷冻干燥损伤的主要代谢酶β-半乳糖苷酶、乳酸脱氢酶和ATP 酶来说,试验组酶活显著高于对照组(P<0.05)。
本研究表明不同初始培养pH 值会影响菌株的抗冷冻干燥活性。其影响机理可能是:在适宜初始培养pH 值条件下,植物乳杆菌LIP-1 生长迅速,pH 值下降较快,菌株长久处于低酸环境下,长时间的酸胁迫促进了细胞膜环丙烷脂肪酸的合成以及饱和脂肪酸向不饱和脂肪酸的转化,改变了细胞膜脂肪酸的组成,使菌株细胞膜在低温环境下保持了良好流动性,有效减轻了冷冻干燥对菌体细胞膜造成的损伤,从而保持了细胞膜较好的完整性,减少了冷冻干燥对植物乳杆菌LIP-1 胞内酶的影响,维护了细胞内酶活性及菌体细胞的正常生理功能,从而有效提高了菌株的抗冷冻干燥活性。本研究可为工业生产中菌株的抗冷冻干燥性的提高提供一定的理论参考。
