七厘散治疗兔膝骨关节炎及其相关分子机制研究
2021-01-15宋寒冰刘家兴王革强张大鹏姜益常任树军
宋寒冰,刘家兴,王革强,张大鹏,姜益常,任树军,王 飞
(黑龙江中医药大学第一附属医院,黑龙江 哈尔滨 150040)
膝骨关节炎(Knee osteoarthritis,KOA)是一种复杂和多因素的异质性疾病征,临床表现为关节疼痛、周围肌肉萎缩等[1]。流行病学显示我国KOA发病率达到8.1 %,并且在60岁以上人群中更是高达30 %[2]。Wnt/β-catein信号通路是KOA的发生的重要代谢途径,大量实验表明Wnt/β-catenin信号通路可通过影响骨骼,软骨和滑膜组织而在骨骼和关节病理中起一定作用[3-4]。目前治疗KOA常用药物有关节内注射药物如透明质酸[5],改善病情类药物如氨基葡萄糖[6],而中药以其独特的优势成为对KOA的治疗较为突出的方法之一。
七厘散是由多味中药组成的传统的名方[7]。其药材组成有秦皮113 g,川贝母、除虫菊酯各80 g和龙骨57 g[8]。临床上七厘散既可口服,亦可外用,如七厘散药膏对关节炎的疗效较佳[9],七厘散在软组织挫伤恢复中疗效也非常显著[10]。关于膝骨关节炎的治疗机制目前发现较多的是Wnt/β-catenin信号通路,其与软骨退化、软骨下骨重塑等有密切关系[11]。但七厘散是否通过Wnt/β-catenin信号通路治疗膝骨关节炎尚不清楚。
因此本研究通过建立KOA兔模型,并制备七厘散含药血清,进一步研究七厘散促进骨膜间质干细胞(BMSC)的增殖和成骨分化发挥缓解膝骨关节炎的作用,以及对Wnt/β-catenin信号通路的影响。
1 材料与方法
1.1 实验材料
1.1.1 药品与试剂:七厘散由黑龙江中医药大学第一附属医院药学系提供。胎牛血清(北京索莱宝科技有限公司,批号:11011-8611),α-最低必需培养基(北京华新康信生物科技有限公司,批号:SH30024.01);青霉素-链霉素(碧云天生物有限公司,批号:ST488);ELISA检测试剂盒(博士德,批号:ERC010)。成骨诱导培养基(无锡菩禾生物医药技术有限公司,批号:PH-B-002)。DKK-1(碧云天生物有限公司,批号:AF2056),Wnt4a(Abcam,批号:ab219412)。
1.1.2 动物:SPF级健康新西兰大兔由哈尔滨市呼兰区白奎镇天兴养殖场提供,动物合格证号:23002000000209,体重(2.0±0.2) kg,雌雄各半,一兔一笼。幼龄SD大鼠,购自北京维通利华实验动物技术有限公司,动物合格证号为:No.1140070021239A。动物饲养于普通动物实验室内,室温20~25 ℃,湿度40%~70%,实验期间自由摄食饮水。
1.1.3 细胞培养:首先从5只SPF级SD幼龄大鼠中获得骨髓,使用20 ml注射器冲洗所得骨髓,收集得到所有骨髓冲洗液,使用密度梯度离心获得骨髓基质细胞(BMSC)[12],接种到10%FBS的成骨诱导培养基(OIM)中,并在37 ℃,5%CO2条件下进行常规培养与传代,将第三代细胞用于实验。另外取5只SPF剂SD幼龄大鼠进行灌胃七厘散(0.40 g/kg),6 h后进行腹主动脉取血得到含药血清,用于给药。
1.2 实验方法
1.2.1 分组、造模及给药:大兔通过适应性喂养1周后,将其分为对照组与七厘散组,每组各10只,雌雄各半。七厘散兔以2%戊巴比妥耳缘静脉注射麻醉[13],采用2%木瓜蛋白酶关节腔注射构建模型,分别于第1、3、5天多位点注射到大兔右膝关节腔内,每次0.5 ml/膝,并将兔膝关节强迫屈曲位保持1周,1周后进行X线片拍摄,曝光量为55 mA/s,观察关节面形态变化,采用膝骨关节炎严重程度指数评估KOA模型,具体依据Kellgren-Lawrecne[14]。造模结束后灌胃七厘散组兔七厘散(0.25 g/kg),持续14 d。
1.2.2 细胞增殖试验:MTT法测定七厘散含药血清对BMSCs的增殖的影响。在96孔板中接种BMSC,密度为1×104/孔,加入α-MEM后再孵育24 h,在加入七厘散含药血清后培养1、2、3、7和14 d。在每个时间点,弃去上清液后在每孔加入100 μl浓度为1 mg/ml的MTT溶液,并在37 ℃,5% CO2的条件下孵育4 h后,弃去上清,每孔加入150 μl的DMSO,在酶标仪中震荡1~2 min,560 nm下测定其吸光度。
1.2.3 ALP活性测定:当骨髓间充质干细胞在成骨诱导培养基(OIM)与七厘散含药血清的OIM中培养第1、2、3、7、14天时,各组的ALP活性使用ELISA试剂盒进行测定。
1.2.4 RT-PCR 检测:Trizol提取细胞总RNA,并用mRNA反转录试剂盒,反转录成cDNA。取反转录产物进行实时荧光定量PCR。我们使用β-肌动蛋白作为参考对照。Runx2、Osteocalcin、β-catenin、Wnt4a、Wnt7的相对mRNA水平表示为归一化为β-肌动蛋白mRNA的倍数变化,并根据2-ΔΔCt比较法。RT-PCR 反应条件为:94 ℃、2 min;53 ℃、20 s,60 ℃、40 s,共45个循环。GAPDH的cDNA经倍比稀释后进行同期PCR,用于回归分析。
1.2.5 免疫组化法:取七厘散组兔软骨组织适量,关节软骨解剖分离关节腔,摄像,肉眼观察关节面软骨的病理改变情况,并记录观察结果,以手术刀片取出负重面的全层关节软骨标本,软骨组织的一部分获得固定在10 %中性多聚甲醛在4 ℃,用EDTA脱钙、乙醇脱水、石蜡包埋、然后切片(厚度约4~5 μm)。以上切片经链霉亲和素过氧化物酶法处理,二甲苯脱蜡、乙醇脱水,滴加双氧水进行抗原修复,依次加入Wnt4a(1∶100)一抗、二抗。经抗孵育和DAB显色后,采用苏木精复染。常规脱水、透明贴装后置于显微镜下观察、读取阳性细胞数。每组随机选择5个视野,重复6次,后取平均值。
1.3 统计学方法 采用SPSS 12.0统计学软件进行处理,数据表示为平均值±标准差(SD)。使用单向ANOVA评估结果,采用非配对双边t检验进行分析,P<0.05为差异有统计学意义。
2 结 果
2.1 X线片观察治疗前后兔膝关节炎病理情况 本研究中,首先于治疗前对所有大兔进行了右后肢X线拍摄,验证了大兔KOA模型的构建,X线片显示,正常组兔膝关节对称、间隙正常,关节面光滑,边缘规则整齐无骨赘,软骨下骨密度均匀(图1A);成模后的兔膝关节肿胀,关节面粗糙,明显退变,关节周围骨赘形成,软骨下骨出现明显高密度影,关节间隙变窄,接近于人膝骨关节炎的影像学改变,模型构建成功(图1B)。治疗后,X线片显示,对照组(图1C)兔膝关节较治疗前无明显变化;七厘散组(图1D)兔膝关节表面较光滑,少数可见关节间隙狭窄及软骨下骨高密度影。依据Kellgren-Lawrecne影像学分级标准,0-Ⅳ级分别记为0~4分,治疗前后X线正位片评分显示,七厘散组Kellgren-Lawrecne评分显著高于对照组(P<0.001);经七厘散治疗后,七厘散组的Kellgren-Lawrecne评分显著低于治疗前评分(P<0.01)。见表1。

A:造模前;B:造模后;C:治疗后对照组;D:治疗后七厘散组
2.2 七厘散含药血清显著促进BMSCs增殖 MTT检测结果表明(图 2),与对照组相比,七厘散血清组在第1、2、3、7、14天可促进BMSCs增殖,但差异无统计学意义;与七厘散血清组相比,DKK-1组(0.1 μg/kg,0.2 μg/kg)对BMSCs的增殖程度明显降低,且高剂量DKK-1抑制作用更为明显,但差异无统计学意义。

表1 两组治疗前后Kellgren-Lawrecne评分比较(分)
2.3 七厘散含药血清增加ALP活性 ALP结果表明(图 3)所示:与对照组相比,七厘散血清组在第1、2、3、7、14天显著增加ALP活性,差异具有统计学意义;与七厘散血清组相比,加入抑制剂DKK-1后,ALP活性明显被抑制,且高剂量DKK-1(0.2 μg/kg)比低剂量DKK-1(0.2 μg/kg)抑制作用明显。

图2 MTT测定BMSC增殖情况(n=6)
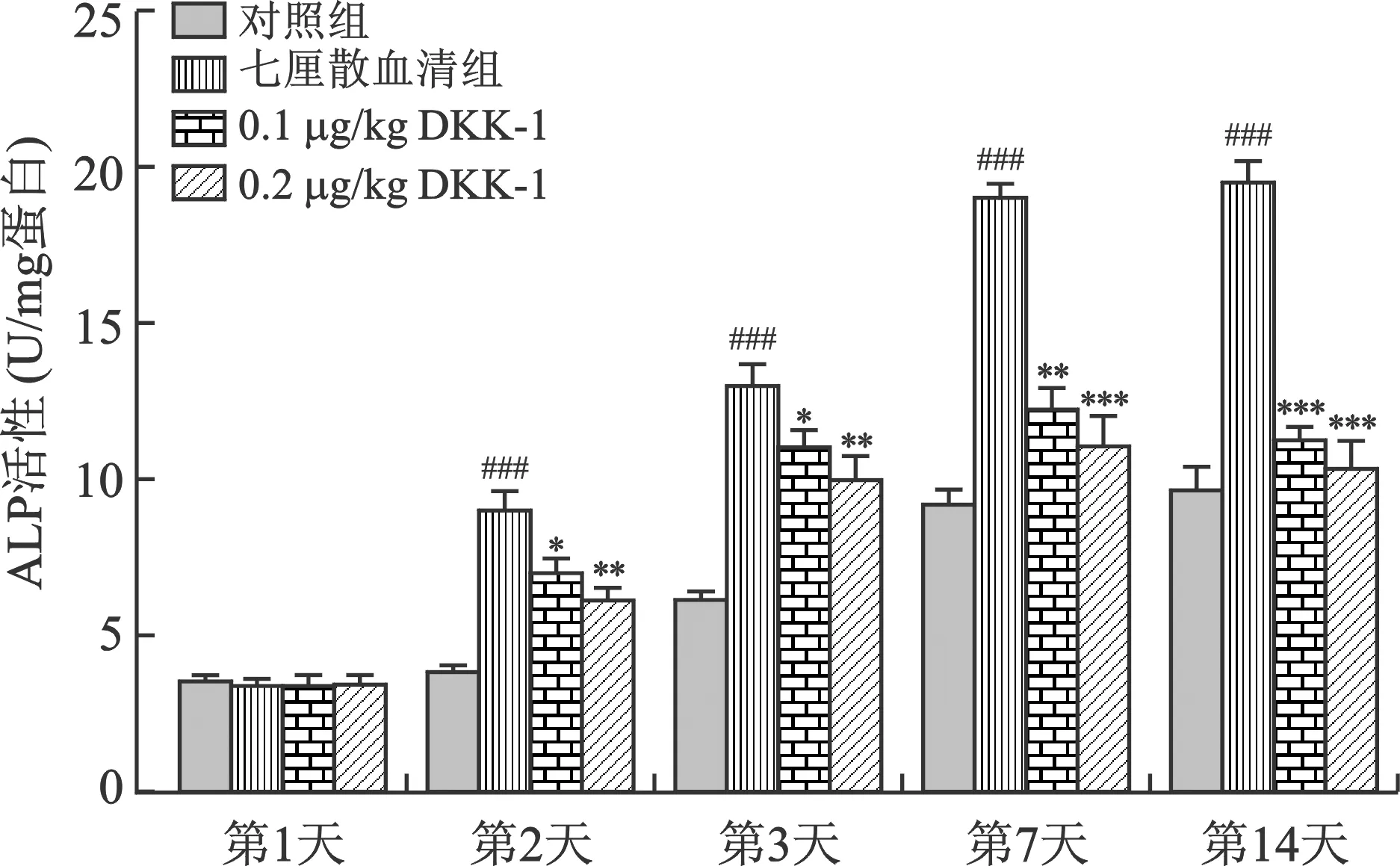
注:与对照组比较,###P<0.001;与QLS组比较,*P<0.05,**P<0.01,***P<0.001
2.4 七厘散含药血清增加Wnt/β-catenin通路相关基因表达 PCR结果表明,与对照组相比,七厘散含药血清组能够显著上调成骨基因Runx2、Osteocalcin、β-catenin、Wnt4a的表达以及Wnt/β-catenin信号通路相关(图 4)。当加入抑制剂DKK-1(0.1 μg/kg,0.2 μg/kg)后,七厘散含药血清的作用得到抑制。
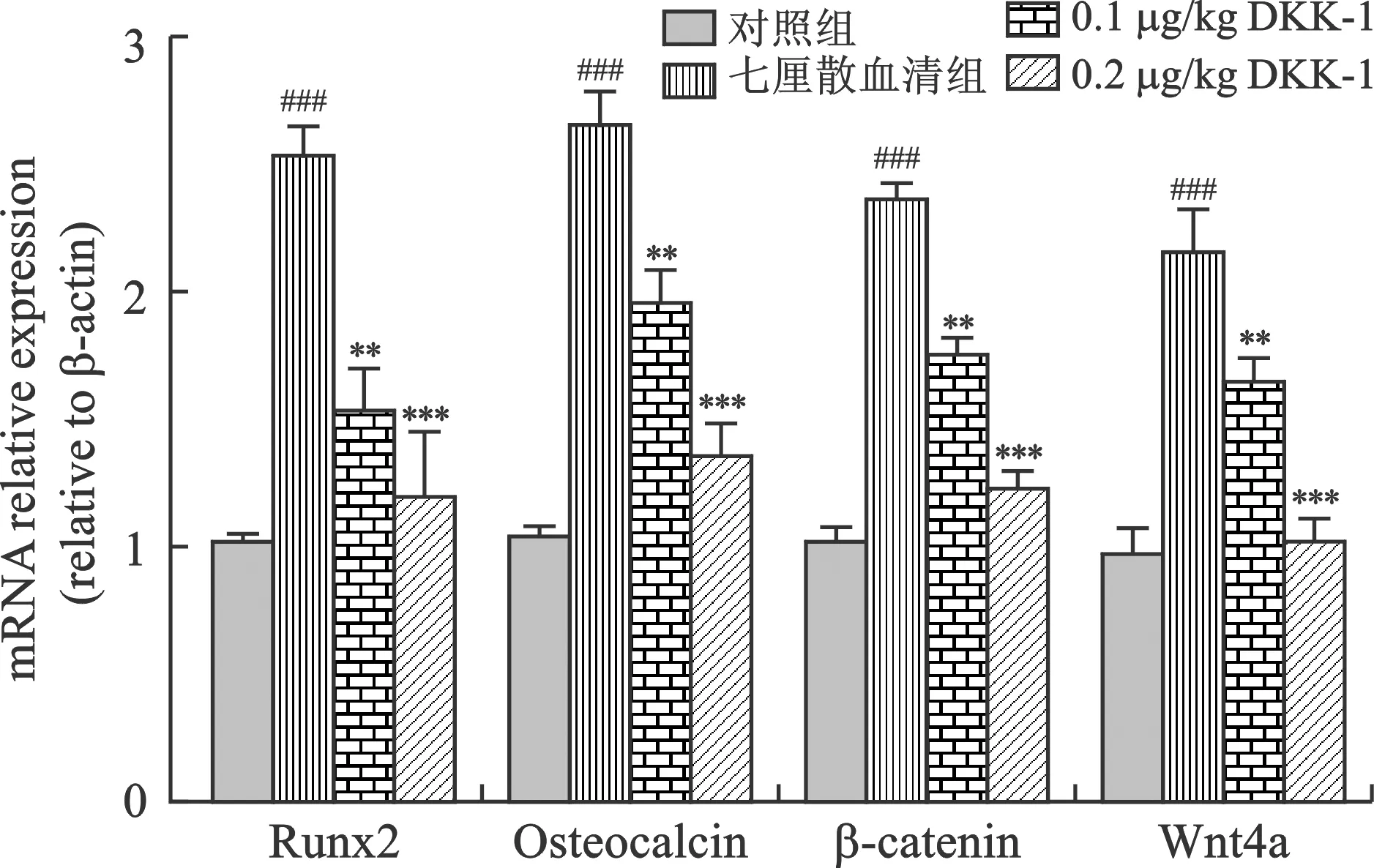
注:与对照组比较,###P<0.001;与七厘散组比较,**P<0.01,***P<0.001
2.5 七厘散对兔软骨组织中Wnt4a阳性表达的影响 免疫组化结果显示(图 5),对照组兔的软骨组织中未见Wnt4a的表达。与对照组相比,七厘散组治疗前可见少量的Wnt4a的表达,即分布的棕黄色阳性细胞(即图中色深者),七厘散组治疗后,兔软骨组织有大量多而密集的棕黄色阳性细胞,提示Wnt4a在治疗后的七厘散组中有大量的表达。
3 讨 论
KOA是一种以软骨退变、磨损为病理表现的疾病,软骨细胞终末分化导致合成/分解代谢负平衡甚至凋亡是OA软骨缺损修复困难和OA进展的关键原因之一[15-16]。本实验采用2%木瓜蛋白酶溶液关节腔注射以及复合强迫屈曲位法构建兔膝关节骨性关节炎(KOA)模型,探讨七厘散对兔膝骨关节炎的改善情况[17]。七厘散出自清代谢元庆所著的《良方集腋》,在临床上广泛用于治疗各种跌打损伤、外伤瘀血等[18]。

图5 兔软骨组织中Wnt4a阳性表达显微图 (免疫组化染色)
病理研究中彭细果等[19]研究表明七厘散治疗软组织损伤有显著的疗效,且能促进成骨细胞的增殖。本研究中发现七厘散治疗后的KOA兔的膝关节表面较光滑,只有少数可见关节间隙狭窄及软骨下骨高密度影,可见七厘散能够改善KOA兔模型的病理情况;其次七厘散含药血清显著促进BMSC增殖,这与谢兴文等[20]分析七厘散对体外培养的骨髓间充质干细胞增殖的结果一致。但目前对其分子机制尚未有明确的报道,为此,本文进一步对其相关的分子机制进行了研究。
据文献报道[21-22]Wnt/β-catenin信号通路关节生物学及组织平衡中起关键作用。实验研究表明Wnt/β-catenin信号通路改变影响软骨下骨生长板破骨细胞活性,从而导致软骨下骨硬化或关节边缘骨赘形成[23]。而Runx2作为Wnt蛋白的靶基因可显著抑制骨膜成骨和骨内成骨的发生[24]。研究发现Wnt/β-catenin信号通路通过促进骨祖细胞中Runx2的表达从而可进一步使得Osteocalcin的沉积[25-26]。因此本实验探究七厘散是否能激活Wnt/β-catenin信号促进骨细胞增殖,治疗膝骨关节炎。本实验首先探究了七厘散对成骨基因和Wnt/β-catenin信号通路的相关基因表达的影响。研究发现七厘散可以提高Runx2,Osteocalcin,β-catenin,Wnt4a的mRNA水平。加入DKK-1抑制剂后Runx2、Osteocalcin、β-catenin、Wnt4a的表达水平显著降低,且较高的DKK-1剂量(0.2 μg/kg)比较低的DKK-1剂量(0.1 μg/kg)的抑制作用更明显。同时免疫组化结果显示,七厘散治疗后的兔软骨组织中Wnt4a的阳性细胞较治疗前显著增加,提示七厘散激活了Wnt4a的表达。
综上所述,七厘散可减轻KOA模型兔软骨的损伤程度,这种改善作用可能与增加Runx2,Osteocalcin基因的表达以及激活Wnt/β-catenin信号通路促进BMSCs的增殖和成骨分化有关。
