升降散对脓毒症小鼠细胞炎症因子抑制作用的研究*
2015-01-04钱风华祁丽丽夏一春钱义明
朱 亮 赵 雷 钱风华 祁丽丽 夏一春 钱义明 奚 耀
(上海中医药大学附属岳阳中西医结合医院,上海 200437)
·研究报告·
升降散对脓毒症小鼠细胞炎症因子抑制作用的研究*
朱 亮 赵 雷 钱风华 祁丽丽 夏一春 钱义明 奚 耀△
(上海中医药大学附属岳阳中西医结合医院,上海 200437)
目的观察中药升降散对脓毒症小鼠炎症细胞因子干扰素-γ(IFN-γ)、转化生长因子-β(TGF-β)、白介素-4(IL-4)和白介素-6(IL-6)的抑制作用。方法72只小鼠随机分为对照组、脓毒症组与升降散组,脓毒症造模后比较升降散干预前后不同时间段各组小鼠IFN-γ、TGF-β、IL-4和IL-6水平的变化。结果IFN-γ水平24 h内脓毒症组呈逐渐上升趋势,升降散组呈逐渐下降趋势,12 h和24 h脓毒症组显著高于升降散组(P<0.01)。TGF-β水平24 h内升降散组均呈逐渐下降趋势,各时段均低于脓毒症组(P<0.05或P<0.01)。IL-4水平24 h内升降散组和脓毒症组呈逐渐下降趋势,24 h升降散组低于脓毒症组和对照组 (P<0.05或P<0.01)。IL-6水平24 h内升降散组和脓毒症组均呈逐渐下降趋势,各时段脓毒症组均高于升降散组和对照组(P<0.01),各时段升降散组均显著高于对照组(P<0.01)。结论升降散具有抑制脓毒症小鼠炎症细胞因子IFN-γ、IL-4、TGF-β和IL-6的作用。
脓毒症 升降散 炎症细胞因子 IFN-γ TGF-β IL-4 IL-6
脓毒症(Sepsis)是感染引起的全身性炎症反应综合征(SIRS),进一步可发展为严重脓毒症、脓毒性休克及多器官功能障碍,采用集束化治疗方案可得到一定控制,但病死率仍然高达30%~70%[1]。目前研究热点主要是以SIRS为理论基础的炎症反应及炎症细胞因子。本研究应用中药升降散对脓毒症小鼠进行干预,探讨升降散对炎症细胞因子干扰素-γ(IFN-γ)、转化生长因子-β(TGF-β)、白介素-4(IL-4)和白介素-6(IL-6)水平的调控作用。现报告如下。
1 材料与方法
1.1 实验动物 SPF级健康雄性BALB/c小鼠72只,6~8周,体质量(20±2)g,由上海中医药大学动物实验中心提供。
1.2 药物与试剂 升降散由僵蚕6 g,蝉蜕3 g,姜黄3 g和大黄12 g组成,由本院制剂室配制。细胞分离纯化相关试剂:磷酸缓冲液 PBS,RPMI-1640培养液,PBMC分离液,红细胞裂解液,胎牛血清(FBS)等,均由上海中医药大学提供。IFN-γ、IL-4、TGF-β、IL-6 Elisa试剂盒,由上海欣博盛生物科技有限公司提供。
1.3 实验仪器 数字显示隔水式电热恒温培养箱(PYX-DHS),上海跃进医疗器械厂出品;高速离心机(TGL-168),上海安亭科学仪器厂出品;漩涡混合器(XW-80A),上海青浦沪西仪器厂出品;连续分液器,美国TOMOS LIFE SCIENCE Group公司出品。酶标仪(DENLEY DRAGON Wellscan MK 3)和洗板机(Wellwash 4 MK2),均由芬兰Thermo出品。
1.4 分组与造模 按随机数字表法分为正常对照组(对照组)8只、脓毒症组24只和中药升降散治疗组(升降散组)24只,后两组再分为术后6、12 h和24 h 3个时间段亚组(各8只)。小鼠造模前72 h开始每日灌胃2次,升降散组给予升降散12 mL/kg,其余各组以等量生理盐水灌胃,连续3 d。制备盲肠结扎穿孔脓毒症模型(CLP模型),以50 mg/kg戊巴比妥钠麻醉后沿腹正中线作1.5 cm长的切口,在盲肠根部结扎盲肠;用18号针在盲肠上穿通3次形成盲肠漏,随后将盲肠还纳腹腔,逐层缝合腹壁切口。术毕,立即予生理盐水50 mL/kg抗休克。
1.5 标本采集与检测 断颈法处死小鼠,延左侧肋弓切开肌层,摘取脾脏后取适量脾脏标本用于检测IFN-γ、TGF-β、IL-4和IL-6的水平。将小鼠脾脏淋巴细胞分离与纯化,细胞样本的标记、细胞表面抗原及细胞内染色后,配置标本稀释液、标准品液、洗涤液,加样、洗板,加入蒸馏水和第一抗体工作液 (空白除外);再洗板,加酶标抗体工作液,再洗板,加底物工作液,加终止液混匀;用酶标仪在450 nm处测吸光值。用ELISA方法分别检测不同时间段IFN-γ、TGF-β、IL-4和IL-6的水平。
1.6 统计学处理 应用SPSS19.0统计软件分析。计量资料以(±s)表示,如符合正态分布和方差齐性采用t检验,如不符合正态分布和方差齐性则采用非参数秩和检验。P<0.05为差异有统计学意义,P<0.01表示差异有显著统计学意义。
2 结 果
2.1 各组小鼠各时间段IFN-γ和TGF-β变化的比较见表1。IFN-γ水平24 h内脓毒症组呈逐渐上升趋势,升降散组呈逐渐下降趋势;6 h时升降散组与对照组、脓毒症组差异无统计学意义(P>0.05),脓毒症组高于对照组(P<0.05);12 h和24 h脓毒症组均显著高于升降散组和对照组(P<0.01),升降散组与对照组差异无统计学意义(P>0.05)。TGF-β水平24 h内升降散组呈逐渐下降趋势;各时段升降散组和对照组均低于脓毒症组 (P<0.05或P<0.01),6 h和12 h升降散组显著高于对照组(P<0.01),24 h升降散组与对照组差异无统计学意义(P>0.05)。
表1 各组小鼠各时间段IFN-γ和TGF-β水平比较(pg/mL,±s)
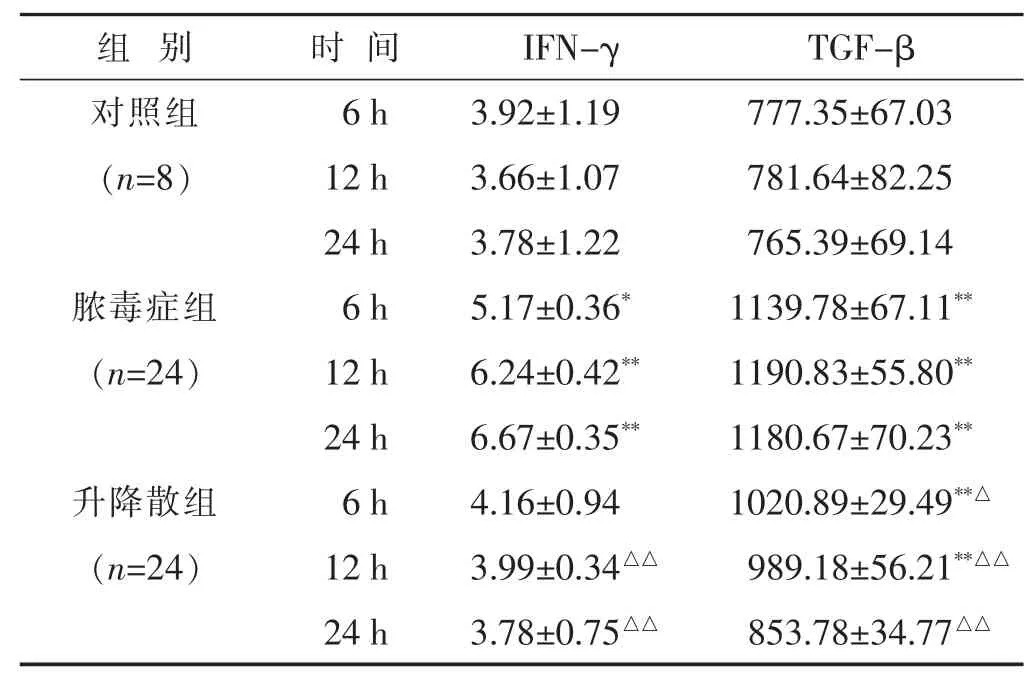
表1 各组小鼠各时间段IFN-γ和TGF-β水平比较(pg/mL,±s)
与对照组同时期比较,*P<0.05,**P<0.01;与脓毒症组同时期比较,△P<0.05,△△P<0.01。下同。
组别 时间 I F N -γ T G F -β对照组 6 h 3 . 9 2 ± 1 . 1 9 7 7 7 . 3 5 ± 6 7 . 0 3(n = 8) 1 2 h 3 . 6 6 ± 1 . 0 7 7 8 1 . 6 4 ± 8 2 . 2 5 2 4 h 3 . 7 8 ± 1 . 2 2 7 6 5 . 3 9 ± 6 9 . 1 4脓毒症组 6 h 5 . 1 7 ± 0 . 3 6*1 1 3 9 . 7 8 ± 6 7 . 1 1**(n = 2 4) 1 2 h 6 . 2 4 ± 0 . 4 2**1 1 9 0 . 8 3 ± 5 5 . 8 0**2 4 h 6 . 6 7 ± 0 . 3 5**1 1 8 0 . 6 7 ± 7 0 . 2 3**升降散组 6 h 4 . 1 6 ± 0 . 9 4 1 0 2 0 . 8 9 ± 2 9 . 4 9**△(n = 2 4) 1 2 h 3 . 9 9 ± 0 . 3 4△△9 8 9 . 1 8 ± 5 6 . 2 1**△△2 4 h 3 . 7 8 ± 0 . 7 5△△8 5 3 . 7 8 ± 3 4 . 7 7△△
2.2 各组小鼠各时段IL-4、IL-6水平的比较 见表2。IL-4水平24 h内升降散组和脓毒症组均呈逐渐下降趋势;6 h各组间差异无统计学意义 (P>0.05),12 h升降散组低于对照组(P<0.05),脓毒症组与对照组、升降散组差异无统计学意义(P>0.05),24 h升降散组低于对照组和脓毒症组(P<0.05或P<0.01)。IL-6水平24 h内升降散组和脓毒症组均呈逐渐下降趋势,各时段脓毒症组均显著高于升降散组和对照组 (P<0.01),各时段升降散组均显著高于对照组(P<0.01)。
表2 各组小鼠各时间段IL-4和IL-6水平比较(pg/mL,±s)

表2 各组小鼠各时间段IL-4和IL-6水平比较(pg/mL,±s)
组别 时间 I L -4 I L -6对照组 6 h 2 0 . 5 8 ± 3 . 9 4 2 . 4 0 ± 0 . 2 9(n = 8) 1 2 h 2 1 . 3 7 ± 4 . 4 2 2 . 5 6 ± 0 . 3 2 2 4 h 2 0 . 8 9 ± 6 . 9 7 2 . 3 3 ± 0 . 3 9脓毒症组 6 h 2 0 . 0 5 ± 4 . 7 4 5 4 5 . 8 5 ± 4 6 . 6 4**(n = 2 4) 1 2 h 1 6 . 6 7 ± 2 . 3 7 4 2 7 . 7 3 ± 6 3 . 1 5**2 4 h 1 6 . 3 4 ± 0 . 7 0 2 2 2 . 5 5 ± 1 5 . 8 6**升降散组 6 h 1 5 . 8 1 ± 3 . 3 2 2 4 8 . 9 6 ± 4 6 . 8 5**△△(n = 2 4) 1 2 h 1 4 . 2 5 ± 1 . 0 9*1 8 4 . 6 4 ± 1 8 . 8 9**△△2 4 h 1 3 . 3 0 ± 1 . 1 8**△9 7 . 2 6 ± 1 0 . 7 8**△△
3 讨 论
在脓毒症状态下,病原体入侵机体后通过一系列途径引起炎症介质级联“瀑布式”的释放反应,促炎因子大量释放的同时还伴有抗炎因子的合成和释放,导致机体炎症反应失衡,使机体处于抗炎症反应综合征(CARS)状态,即“免疫麻痹”。 脓毒症患者处于免疫麻痹状态时抵抗力下降,不能有效清除病原体,易导致二重感染,随着脓毒症持续进展,最终引起机体免疫功能的紊乱[2]。其中,活化的CD4+T辅助淋巴细胞(CD4+Th)起了十分重要的作用。T辅助细胞1(Th1细胞)、Th2细胞和调节性T细胞(regulatory T cell,Treg)是从属于CD4+Th的不同亚群。Th1细胞相关受体被抗原提呈细胞激活后表达T-bet,产生IL-12,激活NK细胞,主要分泌IL-2、IFN-γ及TNF-α等因子[3],促进细胞毒性T细胞、NK细胞以及巨噬细胞活化和增殖,介导细胞免疫应答[4]。Th2细胞的分化则是由抗原及IL-4R信号启动,通过STAT6途径上调T细胞转录因子GATA3的表达,主要分泌IL-4、IL-6、IL-10和IL-13等因子,介导体液免疫、B细胞和嗜酸性粒细胞活化以及IgE的生成[5]。Treg细胞表达Foxp3,主要产生TGF-β、IL-10和IL-35等因子,在脓毒症等状态下可表达高水平的膜结合性TGF-β1,上调Treg细胞比例,进而通过Treg细胞对免疫应答的负反馈调节作用来抑制T细胞介导的细胞免疫功能[6]。另外,近期发现的Th17细胞则是一组表达特异性转录因子RORγt,分泌IL-17为主,也分泌IL-21、IL-2、IL-6及TNF-α等因子的亚群[7]。促炎因子主要有TNF-α、IFN-γ、IL-1和IL-6等,主要由Th1和Th17细胞分泌;抗炎因子主要有TGF-β、IL-4、IL-10和IL-13等[8],主要由Th2和Treg细胞分泌。促炎和抗炎因子的相互制约维持平衡对于机体内环境保持稳定具有重要意义。研究证明[9],脓毒症时促炎因子和抗炎因子同时升高提示预后不佳,可能与免疫反应的极度紊乱有关。因此,对脓毒症早期药物干预的重点在于调节促炎和抗炎因子的平衡,以降低或消除炎症反应过度或抗炎反应过度(免疫麻痹)状态,而维持Th1/Th2、Th17/Treg的动态平衡则决定了促炎和抗炎因子的制约和平衡。
在中医学理论中无“脓毒症”名称,根据其症状及演变过程,一般归属于“温病”、“外感”等范畴[10]。升降散由僵蚕、蝉蜕、姜黄和大黄组方,功用为升清降浊、散风清热,是治疗温病的经典方。升降散向上宣发郁热,向下降泄浊气,使毒热、瘀血、痰浊等病理产物排出体外,邪祛正存,阴阳得以平衡。药理研究证实,僵蚕有改善凝血、抗血栓等作用,可抑制革兰阳性菌和真菌,并促进肾上腺皮质分泌[11];蝉蜕能降低实验动物的毛细血管通透性,明显抑制非特异性免疫和细胞免疫[12]。姜黄通过减少中性粒细胞的浸润、抑制脂质过氧化反应、降低丝氨酸活性而抑制炎症反应[13];大黄可清除炎性介质,降低危重症患者血清TNF、IL和内毒素的水平,并能抑制细菌生长[14]。研究表明[15-16],在西医治疗的基础上,升降散能降低脓毒症患者TNF-α、IL-2、IL-4及IL-6等因子水平,提高IL-10水平,从促炎和抗炎两方面对炎症反应进行调控。本研究显示,促炎因子IFN-γ和IL-6水平24 h内在升降散组呈逐渐下降趋势,多个时间段低于脓毒症组,提示在脓毒症状态下升降散可抑制促炎因子的分泌,从而在初期减轻对器官和组织的损伤。另一方面,抗炎因子TGF-β和IL-4水平24 h内在升降散组也呈逐渐下降趋势,多个时段低于脓毒症组,表明升降散不仅可抑制促炎因子分泌,对抗炎因子也有一定的调节抑制作用,从降低促炎和抗炎的过度反应两方面来调节免疫反应,抑制免疫紊乱,维持免疫平衡。其机制推测为升降散通过调整炎症细胞因子水平以正反馈抑制相关Th细胞的特异性转录因子表达,在减少Th1和Th17细胞过度分化的同时也降低Th2和Treg细胞的过度分化,调节Th1/Th2、Th17/Treg的失衡,从而减缓炎症反应的失控发展。
本研究目的在于观察升降散干预脓毒症不同时间段促炎症和抗炎症细胞因子水平的变化以及对免疫失衡的调节作用,为临床上使用升降散对脓毒症患者的免疫失衡状态进行干预治疗提供有效的依据。但脓毒症时促炎和抗炎症细胞因子的变化与多种因素有关,在不同条件下相互间的促进和制约机制十分复杂,且升降散的具体作用途径尚不明确,有待进一步研究。
[1] 曹书华.脓毒症与多脏器功能失常综合征[J].中华急诊医学杂志,2010,19(7):781-782.
[2] Pen Y,Wang JD,Xia J,et al.The alterationa of mouse plasma proteins during septic devdopment[J].J proteome Res,2007,6(7):2812-2821.
[3] Trinchieri G,Sher A.Cooperation of Toll-like receptor signals in innate immune defence[J].Nat Rev Immuno,2007,7(3):179-190.
[4] 刘夫红,吴润晖.Th1/Th2及Th17/Treg细胞平衡在免疫性血小板减少症发病中的意义[J].中国小儿血液与肿瘤杂志,2013,18(2):90-92.
[5] Zheng W,Flavell RA.The transcription factor GATA-3 is necessary and sufficient for Th2 cytokine gene expression in CD4 T cells[J].Cell,1997,89(4):587-596.
[6] 尹承芬,龚平,姚咏明.脓毒症时调节性T细胞作用机制的研究进展[J].感染、炎症、修复,2013,14(1):50-53.
[7] 韩根成,沈倍奋.Th17细胞分化、调节及效应研究进展[J].生物化学与生物物理进展,2008,35(2):117-123.
[8] Calvano SE,Xiao WZ,Richards DR,et al.A network-based analysis of systemic inflammation in humans[J].Nature,2005,437(7061):1032-1037.
[9] Bozza FA,Salluh JI,Japiassu AM,et al.Cytokine profiles as markers of diseaSe severity in sepsis:a multiplex analysis[J].Crit Care Med,2007,11(2):49.
[10]王龙梅,俞兴.脓毒症的中医药治疗研究现状[J].中医药临床杂志,2013,25(9):821-823.
[11]王居祥,朱超林,戴虹.僵蚕及僵蛹的药理研究与临床应用[J].时珍国医国药,1999,10(8):637-639.
[12]Ukil A,Maity S,Karmakar S,et al.Curcumin,the major component of foof flavour turmeric,reduces mucosal injury in trinitrobenzene sulphonic acid-induced colitis[J].Br J Pharmacol,2003,139(2):209.
[13]刘文军,薛燕星,胡东鹏.升降散的现代药理机制研究进展[J].北京中医药,2012,31(12):939.
[14]张永和,宋祖军,郭学刚.大黄清除活性氧的作用[J].中国药学杂志,1996,31(8):461.
[15]夏一春,钱风华,奚耀,等.升降散对脓毒症大鼠肾功能的影响[J].上海中医药大学学报,2013,27(2):77-80.
[16]赵雷,朱亮,张微微,等.升降散对脓毒症患者的临床疗效及血清学指标的影响[J].辽宁中医药大学学报,2009,11(2):3-5.
Research on the Inhibition of Inflammatory Cytokines by Shengjiang San in Sepsis Mice
ZHU Liang,ZHAO Lei,QIAN Fenghua,et al. Yueyang Hospital of Integrated Traditional Chinese and Western Medicine,Shanghai University of T.C.M.,Shanghai 200437,China
Objective:To investigate the inhibitive effects of Shengjiang San(SJS)upon the serum levels of inflammatory cytokines IFN-γ,TGF-β,IL-4 and IL-6 in sepsis mice.Methods:72 experimental mice were randomly divided into three groups:control group of 8 cases,sepsis group of 24 cases and SJS group of 24 cases. After CLP of sepsis model,the serum levels of inflammatory cytokines IFN-γ,TGF-β,IL-4 and IL-6 were compared respectively among the three groups before and after(6 h,12 h and 24 h)SJS participation.Results:At 24 hours,the serum level of IFN-γwas increasing in sepsis group and decreasing in SJS group.In sepsis group,the IFN-γ concentration was higher than that in SJS group at 12 hours and 24 hours(P<0.01).Serum level of TGF-β was decreasing in SJS group in 24 hours.It was lower than that in sepsis group at each time point(P<0.01 or P<0.05).The serum level of IL-4 was decreasing in SJS and sepsis group in 24 hours.It in SJS group was lower than that in sepsis and control group at 24 hours(P<0.05).The serum level of IL-6 was decreasing both in SJS group and in sepsis group in 24 hours.In sepsis group,it was higher than that in SJS and control group at each time point(P<0.01).It was higher in SJS group than that in control group at each time point(P<0.01)as well.Conclusion:Chinese herb SJS may inhibit the serum levels of inflammatory cytokines IFN-γ,TGF-β,IL-4 and IL-6 in sepsis mice.
Sepsis;Shengjiang San;Inflammatory cytokines;IFN-γ;TGF-β;IL-4;IL-6
R285.5
A
1004-745X(2015)03-0384-04
10.3969/j.issn.1004-745X.2015.03.003
2014-12-08)
国家中医药管理局重点建设科室和专科;国家中医药管理局“名老中医药专家传承工作室”建设项目;上海中医药大学预算内项目(2013JW52)
△通信作者(电子邮箱:lizhiliu3@sina.com)
