Th9细胞对非小细胞肺癌患者CD8+T细胞抗肿瘤活性的调控作用
2021-01-15苏艳丽
苏艳丽,李 波
(湖北省枣阳市第一人民医院呼吸与危重症医学科,湖北 枣阳 441200)
非小细胞肺癌(Non-small-cell lung cancer,NSCLC)占肺癌的80%,其1年生存率仅10%左右[1]。针对表皮生长因子受体的靶向药物和针对免疫检查点的抑制剂为NSCLC的治疗提供了新的手段[2]。通过外源性刺激源刺激免疫细胞,可逆转其衰竭的功能状态,诱导机体产生有效的抗肿瘤免疫应答,可达到抑制NSCLC生长、减少复发和转移的目的[3]。Th9细胞是一类新鉴定的CD4+T细胞亚群,表型为CD4+CCR4-CCR6-CXCR3-,主要在转录因子PU.1的调控下分泌白细胞介素-9(Interleukin-9,IL-9),可通过调控CD8+T细胞活性发挥抗肿瘤作用[4- 5]。但有关Th9细胞对肺癌患者CD8+T细胞调控作用的研究较少。本研究检测NSCLC患者外周血及支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)中Th9细胞比例和IL-9水平,利用体外细胞培养系统观察Th9细胞对NSCLC患者CD8+T细胞抗肿瘤活性的影响。
1 资料与方法
1.1 一般资料 选择2019年2-9月枣阳市第一人民医院诊断为NSCLC的患者32例,其中男19例,女13例,年龄27~64岁,平均(48.7±13.1)岁。所有患者均进行了手术或肺活检,经病理学检查确诊为NSCLC;其中鳞癌17例,腺癌15例。根据影像学结果,中央型肺癌16例(鳞癌9例,腺癌7例),周围型肺癌16例(鳞癌8例,腺癌8例)。32例患者中,21例(鳞癌10例,腺癌11例)接受手术治疗。排除标准:①合并活动性肝炎病毒或人类免疫缺陷病毒感染的患者;②合并严重肺部感染或败血症的患者;③合并心脏、肾脏、中枢神经系统等重要脏器功能不全的患者;④自身免疫性疾病或长期接收免疫调节剂治疗的患者。患者在接受手术前均未进行放疗、化疗或免疫治疗。同时,选择2018年3-6月于枣阳市第一人民医院进行健康体检的、年龄和性别相匹配的健康对照者为对照组,其中男6例,女5例,年龄25~65岁,平均(47.2±11.8)岁。本研究通过枣阳市第一人民医院伦理委员会批准(批准文号:市一伦20180819),入组者或家属均签署知情同意书。
1.2 研究方法
1.2.1 主要试剂和仪器:Ficoll淋巴细胞分离液(美国Sigma公司);CD4+T细胞分选试剂盒、CD8+T细胞分选试剂盒(德国美天旎公司);抗CCR4-PE、抗CCR6-PE、抗CXCR3-PE、抗CD3-PerCP、抗CD4-PE、抗IL-9-APC(美国BD公司);重组人IL-9、抗IL-9中和抗体(美国Peprotech公司);IL-9、干扰素-γ、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)酶联免疫吸附实验(Enzyme linked immunosorbent assay,ELISA)试剂盒(美国R&D公司);Trizol试剂(美国Invitrogen公司);PrimeScript反转录试剂盒、TB Green实时定量PCR试剂盒(北京宝日生物技术有限公司);CCK-8试剂盒、乳酸脱氢酶(Lactate dehydrogenase,LDH)细胞毒性检测试剂盒(武汉碧云天公司);穿孔素、颗粒酶B酶联斑点吸附实验(Enzyme linked immunospot assay,ELISPOT)试剂盒(美国Abcam公司)。MCAS磁力分离架(德国美天旎公司);FACS Aria Ⅱ流式细胞仪(美国BD公司);微孔读板仪(美国BioRad公司);ABI 7500实时定量PCR仪(美国Applied Biosystem公司);ELISPOT读板仪(德国艾迪公司)。
1.2.2 血浆和外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)分离:于晨起空腹留取入组者抗凝外周血20 ml,于1000 g离心10 min收集上层血浆,-70 ℃冰箱冻存备用。下层血细胞使用Ficoll淋巴细胞分离液、采用密度梯度离心法分离PBMCs,调整细胞浓度至107个/ml,加入含10 % DMSO的胎牛血清(Fetal bovine serum,FBS),液氮冻存备用。
1.2.3 BALF制备:经活检孔通过硅胶管向灌洗肺段注入利多卡因进行局部麻醉,将纤维支气管镜顶端紧密楔入肿瘤部位亚段支气管开口处,经硅胶管快速注入37 ℃无菌生理盐水,共灌洗4次,每次50 ml。用100 mmHg(1 mmHg=0.133 kPa)负压吸引回收灌洗液,保证回收效率 >50%。用双层无菌纱布过滤灌洗液,记录总量,导入无菌离心管中,于4 ℃、1000 g离心10 min,收集上清,-70 ℃冰箱冻存备用。经离心沉淀的细胞成分使用Hank’s液洗涤2次,加入完全培养液(RPMI 1640培养液+10% FBS),调整细胞浓度至106个/ml。对于可耐受灌洗的肺癌组患者,对未发生肿瘤的肺部也进行灌洗,作为对照进行检测。
1.2.4 原代NSCLC细胞的分离和培养:对于接受手术的17例肺癌组患者,取新鲜的NSCLC组织,加入适量Hank’s液,去除组织中的血液、结缔组织和脂肪组织,保留肿瘤细胞丰富的区域,用Hank’s液洗涤2次后加入少量RPMI 1640培养液,将组织剪成约1 mm3大小的碎块。将组织碎块转入离心管中,用Hank’s液洗涤数次,组织碎块自动下沉后移除Hank’s液。将组织碎块转入培养瓶中,加入5 ml胶原酶,吹散,置37 ℃恒温摇床、于150 次/min的速度下进行消化,每隔30 min于显微镜下观察1次。待组织碎块呈絮状、且透光性良好后,转入离心管中,于1000 g离心10 min后弃上清,加入Hank’s液洗涤数次,反复吹打后于1000 g离心10 min后弃上清,转入培养板中,加入完全培养液,于37 ℃、5 % CO2条件下培养。
1.2.5 CD8+T细胞的纯化:使用CD8+T细胞分选试剂盒对PBMCs和BALF中的CD8+细胞进行分选。取107个细胞于4 ℃、300 g离心10 min,加入40 μl缓冲液重悬细胞,再加入10 μl生物素标记的抗体鸡尾酒,4 ℃孵育5 min,加入30 μl缓冲液和20 μl CD8+T细胞磁珠鸡尾酒,4 ℃孵育10 min。用3 ml缓冲液浸润置于MACS分离架上的分离柱,加入标记的细胞悬液,收集通过分离柱的细胞,即为CD8+T细胞。
1.2.6 Th9细胞(即CD4+CCR4-CCR6-CXCR3-细胞)的纯化:首先使用CD4+T细胞分选试剂盒对PBMCs和BALF中的CD4+细胞进行分选。取107个细胞于4 ℃、300 g离心10 min,加入40 μl缓冲液重悬细胞,再加入10 μl生物素标记的抗体鸡尾酒,4 ℃孵育5 min,加入30 μl缓冲液和20 μl CD4+T细胞磁珠鸡尾酒,4 ℃孵育10 min。用3 ml缓冲液浸润置于MACS分离架上的分离柱,加入标记的细胞悬液,收集通过分离柱的细胞,即为CD4+T细胞。随后将纯化的CD4+T细胞使用抗CCR4-PE、抗CCR6-PE和抗CXCR3-PE进行染色,室温避光孵育30 min后使用PBS洗涤2次,使用FACS Aria Ⅱ流式细胞仪对细胞进行阴性分选,收集CCR4-CCR6-CXCR3-细胞,即为CD4+CCR4-CCR6-CXCR3-Th9细胞。
1.2.7 细胞培养:①取32例肺癌组患者PBMCs中分离的105个CD8+T细胞,接种于96孔板中,设立3个复孔,其中3个复孔加入200 μl 完全培养液,另外3个复孔加入含有重组人IL-9(5 μg/L)的完全培养液刺激培养,12 h后收集细胞进行后续检测。②建立CD8+T细胞与原代NSCLC细胞直接接触培养和间接接触培养系统[6]。对21例接受手术治疗的NSCLC患者收集其PBMCs和BALF中纯化的CD8+T细胞,加入重组人IL-9(5 μg/L)刺激培养12 h,洗涤细胞2次,去除IL-9,再将105个CD8+T细胞与5×105个自体分离的原代NSCLC细胞共培养。在直接接触培养系统中,CD8+T细胞与原代NSCLC细胞直接混合,并加入抗CD3/CD28抗体(1 μg/L)刺激培养。在间接接触培养系统中,CD8+T细胞与原代NSCLC细胞分别接种于Transwell培养平板的上层小室和下层培养孔中,上层小室底部为孔径直径为0.4 μm的滤膜,仅可溶性细胞因子可以通过,细胞不能通过滤膜,向上层小室中加入抗CD3/CD28抗体。培养48 h后收集上清,进行后续检测。③为评估Th9细胞对CD8+T细胞的调控作用,对21例接受手术治疗的NSCLC患者,将外周血纯化的Th9细胞及CD8+T细胞与原代NSCLC细胞,建立以下培养体系:①5×104个Th9细胞与5×105个自体分离的原代NSCLC细胞直接接触共培养;②105个CD8+T细胞与5×105个自体分离的原代NSCLC细胞直接接触共培养;③5×104个Th9细胞、105个CD8+T细胞与5×105个自体分离的原代NSCLC细胞共培养;④5×104个Th9细胞、105个CD8+T细胞与5×105个自体分离的原代NSCLC细胞共培养,同时加入抗IL-9中和抗体(5 μg/ml)。培养液中加入抗CD3/CD28抗体(1 μg/L)刺激培养。培养48 h后收集上清,进行后续检测。
1.2.8 流式细胞术检测Th9细胞:取106个PBMCs或BALF中分离的细胞,加入佛波酯(50 ng/ml)和伊乌诺霉素(1 μg/ml)刺激培养,同时加入莫能霉素(10 μg/ml)抑制蛋白转运。培养6 h后,PBS洗涤2次,加入抗CD3-PerCP和抗CD4-PE进行表面染色,室温避光孵育30 min。PBS洗涤2次,然后加入破膜固定液,4 ℃避光孵育15 min,PBS洗涤2次,加入抗IL-9-APC进行胞内染色,4 ℃避光孵育30 min,PBS洗涤2次。加入多聚甲醛固定,使用FACS Aria Ⅱ流式细胞仪获取细胞,FlowJo V10软件分析结果。
1.2.9 ELISA检测细胞因子水平:使用商品化ELISA试剂盒对血浆、BALF及培养上清中的IL-9、干扰素-γ和TNF-α水平进行检测。
1.2.10 实时定量PCR法检测PU.1 mRNA相对表达量:取105个PBMCs或BALF中分离的细胞,使用Trizol试剂提取总RNA。反转录反应体系:5×缓冲液 2 μl、反转录酶混合物Ⅰ 0.5 μl、寡聚胸腺嘧啶引物 0.5 μl、随机六核苷酸引物 0.5 μl、总RNA 1 μg,加入不含RNA酶的去离子水调整总体积至10 μl。反转录反应条件:37 ℃ 15 min,85 ℃ 5 s。TB Green实时定量PCR反应体系:TB Green预混Taq酶 10 μl、上游引物(10 μmol/L) 0.4 μl、下游引物(10 μmol/L) 0.4 μl、ROX参考染料 0.4 μl、cDNA 2 μl、灭菌水 6.8 μl。PCR反应条件:预变性:95 ℃ 30 s;PCR反应:95 ℃ 5 s,60 ℃ 30 s,共40个循环。应用2-ΔΔCT法对目的片段的相对表达量进行分析。引物序列:①PU.1上游:5’ GAT CCG CCT GTA CCA GTT CC 3’,下游:5’ CTC CTT GTG CTT GGA CGA GA 3’;②β-肌动蛋白上游:5’ TGG CAGC CAG CAC AAT GAA 3,下游:5’ CTA AGT CAT AGT CCG CCT AGA AGC A 3’。
1.2.11 细胞增殖试验:使用CCK-8试剂盒按说明书操作。在培养的最后4 h,向培养孔内加入20 μl CCK-8反应液,检测细胞培养液在450 nm处的吸光度,设立标准曲线,计算培养细胞的数量。
1.2.12 ELISPOT检测穿孔素和颗粒酶B的水平:使用预包被的穿孔素或颗粒酶B ELISPOT试剂盒检测CD8+T细胞分泌穿孔素及颗粒酶B的水平。向PVDF预包被的平板中每孔加入100 μl PBS,室温孵育10 min,吸干平板中的液体。向平板中每孔加入105个无IL-9刺激或经IL-9刺激的CD8+T细胞,加入佛波酯(50 ng/ml)和伊乌诺霉素(1 μg/ml),同时设立无刺激的阴性对照孔,总体积为100 μl,于37 ℃、5% CO2条件下培养16 h,吸干平板中的液体,加入100 μl PBS-T,4 ℃孵育10 min,使用PBS-T洗板3次。向平板中每孔加入100 μl 1∶100稀释的检测抗体,室温孵育90 min,使用PBS-T洗板3次。向平板中每孔加入100 μl 1∶5000稀释的链霉亲和素碱性磷酸酶,室温孵育60 min,使用PBS-T洗板3次,使用流动水冲洗PVDF膜的两面,吸干液体后加入100 μl BCIP/NBT碱性磷酸酶底物显色液,室温孵育15 min。流动水冲洗,吸干液体后使用ELISPOT读板仪对斑点形成细胞(Spot forming cells,SFC)进行计数。
1.2.13 靶细胞死亡比例检测:通过检测培养上清中LDH计算原代NSCLC细胞的死亡比例。使用LDH细胞毒性检测试剂盒检测培养上清中LDH水平,以原代NSCLC细胞培养上清中的LDH水平作为“低水平LDH对照”,以Triton X-100处理的原代NSCLC细胞培养上清中的LDH水平作为“高水平LDH对照”,按以下公式计算靶细胞死亡比例:(样本LDH水平-低水平LDH对照)/(高水平LDH对照-低水平LDH对照)×100%。

2 结 果
2.1 肺癌组和对照组外周血及BALF中Th9细胞比例、IL-9水平及PU.1相对表达量比较 肺癌组及对照组外周血CD3+CD4+IL-9的Th9细胞典型流式散点图见图1。肺癌组外周血Th9占CD4+T细胞的比例显著低于对照组,但外周血Th9细胞比例在肺鳞癌和肺腺癌中的差异无统计学意义。肿瘤部位收集的BALF中Th9细胞比例显著低于非肿瘤部位,但肿瘤部位收集的BALF中Th9细胞比例在肺鳞癌和肺腺癌中的差异无统计学意义。肺癌组外周血IL-9水平显著低于对照组,但外周血IL-9水平在肺鳞癌和肺腺癌中的差异无统计学意义。肿瘤部位收集的BALF中IL-9水平显著低于非肿瘤部位,但肿瘤部位收集的BALF中IL-9水平在肺鳞癌和肺腺癌中的差异无统计学意义。肺癌组PBMCs中PU.1 mRNA相对表达量显著低于对照组,但PBMCs中PU.1 mRNA相对表达量在肺鳞癌和肺腺癌中的差异无统计学意义。肿瘤部位收集BALF分离的细胞中PU.1 mRNA相对表达量显著低于非肿瘤部位,但肿瘤部位BALF分离的细胞中PU.1 mRNA相对表达量在肺鳞癌和肺腺癌中的差异无统计学意义。见表1。

图1 对照组和肺癌组外周血Th9细胞典型流式分析散点图
2.2 IL-9刺激对肺癌组患者外周血CD8+T细胞增殖及分泌穿孔素、颗粒酶B的影响 经IL-9刺激的CD8+T细胞增殖显著高于无IL-9刺激的CD8+T细胞,经IL-9刺激的CD8+T细胞分泌穿孔素和颗粒酶B的水平显著高于无IL-9刺激的CD8+T细胞。见表2。
2.3 IL-9刺激对肺癌组患者外周血和BALF中CD8+T细胞功能的影响 经IL-9刺激后,无论外周血分离的CD8+T细胞还是BALF中分离的CD8+T细胞,其细胞杀伤功能均显著高于无IL-9刺激的CD8+T细胞,表现为在直接接触和间接接触培养系统中,CD8+T细胞诱导原代NSCLC细胞死亡比率在经IL-9刺激的CD8+T细胞中均显著高于无IL-9刺激的CD8+T细胞。无论外周血分离的CD8+T细胞还是BALF中分离的CD8+T细胞,在直接接触和间接接触培养系统中,经IL-9刺激后分泌干扰素-γ和TNF-α的水平均显著高于无IL-9刺激的CD8+T细胞。见表3。
2.4 Th9细胞对肺癌组患者外周血CD8+T细胞功能的影响 Th9细胞诱导原代NSCLC细胞死亡比率极小,培养上清中检测不到干扰素-γ和TNF-α。Th9细胞可增强肺癌组患者外周血CD8+T细胞的杀伤功能,表现为原代NSCLC细胞死亡比率升高,培养上清中干扰素-γ和TNF-α水平亦升高。而加入抗IL-9中和抗体则可抑制Th9细胞对CD8+T细胞杀伤功能的增强作用,表现为原代NSCLC细胞死亡比率降低,培养上清中干扰素-γ和TNF-α水平亦降低,见表4。

表1 对照组和肺癌组外周血BALF中Th9细胞比例、IL-9水平和PU.1相对表达量比较

表2 IL-9刺激对肺癌组患者外周血CD8+T细胞增殖及分泌穿孔素、颗粒酶B 的影响

表3 IL-9刺激对肺癌组患者外周血和BALF中CD8+T细胞功能的影响
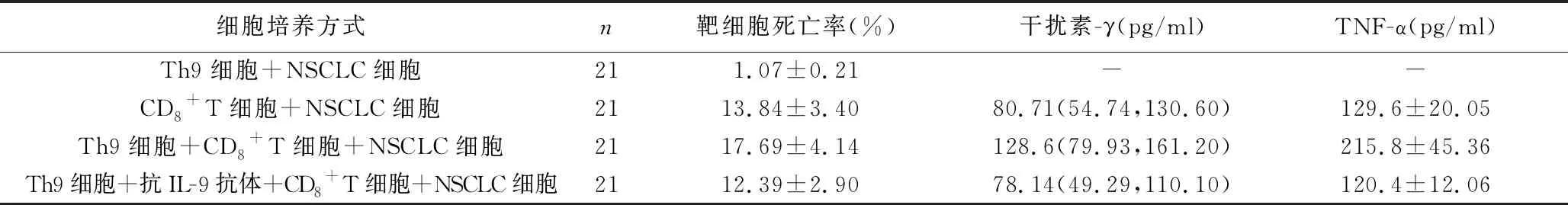
表4 Th9细胞对肺癌组患者外周血CD8+T细胞功能的影响
3 讨 论
Th9细胞在多种实体肿瘤的发生发展中均发挥重要的免疫调控作用[6]。研究发现,肿瘤微环境中的Th9细胞可诱导肺癌细胞上皮间质细胞转化,进而促进肺癌细胞的迁移和转移性扩散[7],Th9细胞分泌的IL-9也可通过诱导血管生成促进NSCLC肿瘤形成[8]。相反,miR-208b-5p可通过IL-9介导的STAT3信号通路抑制NSCLC细胞的侵袭和迁移[9]。IL-9还可直接通过刺激抗肿瘤M1型巨噬细胞的活化抑制黑色素瘤肺转移[10]。在黑色素瘤肺转移小鼠模型中,抑制IL-9可促进肿瘤生长,肿瘤特异性Th9细胞可通过促进树突状细胞向肿瘤组织的募集增强CD8+T细胞抗肿瘤活性[11]。因此,Th9细胞及其分泌的IL-9在肺癌的发生发展中存在双重功能,可能与不同肿瘤组织类型及不同疾病的免疫状态有关[12]。本研究结果发现Th9细胞、IL-9和PU.1在NSCLC患者外周血和肿瘤局部的水平降低,这与既往在结肠癌组织中的发现的IL-9水平降低结果一致,但却与宫颈癌患者肿瘤浸润组织中所发现的IL-9 PU.1+T细胞水平升高的结果不尽相同[13],这是可能是由于不同的肿瘤细胞系对Th9细胞和IL-9刺激的应答存在差异造成的[14],NSCLC患者中Th9细胞和IL-9水平降低可能与机体免疫应答抑制有关。进一步的研究发现,NSCLC患者分离的Th9细胞与自体原代NSCLC细胞共培养后,诱导细胞死亡的水平很低,提示NSCLC患者的Th9细胞的直接杀伤功能极低。这可能与两个方面的因素有关:一方面,CD4+T细胞的直接细胞杀伤功能较弱,特别是CD4+CCR4-CCR6-CXCR3-Th9细胞主要分泌IL-9和IL-21[15],不能发挥有效的细胞毒性作用。另一方面,NSCLC患者自身存在免疫功能不全甚至衰竭[16],Th9细胞分泌的IL-9不但存在数量减低,还可能出现功能障碍,从而不能有效发挥免疫调控作用。
Th9细胞通过分泌IL-9显著增强黑色素瘤小鼠模型的免疫应答,抑制肿瘤生长[17]。IL-9还可直接调控T细胞和浆细胞的增殖和功能,通过多种途径发挥免疫增强作用[18]。相反,IL-9还可通过抑制转化生长因子和粒细胞-巨噬细胞集落刺激因子的分泌抑制单核细胞的功能,使机体免受过强的免疫应答的影响[19-20]。因此,Th9细胞和IL-9在肿瘤免疫调控中亦存在双重功能。CD8+T细胞是重要的抗肿瘤免疫细胞,而CD8+T细胞在肿瘤患者中存在功能不全甚至功能衰竭,无法有效清除肿瘤细胞,造成肿瘤增殖和转移。肺癌患者中亦存在CD8+T细胞功能衰竭[21],采用多种方式(如:免疫佐剂、直接刺激、基因编辑等)恢复CD8+T细胞功能已成为肺癌治疗的研究热点之一。在结肠癌中,Th9细胞可通过抑制CD8+T细胞中的PD-1/PD-L1信号通路促进CD8+T细胞克隆性增殖[5]。在乳腺癌中,Th9细胞可通过分泌IL-9和IL-21促进CD8+T细胞抗肿瘤活性[15]。但尚未见到有关Th9细胞及其分泌的IL-9对NSCLC患者CD8+T细胞功能调控作用的相关报告。本研究发现,虽然Th9细胞的毒性作用较弱,但Th9细胞可显著增强NSCLC患者CD8+T细胞诱导的靶细胞死亡,抗IL-9中和抗体可抑制Th9细胞对CD8+T细胞功能的增强效应,提示Th9细胞主要通过分泌IL-9发挥调控NSCLC患者CD8+T细胞的抗肿瘤活性,这与在乳腺癌中的研究结果一致[15]。进一步对IL-9调控CD8+T细胞功能的机制进行研究。第一,IL-9可促进NSCLC患者CD8+T细胞的增殖,提示IL-9可通过促进细胞生长增加CD8+T细胞的数量。第二,利用直接接触和间接接触培养系统,观察CD8+T细胞的直接杀伤和非直接杀伤的功能在抗NSCLC中的作用。直接接触培养系统中,CD8+T细胞可通过依赖细胞间接触的直接杀伤和分泌细胞因子介导的非直接杀伤之双重功能发挥诱导靶细胞死亡的作用,在间接接触培养系统中,CD8+T细胞仅通过细胞因子介导的非直接杀伤功能诱导靶细胞死亡[22]。IL-9刺激后,无论在直接接触还是间接接触培养中,NSCLC患者外周血和BALF中CD8+T细胞诱导靶细胞死亡的比例均增加,同时伴有干扰素-γ和TNF-α分泌水平增加,提示IL-9可直接促进NSCLC患者的CD8+T细胞通过分泌细胞因子介导的非直接杀伤活性。第三,IL-9可直接促进CD8+T细胞分泌穿孔素和颗粒酶B,穿孔素和颗粒酶B均为CD8+T细胞发挥直接杀伤功能活性的重要介质分子[23],提示IL-9还可增强NSCLC患者CD8+T细胞的直接杀伤功能。因此,Th9细胞分泌的IL-9可能通过多种机制发挥促进NSCLC患者CD8+T细胞活性的作用。但本研究仅进行了体外试验,且入组样本数量相对较少,还需进行动物试验并扩大样本量对结论进一步验证。
总之,NSCLC患者中低表达的Th9细胞可能与NSCLC患者CD8+T细胞抗肿瘤活性降低有关,Th9细胞可能主要通过分泌IL-9增强NSCLC患者CD8+T细胞的抗肿瘤效应。
