前列腺癌免疫人源化小鼠模型的构建及鉴定
2021-01-14郭文文师长宏李苗苗乔天运赵菊梅张彩勤
郭文文,师长宏,李苗苗,乔天运,赵菊梅,张彩勤∗
(1.延安大学医学院,陕西延安 716000;2.空军军医大学实验动物中心,西安 710032)
前列腺癌是男性泌尿生殖系统中最常见的恶性癌症之一,并且随着我国人口老龄化趋势不断明显,其发病率也呈逐年上升趋势[1-2]。由于前列腺癌的早期发展依赖于雄激素,主要治疗方法为根治性手术治疗、内分泌治疗及放射治疗等。然而,大多数患者经治疗产生一段时间反应后会复发,发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[3]。而目前 CRPC有效的治疗方法尚不明确,迫切需要探索新的治疗方法。近年来,免疫疗法在前列腺癌的治疗上取得了快速发展,它可通过激活宿主免疫细胞特异性攻击前列腺癌细胞产生特异性抗肿瘤免疫反应[4-5]。然而,传统的前列腺癌细胞系移植(cell derived xenograft,CDX)模型因缺乏完整的人免疫系统,无法用于免疫治疗研究。本研究主要目的是构建具有人免疫系统的人源化肿瘤小鼠模型,期望能够用于肿瘤免疫药物的研发及临床前评估。
NOD-PrkdcscidIl2rgtm1/Vst(NPG)小鼠是一种先天性T、B与NK细胞三重免疫缺陷动物。与国外的NSG或 NOG一样,均为 NOD-Prkdcscid Il2rgnull小鼠,是目前国际公认的免疫缺陷程度最高的小鼠模型,同时也是最好的人源细胞移植的受体。将人外周血中分离的PBMC移植入NPG小鼠体内,可以重建以成熟T淋巴细胞为主的人免疫系统,在此基础上进一步移植人肿瘤细胞而构建的模型,即为人源化肿瘤模型。其模拟人体的生理、病理变化,可以给肿瘤提供与人体更相似的生长微环境。同时,肿瘤基质包含了人源免疫细胞成分,在阐明发病机制及肿瘤靶向治疗与肿瘤发生、发展、转移机制等研究方面具有重要的应用价值,尤其在研究肿瘤免疫治疗方面,是更理想的肿瘤模型[6-8]。但外周血中PBMC在NPG小鼠体内免疫重建时相及动态过程有待进一步研究。因此,本研究采用密度梯度离心法从新鲜人外周血中分离出PBMC,通过尾静脉注射NPG小鼠,建立人源化小鼠模型;并植入前列腺癌细胞系 22Rv1细胞,构建 Hu-CDX模型,探讨NPG小鼠移植入人PBMC后免疫重建的水平及肿瘤生长情况,以期为肿瘤免疫治疗药物的评估提供理想的临床前动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
12只4~5周龄SPF级雄性NPG小鼠,体重22~25 g,购买于北京维通达生物技术有限公司【SCXK(京)2019-0002】。饲养于中国人民解放军空军军医大学实验动物中心屏障环境【SYXK(陕)2019-001】。环境温度20~26℃,相对湿度40%~70%,12 h光照/12 h黑暗。饲料及饮水均经无菌处理,小鼠自由摄食和饮水。相关动物实验获得了空军军医大学实验动物福利伦理委员会批准(No.16013)。
1.1.2 细胞系
人前列腺癌细胞22Rv1细胞购买于ATCC,该细胞培养于RPMI-1640培养基(10%胎牛血清 +1%青链霉素)置于37℃、5%CO2孵箱中培养。
1.1.3 主要试剂与仪器
2份新鲜外周血供体取自空军军医大学第一附属医院输血科,并获得医学伦理委员会批注(KY20193035);胎牛血清、RPMI-1640培养基和0.25%胰酶购自美国 Gibco公司;人 Ficoll-PaqueTMPREMIUM 1.084 sterile solution试剂购自美国GE Healthcare;小鼠淋巴细胞分离液试剂购自天津市灏洋生物科技有限公司;抗人流式检测抗体:PE-CD3e抗体,FITC-CD45抗体为美国 BD Biosciences产品;IHC试剂盒购买于康为世纪有限公司;抗人CD45、CD4和CD8抗体购于英国abcam公司。FC500(Beckman Coulter)和 Flow Jo软件用于流式细胞采集与数据分析。
1.2 方法
1.2.1 动物分组
NPG小鼠适应性喂养1周后,随机分为供体1重建组、供体2重建组及未重建对照组,共3组,每组4只。
1.2.2 人源化小鼠模型的建立
采用Ficoll密度梯度离心法提取人新鲜外周血中PBMC备用。重建组每只小鼠通过尾静脉注射1×107个PBMC,未重建对照组给予等体积的生理盐水。所有动物均饲养在SPF级环境,动态监测每组小鼠各项指标的变化情况。
1.2.3 流式细胞术监测小鼠外周血中人免疫细胞的重建水平
移植后第3、4、5、6周分别用断尾法取两个免疫重建组小鼠尾静脉血,并分离出PBMC制成单个细胞悬液,分别标记抗人CD3+、CD45+T细胞荧光抗体后,进行流式细胞分析,动态监测小鼠外周血中人免疫细胞的重建水平。流式细胞仪所检测数据,采用FlowJo 7.6.1软件分析及绘图。
1.2.4 Hu-CDX模型的建立
当供体1和供体2重建的小鼠外周血中人免疫细胞CD45+CD3+T细胞>25%时,标志人源化小鼠模型构建成功。接下来我们将对数生长期的22Rv1细胞,用0.25%的胰蛋白酶消化后,最终用无菌PBS缓冲液和基质胶Matrigel基质胶以1∶1将1×107个22Rv1细胞重悬至200 μL,皮下接种于构建成功的免疫人源化小鼠。
1.2.5 肿瘤生长监测及免疫浸润分析
小鼠生物学特征观察:每天观察精神状态、饮食、活动力、体重、毛顺滑度及肿瘤的生长等情况。肿瘤细胞接种后,一周2次监测肿瘤体积,并绘制肿瘤生长曲线。肿瘤体积计算方法:V(mm3)=长(mm)×宽2(mm2)/2。当肿瘤长至1000 mm3左右,实验终止时对小鼠采用吸入CO2安乐死,收集模型鼠的肿瘤组织和脾组织,固定于4%多聚甲醛溶液中,作组织切片,进行HE染色以及免疫组化染色,在显微镜下观察染色结果。
1.3 统计学分析
实验数据采用SPSS 20.0统计软件进行统计分析,以平均值±标准差()表示。采用t检验法进行组间差异性分析,P<0.05为差异具有统计学意义。
2 结果
2.1 成功构建免疫系统人源化小鼠模型
将供体1来源的人PBMC注射入重建移植组小鼠体内,于第3、4、5、6周流式细胞术动态监测小鼠外周血中人CD45+CD3+T细胞比例。如图1A显示,注射后第3周即可检测到人源免疫细胞CD45+CD3+T细胞>25%,标志着人源化小鼠模型构建成功。随着重建时间的延长,人CD45+CD3+T细胞明显上升,到第6周达到约77.4%~86.7%。此外,我们还用供体2来源的PBMC进行了免疫重建,流式数据分析发现两组供体免疫系统重建水平存在差异;人源化小鼠一般在重建第6周即出现包括体重下降、弓背、脱毛等移植物抗宿主反应(GVHD)(图1B)。
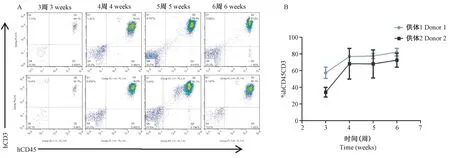
图1 NPG小鼠人源化重建后外周血中人免疫细胞的百分比Note.A.The percentage of human CD45+CD3+T cells in the peripheral blood of donor 1 reconstructed mice was monitored by flow cytometry at the 3rd,4th,5th and 6th week.B.The level of human CD45+CD3+T cells in peripheral blood of mice reconstructed by donor 1 and donor 2(n=4).Figure 1 Percentages of human immune cells in peripheral blood of NPG mice after humanization
2.2 前列腺癌Hu-CDX模型的构建与评估
人源化小鼠模型于第3周重建成功后,进一步将人前列腺癌细胞22Rv1皮下移植入小鼠右侧腋下,并以正常的NPG小鼠为对照组。定期测量肿瘤的生长情况。结果如图2显示,两组小鼠中均有肿瘤生长,随着时间延长肿瘤体积增大,且22Rv1细胞系在人源化小鼠中生长速度缓慢,与正常的NPG小鼠相比有显著差别(P<0.05)。待肿瘤生长到1000 mm3左右后,对小鼠进行安乐死处理,进一步固定肿瘤组织,免疫组化染色后进行单位面积阳性细胞数量分析,观察到人免疫重建组中每只CDX模型鼠的肿瘤组织中均有CD45+细胞及CD4+、CD8+T细胞的明显浸润,HE染色发现免疫人源化与非人源化小鼠肿瘤细胞的组织细胞形态没有显著性改变(见图3A、3B)。综上,重建的人免疫系统可能具有抑制肿瘤生长的作用。
2.3 人源化小鼠免疫器官中人免疫细胞浸润情况
为了进一步研究人免疫系统重建后小鼠脾内人源免疫细胞的浸润情况,我们利用免疫组织化学染色方法检测了免疫重建6周后小鼠脾内人CD4+和CD8+T细胞表达情况。结果显示,人CD4+、CD8+T细胞在重建小鼠脾组织中大量表达(T细胞膜着染棕黄色);对照组小鼠脾中未见人源细胞表达(图 4A、4B)。

图2 Hu-NPG与NPG小鼠接种22Rv1细胞后肿瘤的生长曲线(n=4)Note.Compared with control group,∗P <0.05.Figure 2 Growth curve of tumor in humanized mice after inoculated with 22Rv1 cells(n=4)
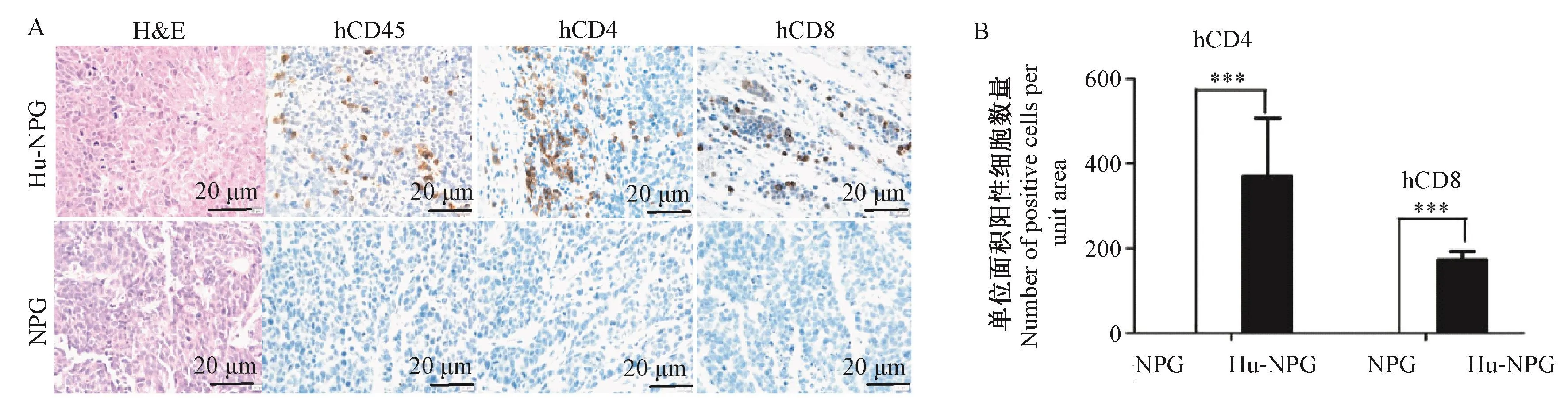
图3 Hu-NPG与NPG肿瘤组织中人免疫细胞的表达及HE染色Note.A.Expression of human CD45,CD4 and CD8 in tumor tissue and tumor infiltrating lymphocytes of Hu-NPG and NPG mice.B.Semi-quantitative analysis of human CD4 and CD8 immunohistochemical staining in tumor tissue.Compared with NPG, ∗∗∗P< 0.001, n=4.(The same in the next figures)Figure 3 Expression and HE staining of human immune cells in tumor tissues of Hu-NPG and NPG

图4 Hu-NPG与NPG小鼠脾组织中人CD4、CD8免疫组化染色与半定量分析Note.A.Expression of human CD4 and CD8 in spleen tissue of Hu-NPG and NPG mice.B.Semi-quantitative analysis of human CD4 and CD8 mmunohistochemical staining in spleen tissue.Figure 4 Immunohistochemical staining and semi-quantitative analysis of human CD4 and CD8 in spleen tissue of Hu-NPG and NPG mice
3 讨论
肿瘤免疫治疗通过激活机体抗肿瘤免疫反应或阻断肿瘤免疫逃逸,以控制和杀伤肿瘤。自2014年 9月,FDA首次批准 PD-1抑制剂(pembrolizumab)作为恶性黑色素瘤的一线治疗以来,免疫治疗已成为多种癌症的一线治疗方案,也为中晚期前列腺癌患者带来了曙光。以往的前列腺癌临床前研究模型是将前列腺癌细胞系或临床患者标本移植入免疫缺陷小鼠体内,然而这种模型由于缺乏人的免疫系统,无法模拟人类肿瘤与免疫微环境之间的相互作用,因而无法进行免疫检查点抑制剂等肿瘤免疫治疗研究。
通过在免疫缺陷小鼠体内植入人造血干细胞或功能性的淋巴细胞,使其具有人的免疫功能,这样的小鼠模型称为免疫系统人源化模型。在此模型上移植肿瘤可模拟人体肿瘤与免疫系统之间的相互作用,因而在肿瘤免疫治疗药物(如新型免疫检查点抑制剂、疫苗等)的研发与临床前药物评估方面具有重要的应用前景[9]。依据人免疫系统重建方法的不同,可将免疫人源化小鼠模型分为3类:(1)Hu-BLT(humanized-bone marrow,liver,thymus)小鼠模型,是人源免疫系统重建最为完善的小鼠模型,但其供体为人胚胎肝和胸腺,来源比较受限[10];(2)Hu-HSCs(humanized-hematopoietic stem cells)小鼠模型,是将人CD34+HSC移植入免疫缺陷小鼠体内,虽然这种方法可使多系造血细胞发育,但构建模型较慢[6,11];(3)Hu-PBL(humanized-peripheral blood mononuclear cells)小鼠模型,是将完全分化成熟的人PBMC移植入免疫缺陷小鼠体内[6,12-13],可产生效应性和记忆性T细胞。本研究中采用了第3种方法,不仅由于其构建方法快速简便,而且这种方式可以使T细胞移植效率高且稳定,更加准确的反应健康供体的免疫记忆状态。更为重要的是,以往很多研究中小鼠重建人免疫系统模型之前都要经过预处理,如未重建前进行化疗药环磷酰胺或亚致死性剂量的60Co γ射线辐照处理[14-15],尾静脉注射抗NK细胞活性制剂[16]、IFN-γ[17]等以提高重建的比例,但仍存在较高的重建失败率。而本研究中应用的T、B、NK重度联合免疫缺陷的NPG小鼠,在针对Hu-PBMC重建方面可以不进行辐照处理,直接用于对多个供体来源的PBMC进行筛选。
本研究结果显示,人源化小鼠外周血及免疫器官中均监测到高水平的人源细胞的表达。供体1重建第三周外周血中即可监测到人CD45+CD3+T细胞 >25%,第六周即可达到77.4%~86.7%,并且重建小鼠脾中有高水平的人CD4、CD8+T细胞浸润,表明人源化小鼠模型构建成功。此外,流式数据显示,不同供体来源的PBMC在小鼠体内免疫重建效果存在差异,这可能与供体的个体差异有关。人前列腺癌细胞系22Rv1中PD-L1、AR和PSA均高表达,是研究激素非依赖性前列腺癌免疫治疗理想的的细胞系,因此我们选择22Rv1细胞系皮下移植入人源化小鼠体内,成功构建了人源化荷瘤小鼠模型。我们实验发现,肿瘤细胞移植前后人源化小鼠外周血液及脾中人CD45+CD3+T细胞维持恒定状态,且肿瘤组织中也有较高水平人CD4+、CD8+T细胞的浸润。值得指出的是,本研究发现人前列腺癌细胞22Rv1细胞系在人源化小鼠中较非人源化小鼠中肿瘤生长速度缓慢,提示,重建的人免疫系统可能具有抑制肿瘤生长的作用。
由于临床上前列腺癌是低免疫浸润的“冷”肿瘤,靶向免疫检查点的治疗方法在临床上的治疗效果差强人意。目前,研究者寻求通过联合化疗以提高前列腺癌的免疫浸润及免疫原性,使前列腺癌转化为对免疫治疗敏感的“热”肿瘤[18],因此该模型不仅能够应用于免疫新药的疗效评估,还能作为免疫治疗联合化疗的临床前动物模型,这显然是人源化小鼠模型更具意义的应用方向。相关研究报道,Hu-PBL模型由于GVHD出现较早,研究窗口期为3~6周,主要用于短期免疫治疗药物的评价,不适用于长期的肿瘤免疫机制研究[13]。因此,课题组后续将构建Hu-HSCs模型,以进行上述联合治疗的研究及开发新型免疫检查点抑制剂和抗肿瘤免疫机制的研究,以期为临床实验提供依据。