CRISPR/Cas9介导人HBB基因突变体在猪成纤维细胞的靶向敲入
2021-01-14张婷婷杨漫漫魏强李燕莉李林王然胡莉花姜芳芳刘瑜赵卫华李勇1
张婷婷,杨漫漫,魏强,李燕莉,李林,王然,胡莉花,姜芳芳,刘瑜,赵卫华,李勇1,∗
(1.深圳华大三生园科技有限公司,广东深圳 518000;2.深圳动物基因组辅助育种工程实验室,广东深圳 518000;3.深圳市华大农业应用研究院,广东 深圳 518000;4.重庆市医药卫生学校,重庆 408000;5.深圳市第二人民医院,深圳大学第一附属医院,广东深圳 518028)
地中海贫血症主要是调控珠蛋白合成的基因发生缺失或突变,导致构成血红蛋白的α链和β链珠蛋白链表达不平衡、红细胞寿命缩短的一种溶血性血液疾病。全球160多个国家和地区有近2.8亿地中海贫血病患者。β地贫是广东省发病率最高、危害最大的遗传病之一。其致病原因是第11号染色体的β-珠蛋白(β-globin)基因发生缺失或点突变,造成β-珠蛋白合成完全或部分受抑,导致α/β链比例失衡,进而发生溶血性贫血。在多种β基因突变或缺失中,Codons41/42(-CTTT)突变约占β-地贫突变的36%以上[1]。一直以来,造血干细胞移植是唯一治愈β地贫的手段,但配型合格的供体少之又少。近年来,基于特定突变修复的基因治疗将成为β地贫永久性“治愈”最有效的手段之一。
为便于开展对Codons41/42(-CTTT)突变型β地贫的基因治疗研究,国内外已通过多种途径建立了携带该突变体的载体、细胞甚至基因工程小鼠[2]。Niu等[3]利用来自β地贫病人细胞构建的纯合HBBCodons41/42(-CTTT)突变的iPS细胞,结合CRISPR/Cas9系统进行突变矫正,并评价矫正细胞的功能特性。然而,iPS细胞实验只能体外检测编辑效率和功能特性,无法完成体内的功能和安全性评价。Jamsai等[4]利用基因打靶技术制备了人HBB41/42(-CTTT)小鼠,发现纯合子小鼠存活到妊娠后期,表现出严重的贫血症状。尽管β地贫小鼠模型可以比较好的模拟其病理过程,但像地贫患者输血后出现的铁过载现象在实验鼠的身上却不能完全拟合,不能很好反映出病程。因此,其作为临床前的药物使用剂量、安全评价并不合适[5]。因此,开发携带人β地贫大动物模型十分必要。
我们发现,较小鼠而言,猪与人β-珠蛋白氨基酸一致性较更高,达到85%。此外,天然猪血红蛋白与人血红蛋白的分子构象几乎一致,二者有高度相似的抗原性[6]。这提示我们:猪β-珠蛋白在其生物学功能上或许与人β-珠蛋白更为相似,暗示以猪HBB蛋白突变体而构建地贫模型,更能模拟出人地贫症的机制。因此,开发携带人β地贫大动物模型十分必要。同时,猪在器官发育、生理生化、疾病进程以及基因组序列方面和人类具有高度的相似性,是人类疾病的理想实验模型,被广泛应用到生物医学研究[7]。在血液生理生化方面,小型猪19项生理指标、9项生化指标和人类的参考值接近[8]。以猪替代小鼠研究人地贫等相关疾病模型具有无法比拟的优势。
本研究利用CRISPR/Cas9技术制备了携带人源化HBB基因Codons41/42(-CTTT)突变体的巴马猪胎儿成纤维细胞株,经PCR方法和DNA测序法验证了插入的hHBB突变体基因序列正确。最后,通过PCR方法检测到表达外源hHBBCodons41/42(-CTTT)基因的细胞株6株。该细胞株为进一步获得人地贫的小型猪模型,为研究地贫的发生、发展及新药创制奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞及载体
CRR质粒由本实验室设计并合成,hCas9为华中农业大学种猪测定中心韩晓松博士提供,猪PK细胞和巴马猪胎儿成纤维细胞为中国农业科学院北京畜牧研究所杨述林研究组提供。
1.1.2 主要试剂与仪器
限制性内切酶、T7核酸内切酶、T4连接酶均购于NEB公司;无内毒素质粒提取试剂盒购于Omega公司;Lipofectamine2000脂质体转染试剂盒购于Invitrogen公司;电转染试剂盒 AmaxaBasic Nucleofector Kit Primary Fibroblasts购于Lonza公司;反转录试剂盒 TransScriptFirst-StrandcDNA Synthesis SuperMix购于北京全式金生物公司。
高速离心机(Eppendrof,德国),倒置光学显微镜(莱卡,德国),核转仪(Lonza,瑞士),二氧化碳培养箱(Eppendrof,德国),水浴锅(北京六一仪器厂)电泳槽(北京六一仪器厂),PCR扩增仪(Bio-Rad,美国),凝胶成像仪(Bio-Rad,美国)。
1.2 方法
1.2.1 sgRNA设计及表达载体构建
根据猪HBB基因序列(Gene ID:407066),利用张锋实验室在线网站http://crispr.mit.edu/设计了11条靶向 sgRNA(small guide RNA)序列(表1),sgRNA序列由华大基因合成,上、下游序列按体积比 1∶1混合,95℃,10 min;25℃,30 min;变性;退火后,以T4 DNA连接酶介导,连接入BsaI内切酶酶切回收后的骨架载体CRR,最终构建出CRR-sgRNA表达载体。将该载体转化大肠杆菌DH5α,经涂板、挑选单克隆菌落和菌落PCR鉴定阳性克隆。
1.2.2 sgRNA活性鉴定
转染前24 h将猪PK15细胞铺于24孔板(1×104细胞/孔),次日,将构建好的 sgRNA转染细胞(参照Lipo2000转染试剂盒说明书),转染质粒总量500 ng,hCas9:CRR-sgRNA=3∶1。 细胞于培养箱培养48 h。收集细胞并提取基因组DNA(gDNA),按表 2 引物做 PCR,体系为:gDNA 0.1 μg,Premix Ex Taq 10 μL,上下游引物(10 μmol/L) 各 0.4 μL,ddH2O补足体积至20 μL。PCR反应程序:98℃,1 min;98℃ 10 s,58℃ 30 s,72℃ 10 s,循环 32 次;72℃,5 min。
T7 变性程序:95℃,10 min;95~85℃(-2.0℃ /s);85~25℃(-0.3℃ /s);25℃,1 min。
T7酶切反应体系:PCR 产物 17 μL,NEB Buffer 2 2 μL,T7 酶 0.2 μL,ddH2O 补足体积至20 μL。 反应条件:37℃,45 min。将酶切产物电泳后利用DNA凝胶成像系统检测。

表1 sgRNA靶点序列Table 1 Sequences of the sgRNAs

表2 sgRNA活性鉴定引物Table 2 Primers used for PCR of sgRNA targeted sites
1.2.3 人源化HBB基因打靶载体构建
靶位点上、下游1000 bp左右的序列作为同源臂序列,设计含有NotI酶切位点的上游同源臂引物、含有XhoI酶切位点的下游同源臂引物及融合扩增引物(表3)。以猪基因组DNA为模板,扩增上、下游同源臂,反应体系为:gDNA 0.1 μg,KOD Buffer 5 μL,2 mmol dNTPs 5 μL,25 mmol MgSO42 μL,上、下游引物(10 μmol/L) 各 1.5 μL, DNA 聚合酶1 μL,ddH2O 补足体积至 50 μL。 PCR 反应程序:94℃,3 min;94℃,15 s;55℃,30 s;72℃,2 min,循环35次;72℃,5 min。PCR产物回收作模板,进行融合PCR。把融合PCR产物与pGH-T载体(NotI和XhoI切过)进行融合,融合反应体系为:pGH-T载体5 μL,融合 PCR 产物 3 μL,infusion 酶 2 μL。 反应程序为:50℃,15 min,构建重组载体 pGH-LA-RA,测序序列完全正确后,大量提取无内毒素质粒备用。
以hHBB(CD41/42,-CTTT)-T质粒为模板,分别扩增两个片段,反应的引物序列见表4。hHBB(CD41/42,-CTTT)片段扩增反应体系:DNA 0.05 μg,KOD Buffer 5 μL,2 mmol dNTPs 5 μL,25 mmol MgSO42 μL,上下游引物(10 μmol/L)各 1.5 μL,DNA 聚合酶 1 μL,ddH2O 补足体积至 50 μL。反应程序为:94℃,3 min;94℃ 15 s,55℃ 30 s,72℃2min,循环 35 次;72℃,5 min。 PCR 产物回收后,进行融合PCR。融合PCR产物经BsaI酶介导构建于重组骨架载体pGH-LA-RA。
1.2.4 CRISPR/Cas9载体及同源重组载体转染巴马猪胎儿成纤维细胞
将 CRISPR/Cas9 3 μg、sgRNA 环状质粒1 μg 和hHBB同源重组载体3 μg通过电穿孔转染法转染巴马猪胎儿成纤维细胞。转染60 h后,采用有限稀释法将细胞悬液稀释至每个培养皿5000个细胞,放入培养箱培养,培养条件:37℃,5%CO2。
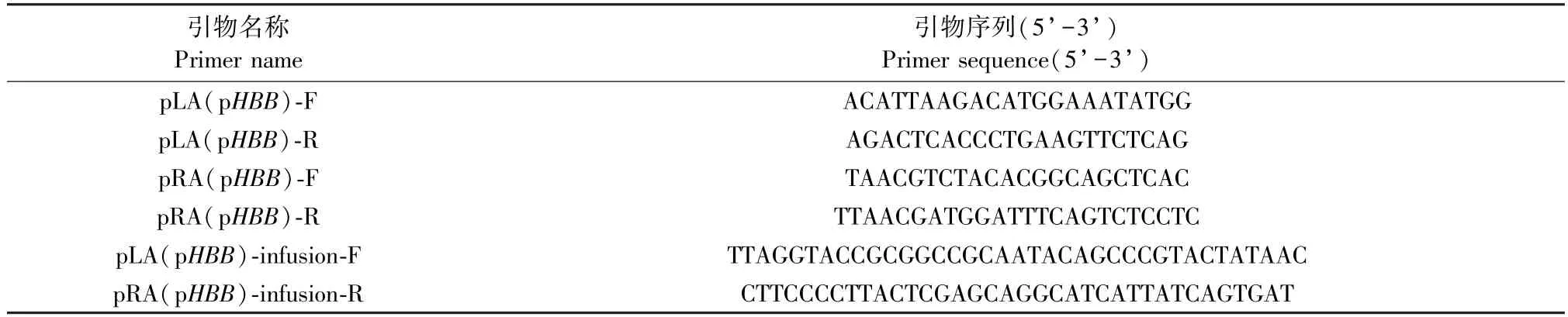
表3 左右同源臂扩增引物序列及融合扩增引物序列Table 3 Primers used for PCR or infusion PCR of the homologous arms

表4 人源hHBB片段扩增及融合引物序列Table 4 Primers used for PCR or infusion PCR of the human HBB gene
1.2.5 单克隆细胞系筛选及鉴定
转染后的细胞,用含 400 μg/mL G418、20%FBS的DMEM药筛培养基药筛5 d,而后用含20%FBS的DMEM培养基继续培养7 d,至第12天形成单克隆细胞团,用单克隆环挑选生长状态好、大小合适的单克隆细胞团到48孔细胞培养板。待细胞汇合度达90%对单克隆细胞消化,进行PCR鉴定。
对收集到的单克隆细胞进行裂解,裂解程序60℃,60 min;95℃,10 min,以细胞裂解产物(gDNA)为模板,分别用3对定点敲入鉴定引物进行扩增,引物序列见表5。
第1对鉴定引物为转基因阴阳性鉴定引物,第2对鉴定引物为跨左同源臂鉴定引物、第3对为跨右同源臂鉴定引物,三对引物反应体系为:DNA 2 μL,Premix Ex Taq 10 μL,上下游引物(10 μmol/L)各0.4 μL,ddH2O 补足体积至 20 μL。 反应程序均为:98℃,1 min;98℃ 10 s,65℃ 30 s,72℃ 1 kb/s,循环 35 次;72℃,5 min。
3对鉴定引物扩增均为阳性的细胞株,将其传代到12孔板继续培养,代细胞汇合度达到90%及以上时,进行冻存。
1.2.6 人源化HBB基因定点敲入细胞株纯合子、杂合子鉴定
针对猪HBB基因序列设计了一对鉴定定点敲入细胞株为纯合子或杂合子的鉴定引物,
采用1.2.5中细胞裂解产物(gDNA)为模板,用纯/杂合子鉴定引物进行扩增,上游引物sp-pHBB-iden-F1(AGGCAGGATGCCGTTTAGAA);下游引物sp-pHBB-iden-R1(CACTATCACGTTGCCCAGGA)。反应体系为:DNA 2 μL,Premix Ex Taq 10 μL,上下游引物浓度为10 μmol/L各取 0.4 μL,ddH2O 补足体积至20 μL。反应程序同步骤1.2.5。

表5 单克隆细胞定点敲入鉴定引物Table 5 Primers used for hHBB knock-in examination
1.2.7 人源化HBB基因在猪成纤维细胞中表达情况鉴定
根据人和猪HBB基因CDS区的差异,设计一对针对人源化HBB基因表达的鉴定引物,上游引物hHBB-iden-qF1(CTGAGGAGAAGTCTGCCGTTAC),下游引物hHBB-iden-qR1(CAGGCCATCACTAAA GGCAC)。提取人源化HBB基因发生定点整合细胞株的总RNA,随后反转录为cDNA,用鉴定引物hHBB-iden-qF1/R1进行检测。反转录反应体系为:RNA 500 ng,Anchored Oligo(dT)18 1 μL,2X TS Reaction Mix 10 μL,TransScript RT/RI Enzyme Mix 1 μL,RNase-free Water补足体积至 20 μL。 反应程序为:42℃,30 min 孵育。
PCR 反应体系为:cDNA 1 μL,Premix Ex Taq 10 μL,上下游引物浓度为 10 μmol/L 各取 0.4 μL,ddH2O 补足至 20 μL。 反应程序为:98℃,1 min;98℃ 10 s,62℃ 30 s,72℃, 13 s,循环 35 次;72℃5min。同时,用内参引物作为对照,按照前面的体系及反应程序进行扩增。
2 结果
2.1 人、猪和鼠HBB基因比较分析
通过MegAlign7软件Construct-Test Neighbor joining Tree算法对包括小鼠、猪、猴等8种哺乳类动物与人HBB基因做系统发育树分析,结果发现:人HBB遗传距离与灵长类动物最近,其次为猪,再其次为小鼠。即相比于小鼠而言,猪与人类HBB基因遗传距离更近(图1A)。我们进一步利用UniProt网站在线软件Clustal Omega对人、猪和小鼠β-珠蛋白氨基酸序列进行比对。结果表明:小鼠与人β-珠蛋白氨基酸一致性为80%,而猪与人β-珠蛋白氨基酸一致性则更高,达到85%(图1B)。总之,以上结果提示:猪β-珠蛋白在其生物学功能上或许与人β-珠蛋白更为相似,暗示以猪HBB蛋白突变体而构建地贫模型,更能模拟出人地贫症的机制。
2.2 CRR-sgRNA表达载体活性验证结果
本研究中合成了11条靶向sgRNA,分别连接CRR质粒,构建成11个CRR-sgRNA表达载体,并分别与CRISPR/Cas9表达载体共转染至PK15细胞中。48 h后,提取细胞基因组DNA作为PCR模板,用鉴定引物做PCR,扩增产物进行T7酶切和凝胶成像作鉴定。结果表明鉴定引物对#2sgRNA扩增后产物片段大小为913 bp,T7酶切后片段大小为364 bp和549 bp;鉴定引物对#11sgRNA扩增后产物片段大小为877 bp,T7酶切后片段大小为393 bp和484 bp,#2sgRNA和#11sgRNA这两条剪切活性高于其他9份(图2)。
2.3 人源化打靶载体构建结果
首先,以猪基因组DNA为模板,构建同源臂载体pGH-LA-RA,其中左臂1.062×103,右臂1.024×103。其次,利用融合PCR方法将人HBB突变体插入pGH-LA-RA的两个同源臂之间,构建成带有人源化HBB基因突变体(-CTTT)的同源重组终载体pGH-LA-hHBB-RA。进行sanger测序验证,测序结果表明:携带有人源化HBB基因突变体的同源重组载体构建成功,图3所示包含“-CTTT”四碱基缺失的测序结果的峰图,可用于下一步的转染。
2.4 单克隆细胞株鉴定结果
利用电穿孔转染法 CRISPR/Cas9质粒、#2sgRNA和#11sgRNA及pGH-LA-hHBB-RA同源重组载体共同转入巴马猪胎儿成纤维细胞,经G418筛选后共获得了99株单克隆细胞。再利用转基因鉴定引物对敲入的人源化HBB基因突变体做PCR扩增,扩增后片段大小为1105 bp,凝胶成像结果如图4A所示,结果统计如图4B所示:一共鉴定了99株细胞,转基因阳性细胞克隆为69份,转基因阴性细胞克隆为30份。

图1 比较分析人、猪和小鼠HBB基因序列Note.A.Building the phylogenetic trees for HBB genes of 8 different mammals.B.Identities of β-globin amino acid among human, pig and mouse.Figure 1 Identities of the HBB gene sequence among human,pig and mouse
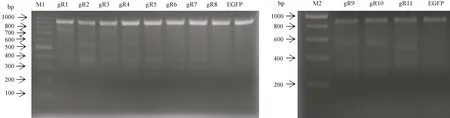
图2 猪HBB基因sgRNA T7酶切活性验证结果Note.gR1~11.Cell samples transfected with sgRNA1~11 plasmids respectively.EGFP.Control cell sample transfected with EGFP plasmid.M1.100 bp DNA ladder marker.M2.200 bp DNA ladder marker.Figure 2 T7 Enzyme digestion for Pig HBB gene sgRNA activity examination

图3 同源重组打靶载体测序结果Figure 3 Homologous recombination targeting vector sequencing results
左端同源臂鉴定,上游引物位于左端同源臂外侧,下游引物位于人源化HBB基因特异性区域内,可完全扩增出左同源臂全长及部分hHBB基因,PCR产物大小为1550 bp,扩增结果如图5A所示。结果统计如图5B:一共鉴定了99株细胞,阳性细胞克隆为25株,阴性细胞克隆为74份。
右端同源臂鉴定,上游引物位于hHBB基因特异性区域,下游引物位于右端同源臂外侧,PCR产物大小为1507 bp,扩增结果如图6A所示。结果统计如图6B所示,一共鉴定了32株细胞,阳性细胞克隆为15份,阴性细胞克隆为17份。总之,通过对99个细胞克隆的筛选与基因型鉴定,我们一共获得69株整合人HBB基因的猪成纤维细胞,其中定点整合15株,随机定点整合54株。
通过上述3重PCR鉴定,筛选出3对引物都鉴定为阳性的单克隆细胞,并做hHBB突变体位点的sanger测序。如图7所示,猪HBB基因靶序列为CTTC,正常人源HBB基因靶序列为CTTT,而人源HBB基因突变体对应的位置缺少4个碱基(-CTTT),测序结果(图7A)证明:我们在巴马胎猪胚胎成纤维细胞中成功地插入了人源化HBB基因的突变体。随后,我们通过对猪内源HBB(pHBB)基因检测,发现全部样品均能扩增到pHBB条带,并未鉴定到纯合子细胞,即本实验所得15株细胞均为杂合子(图7B)。最后,通过提取细胞总RNA和进一步的PCR验证,我们共获得6株阳性表达外源HBB基因的突变体(图7C)。
3 讨论

图4 转基因阴阳性鉴定引物扩增结果Note.A.Amplification result of transgene identification primer.M.100 bp plus DNA Ladder Marker.P.Positive control.WT.Wild type control.1~5.The number of cell clones identified.B.Number of positive and negative cell clones.Figure 4 Amplification result of transgenic negative and positive identification primers

图5 跨左端同源臂鉴定引物扩增结果Note.A.Identify primer amplification results across the left homology arm.M.1 kb DNA ladder marker.1~6.The number of cell clones identified.B.Number of positive and negative cell clones.Figure 5 Identify primer amplication results across the left homology arm
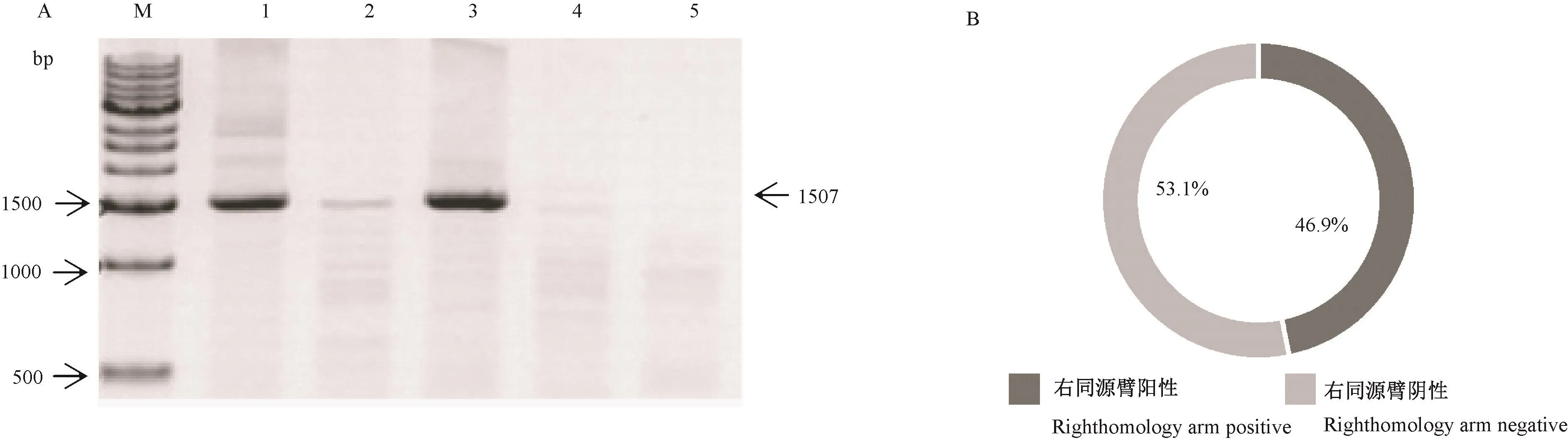
图6 跨右端同源臂鉴定引物扩增结果Note.A.Identify primer amplification results across the right homology arm.M.1 kb DNA Ladder Marker.1~5.The number of cell clones identified.B.Number of positive and negative cell clones.Figure 6 Identify primer amplication results across the right homology arm
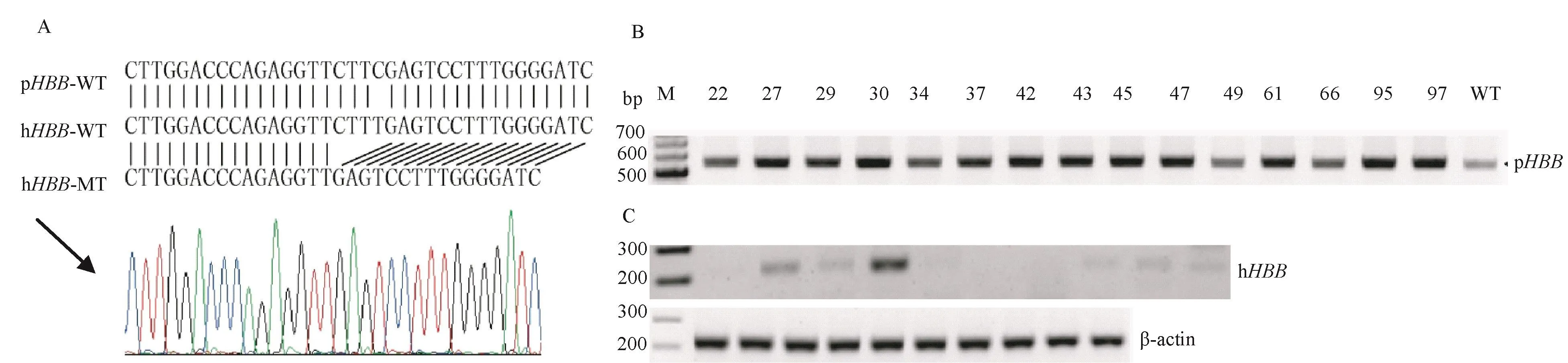
图7 猪胎儿成纤维细胞hHBB基因型及基因表达检测Note.A.Sequence comparison of swine wild-type HBB gene,human wild-type HBB gene and human mutant HBB gene.B.Identification of 15 homozygous and heterozygous site-specific knock-in cell lines.C.Identification results of humanized HBB gene expression in targeted knock-in cell lines.Figure 7 hHBB genotype and mRNA expression examination in the pig fibroblasts
我国的地贫患者主要分布于广东、广西、湖南、四川、云南和贵州等南部省份[9],β地中海贫血是广东省发病较高的地贫类型[10]。β地贫涉及到200多种 β珠蛋白突变,热点的突变类型包括Codons41/42(-CTTT)、IVS-II-654(C→T)、-28(A→G)、IVS1.6(T→C)、-87(C→G)等,其中 Codons41/42(-CTTT)作为主要的突变体约占发病人群的36%以上。β珠蛋白基因在哺乳动物中保守性较好。由于纯合敲除的小鼠致死性较高,加上缺乏特定的突变体,应用性较差。相比而言,携带人源化突变体的杂合小鼠能较好模拟β-地贫的相关症状,同时包含特定的人类突变位点,为基因治疗提供了理想的靶点材料[4]。然而,我们对小鼠、猪与人的HBB基因和蛋白氨基酸比对发现,小鼠、猪与人的HBB蛋白同源性分别为80%和85%,较小鼠而言猪与人HBB遗传距离更近。根据这些数据我们推测,无论是研究HBB基因功能,或是研究HBB突变体致地贫发病机制,利用猪为研究对象更能模拟其在人体内的生物学本质。且小鼠由于体型大小和生理生化数据一致性的限制,并不是基因治疗最为理想的疾病模型。本研究采用同样的思路构建了携带人源化HBB基因突变体同源打靶载体,并利用两条靶向切割猪内源HBB基因的sgRNA对其进行了敲除,同时结合同源重组修复,使得携带了目的突变体的人源HBB基因准确地敲入到巴马猪胎儿成纤维细胞基因组之中。该方法制备的突变体敲入阳性细胞可作为核供体,借助体细胞克隆技术,为下一步创制携带缺陷型人源化HBB基因的地贫模型猪奠定基础。
本研究中,我们将CRISPR/Cas9体系及同源重组载体经电转染方式导入巴马猪胎儿成纤维细胞,并结合G418药物筛选获得单克隆细胞。我们一共鉴定了99株单克隆,其中转基因阳性克隆69株,效率为69.7%,定点敲入人源化HBB基因突变体的阳性细胞15株,阳性率为15%。在这些成功定点敲入的细胞中1株纯合,其余为杂合,单等位基因的同源重组效率远高于双等位基因。
CRISPR/Cas9技术的介导可提高同源重组效率达千倍以上,远远高于传统基因打靶效率,相比而言,我们的结果稍低于同类定点整合效率。相关研究表明定点整合效率与多种因素有关,如细胞类型、同源臂的长短、细胞周期、转染效率等[11-15]。从细胞DNA修复机制看,非同源末端连接修复和同源重组修复同时存在,但在非分裂期的细胞中,细胞会更偏向于非同源末端连接修复,如此一来,重组效率在一定程度上受到了影响,人们常用NHEJ的抑制剂Scr7或HDR相关RAD51激动剂RS-1,从而使同源重组修复效率显著提高[16]。在转染效率方面,一方面,不同的转染方式会影响效率,慢病毒或核转染比电转染、脂质体等其他转染方式效率更高;另一方面,转染体系的构成在一定程度上也会影响转染的效率,多个载体共转染较单个多基因表达载体效率低[17]。当然,我们可以通过药物筛选或流式细胞仪富集的方式来弥补转染效率的不足,从而提高同源重组效率。
在同源臂长度研究方面,传统的基因打靶研究表明同源臂长度与重组效率成正比[18],但在CRISPR/Cas9介导的HDR中,同源臂的影响并不一定是正相关,不同的研究有不同的结果,如Li等[19]利用5’端1.2×103同源臂长度,3’端5.6×103同源臂长度的打靶载体结合TALEN技术在猪Rosa26位点获得31.3%的整合效率;Ruan等[20]利用左右同源臂长度均为0.8×103的载体结合CRISPR/Cas9技术在猪H11位点获得23%的整合效率;此外,Xie等[21]的研究结果表示当5’端、3’端同源臂长度分别为0.5×103和1×103时整合效率较高,能达到29.6%;相比而言,我们打靶载体左臂1.062×103,右臂1.024×103。可见,同源臂的长短能在一定程度上影响同源重组效率,但并没有一致性的规律。
本研究以巴马猪胎儿成纤维细胞作为研究材料,利用CRISPR/Cas9基因编辑手段,制备出携带人源化HBB基因突变体的转基因阳性细胞株。未来,这些阳性细胞可作为核供体,为下一步创制携带缺陷型人源化HBB基因的地贫模型猪奠定基础,也为人们研究地贫的发生机制和临床治疗提供珍贵的材料。