低温治疗后不同复温速率对心搏骤停复苏大鼠神经元自噬的影响
2021-01-14孙大伟崔德荣
李 艺,胡 月,孙大伟,崔德荣
上海交通大学附属第六人民医院麻醉科,上海 200233
心搏骤停发病率高,存活率低;且复苏成功后,易遗留神经功能障碍,致残率高[1]。心搏骤停患者自主循环恢复可造成脑缺血再灌注后6 h 内,钙离子超载,大量炎症因子、氧自由基和毒性神经递质释放,这是患者神经元损伤的主要原因。低温治疗被美国心脏协会推荐为心搏骤停患者自主循环恢复后的常规治疗方法[2]。研究结果[3-4]表明,心搏骤停患者自主循环恢复后将患者温度降至32 ~36 ℃并持续24 ~48 h,进而慢速复温后,患者的神经功能预后与生存率显著高于常温组。其主要作用机制包括降低脑氧耗、减少炎症因子释放、抑制氧自由基生成、减少毒性神经递质释放等[5-6]。
低温过程包括诱导期、维持期和复温期,其中复温期是低温治疗过程中最关键的环节。有研究[7]表明,低温治疗后慢速复温可避免颅内压增高;而快速复温引起炎症因子白细胞介素6(interleukin 6,IL-6)、IL-10 升高,逆转低温治疗效果,降低生存率[7-9]。探索低温治疗后不同复温速率所涉及的分子机制对减少低温治疗并发症、改善患者预后、推广低温治疗临床应用具有重要意义。
既往研究[10-11]表明脑缺血再灌注可过度激活自噬,导致神经元死亡。自噬既是细胞的一种死亡机制,也是细胞的一种保护性机制[12]。自噬过程中自噬小体形成后,包裹待降解物质运送至溶酶体,溶酶体降解自噬小体,产生小分子代谢物,该过程也称为自噬流。其中溶酶体起着重要的作用,其功能异常可导致多种疾病,如溶酶体储存病等[13]。本课题组既往研究[14]结果表明,未经低温治疗的SD 大鼠脑缺血再灌注损伤后,氧自由基产生增加,自噬激活和溶酶体功能障碍,表现为溶酶体相关膜蛋白(lysosome-associated membrane protein 2,LAMP2)以及溶酶体水解酶组织蛋白酶D(cathepsin D)表达量降低、自噬流受损,导致神经元损伤。另有研究[10]表明,心搏骤停复苏后的低温治疗可抑制自噬过度激活,对神经元产生保护性作用,但目前关于低温治疗过程中不同复温速率所涉及的具体分子机制尚不明确。本研究旨在通过观察自噬以及溶酶体功能在低温治疗后复温过程中的变化,揭示该过程中所涉及的具体分子机制,从而改进低温治疗方案,为低温临床应用提供理论基础,提高目标体温管理治疗在临床上的使用率。
1 对象与方法
1.1 研究对象
1.1.1 实验动物 雄性SPF 级SD 大鼠,2 ~3 月龄,体质量250 ~350 g,购于上海斯莱克实验动物有限责任公司,实验动物生产许可证号为SCXK(沪)2017-0005。大鼠饲养于上海交通大学附属第六人民医院实验动物中心,实验动物使用许可证号为SYXK (沪) 2011-0128。所有实验动物操作流程符合上海交通大学附属第六人民医院伦理委员会相关规定。
1.1.2 实验试剂和仪器 微管相关蛋白1 轻链3- Ⅱ(microtubule-associated protein 1 light chain 3- Ⅱ,LC3- Ⅱ)抗体、P62 抗体、LAMP2 抗体、cathepsin D 抗体、荧光二抗Alexa Fluor®488 购自英国Abcam 公司,Beclin1(Bcl 2- interacting protein-1)抗体购自美国Santa Cruz 公司,泛素蛋白ubiquitin 抗体购自美国CST 公司,β-肌动蛋白(β-actin)抗体购自中国杭州华安生物技术有限公司,化学发光(enhanced chemiluminescence,ECL)试剂、RIPA蛋白裂解液购自美国Thermo Fisher 公司,Triton X-100 购自美国Sigma 公司,苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、盐酸氯喹、尼式染色液、蛋白定量试剂盒(BCA Protein Assay Kit)购自上海碧云天生物技术有限公司。亚低温治疗仪购自中国众实迪创公司,鼠机械通气仪购自美国哈佛仪器公司,化学发光成像仪(Image-Quant LAS 4000)购自美国GE 公司,倒置荧光显微镜(DM IL LED)购自德国Leica 公司。
1.2 实验方法
1.2.1 动物模型的建立 建立SD 大鼠窒息性心搏骤停复苏模型,取SD 大鼠80 只,随机分为假手术组(15 只)、常温组(15 只)、慢速复温组(30 只)和快速复温组(20只)。使用3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,进行左侧股动脉、右侧股静脉置管和气管插管,并连续监测大鼠肛门温度和动脉血压变化。假手术组同样进行上述手术准备步骤,但无心搏骤停复苏处理。常温组、慢速复温组、快速复温组于右侧股静脉注射肌肉松弛剂罗库溴铵(2 mg/kg),使自主呼吸停止持续5 min 且平均动脉压下降至25 mmHg 以下持续2 ~3 min 后,立刻进行机械通气、胸外心脏按压并静脉注射肾上腺素(100 µg/kg)。自主循环恢复后,常温组使用加热板,维持体温(37.0±0.5) ℃;慢速复温组和快速复温组即刻进行34 ℃持续4 h 的低温治疗,低温治疗以及后续的复温都是通过亚低温治疗仪进行,该设备可监测并自动调节直肠温度至设定点。随后,慢速复温组以0.5 ℃ /h 复温,快速复温组以4 ℃ /h 复温至(37.0±0.5) ℃。慢速复温组和快速复温组的SD 大鼠中各随机选取5 只,作为慢速复温氯喹组和快速复温氯喹组,于建模前1 h 腹腔注射氯喹10 mg/kg。
1.2.2 尼式染色 用于尼氏染色的SD 大鼠,在低温治疗结束后24 h 取材,每组5 只。冰冻切片室温放置30 min后,蒸馏水洗涤2 次(每次2 min),尼式染料滴于脑片上,于37 ℃孵育10 min 后,蒸馏水洗涤2 次,依次使用95%、70%乙醇脱水,二甲苯通透5 min,封片,显微镜下拍片。每只大鼠取3 张切片,每张切片在大脑皮质区域随机取5个视野(400 倍镜下),计算每个高倍镜视野下活细胞数目。正常神经元的尼氏小体呈蓝紫色,体积大而数量多,神经元受损时细胞皱缩,尼氏小体呈蓝色,数量减少甚至消失。
1.2.3 Western blotting 蛋白检测 假手术组、常温组、快速复温组于低温治疗结束后6 h 取材,每组5 只;慢速复温组于低温治疗结束后6、12、24 h 取材,每个时间点5只。3%戊巴比妥钠腹腔注射麻醉后,使用0.9%生理盐水经心脏灌注,取出脑组织并置于冰上取下双侧运动皮层M1、M2 区。将取下的脑组织与PMSF、蛋白酶抑制剂混匀以后使用研磨器研磨。研磨物于4 ℃下12 000×g离心20 min,取上清液,使用BCA 法检测蛋白浓度。SDS-聚丙烯酰胺凝胶电泳分离目标蛋白后转移至PVDF膜,使用5%脱脂奶粉室温封闭1 h,PVDF 膜洗涤后加入抗P62(1:2 000)、抗Beclin1(1:2 000)、抗LC3- Ⅱ(1:3 000)、抗LAMP2(1:500)、抗cathepsin D(1:1 000)、抗ubiquitin(1:1 000)的一抗,于4 ℃摇床孵育过夜。次日,室温二抗孵育1 h 后,于PVDF 膜上覆盖化学发光显影剂曝光。采用Image J 对免疫印迹条带进行灰度值分析。
1.2.4 免疫荧光检测 在低温治疗结束后12 h 取材,每组5 只。3%戊巴比妥钠腹腔注射麻醉后,使用0.9%生理盐水经心脏灌注,继而用4%多聚甲醛持续灌注后取脑组织。置入浓度为20%~30%的蔗糖溶液依次梯度脱水后,浸泡于4%多聚甲醛固定24 h,于-80 ℃保存。使用OGD 包埋液包裹脑组织,于-20 ℃冰冻切片,厚度约20 µm,贴于载玻片上,置于-20 ℃保存备用。
将制备好的冰冻切片室温放置30 min 后,磷酸盐缓冲液洗涤10 min,重复3 次。5%胎牛血清室温封闭1 h后,使用0.25% Triton X-100 室温破膜10 min,随后加入抗LAMP2(1:200)、抗LC3- Ⅱ(1:100)的一抗,4 ℃孵育过夜。次日,磷酸盐缓冲液清洗,荧光二抗室温孵育1 h,核酸染料4', 6-联脒-2-苯基吲哚(4', 6-diamidino-2-phenylindole,DAPI)室温10 min 染细胞核,于倒置荧光显微镜下观察拍片。每只大鼠取3 张切片,每张切片在大脑皮质区域随机取5 个视野(400 倍镜下),观察阳性蛋白的荧光强度。
1.3 统计学方法
应用SPSS 22.0、GraphPad Prism 7.0 以及Adobe Photoshop CC 2017 进行数据统计和图形制作。定量资料以±s 表示,采用单因素方差分析,Bonferroni 检验进行两两比较。P<0.05 认为差异有统计学意义。
2 结果
2.1 不同复温速率对神经元活性的影响
为观察窒息性心搏骤停复苏低温治疗后,不同复温速率对大鼠神经元活性的影响,使用尼氏染色检测低温治疗结束后24 h 大鼠运动皮层神经元的改变。检测结果(图1) 显示,快速复温组运动皮层活细胞数为每个高倍镜(×400)视野下(22.0±2.5)个,慢速复温组为每个高倍镜(×400)视野下(55.0±4.2)个,快速复温组神经元活细胞数显著低于慢速复温组(P<0.05),且与常温组差异无统计学意义。
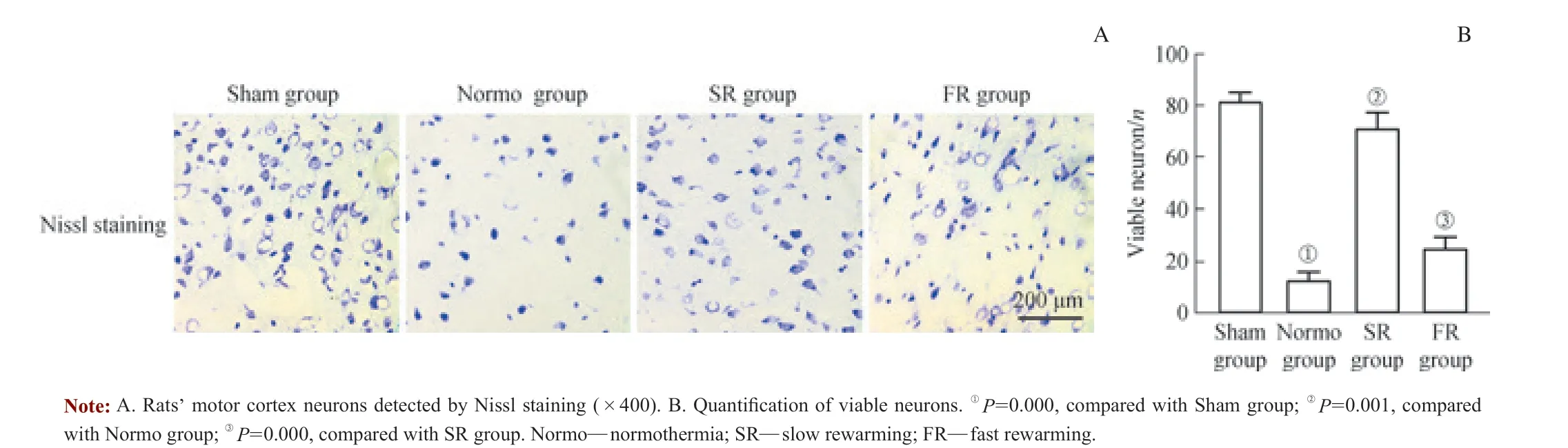
图1 不同复温组大鼠运动皮层尼式染色Fig 1 Nissl staining of rat motor cortex in different rewarming groups
2.2 慢速复温对自噬的影响
为观察复温对自噬的影响,使用Western blotting 测定慢速复温组低温治疗后6、12、24 h 的自噬激活标志蛋白LC3- Ⅱ与Beclin1 的蛋白表达量。结果(图2A)显示,与假手术组和常温组比较,6 h 和12 h 后,LC3- Ⅱ以及Beclin1 水平增高。自噬选择性底物受体P62,能够识别待降解物,并将其运送到自噬溶酶体。P62 表达水平在6 h检测到最低,且低于假手术组和常温组。进一步使用免疫荧光法检测细胞LC3- Ⅱ的表达情况,结果(图2B)显示慢速复温过程中,LC3- Ⅱ阳性细胞计数较假手术组和常温组显著增加,以上结果表明在慢速复温过程中自噬激活且自噬流通畅。

图2 慢速复温过程中自噬相关蛋白的表达情况Fig 2 Expression of autophagy associated proteins during slow rewarming
2.3 不同复温速率对溶酶体功能的影响
为进一步观察不同复温速率对溶酶体功能的影响,我们检测了不同复温组低温治疗结束后6 h 溶酶体相关蛋白LAMP2 和cathepsin D 的表达水平。Western blotting 结果(图3)显示,与假手术组和慢速复温组相比,常温组和快速复温组LAMP2 和cathepsin D 的表达水平降低,差异均有统计学意义(均P<0.05),常温组和快速复温组蛋白表达量之间差异无统计学意义。使用免疫荧光法检测溶酶体LAMP2 在皮质神经元中的表达,结果显示,与慢速复温组相比,快速复温组LAMP2 阳性细胞率降低,与常温组无明显差异。以上结果说明低温治疗后快速复温导致大脑皮质神经元溶酶体功能发生障碍,并且与常温组无明显 差异。
2.4 不同复温速率对自噬流的影响
自噬受体蛋白P62 以及泛素蛋白ubiquitin 是反映自噬通量的关键蛋白。氯喹可抑制溶酶体水解酶活性,进而使自噬流受损,其常作为检测自噬流受损的阳性对照物。对复温组大鼠增加氯喹处理,可进一步观察溶酶体功能障碍对慢速和快速复温过程中自噬流的影响。结果(图4)显示,与慢速复温组(未注射氯喹)相比较,慢速复温氯喹组P62 和ubiquitin 表达水平在低温治疗结束后6 h 显著增加,提示慢速复温组自噬流通畅。但快速复温氯喹组较快速复温组(未注射氯喹),P62 和ubiquitin 表达水平显著降低,表明快速复温组溶酶体功能障碍且自噬流受损。
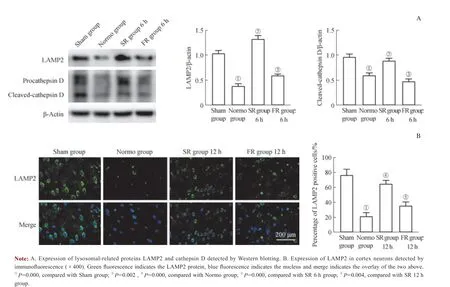
图3 不同复温组溶酶体相关蛋白的表达情况Fig 3 Expression of lysosomal-related proteins in different rewarming groups
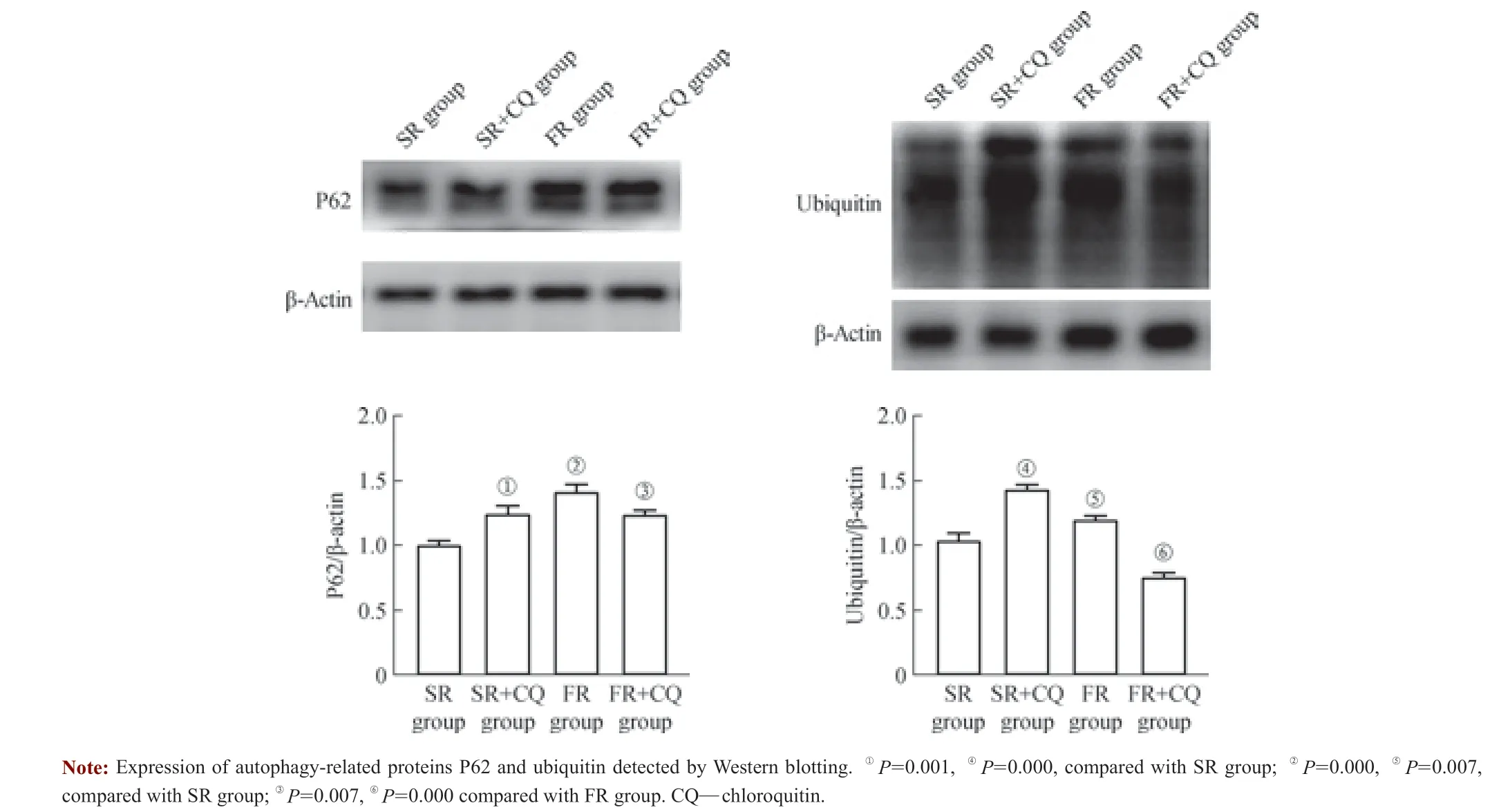
图4 不同复温速率对自噬流的影响Fig 4 Effect of different rewarming rates on autophagy flux
3 讨论
研究[3]表明,34 ~36 ℃持续24 h 的全身性低温治疗能显著提高心搏骤停后心肺复苏患者的存活率和改善神经功能预后。但对部分心搏骤停的患者,低温对患者结局并无显著效果,且由于低温治疗本身带来的不良反应[15],如心率减慢、血压降低、凝血功能异常等,致使低温治疗在临床上的使用率低。复温是患者体温从持续低温治疗恢复到常温的过程,是低温治疗过程中的一个关键步骤。另有研究[8,16]报道,尽管低温治疗可改善患者心功能、神经功能及提高生存率,但复温过程可诱导皮质神经元凋亡且快速复温(2 ℃ /h)可逆转低温治疗对心肌及脑组织的保护性作用。本研究结果也证实了这一现象,尼式染色结果提示快速复温组活细胞计数显著低于慢速复温组。关于复温阶段,不同的温度变异度对细胞生理功能如何产生影响,其中涉及的分子机制是什么,目前尚未阐明。
自噬是细胞内溶酶体对损伤的蛋白质和细胞器吞噬降解并释放小分子物质供机体使用的过程。自噬过程包括自噬小体形成、自噬小体包裹待降解物运送至溶酶体、溶酶体与自噬体相结合、内容物降解及释放的过程。其中Beclin1 作为上游信号分子调控自噬膜的形成;LC3- Ⅰ作为其下游信号分子,在形成双层膜结构过程中与磷脂酰乙醇胺(PE)连接,形成LC3- Ⅱ,此标志着自噬的起始[17]。根据本课题组既往研究[14],心搏骤停复苏后未使用低温治疗的SD 大鼠溶酶体功能障碍自噬流受损,导致神经元的死亡,本研究进一步探索这一机制在脑缺血再灌注-低温治疗-复温过程中所扮演的角色。结果显示,慢速复温组LC3- Ⅱ和Beclin1 均在低温治疗结束后6 h 升高,且在12 h 时仍显著高于常温组,同时伴随自噬受体蛋白P62 的降低,提示复温过程中自噬激活且自噬流通畅,推测低温治疗联合慢速复温对未使用低温治疗组的自噬流受损有修复作用,这一机制与低温治疗提高神经元活力相一致。
溶酶体在自噬过程中起到关键性作用,其功能的完整性对于自噬小体的降解至关重要[18]。研究[19]表明,溶酶体功能障碍导致溶酶体储存病,引起机体一系列病理生理改变。溶酶体蛋白水解酶cathepsin D 的活性,反映着溶酶体的功能;溶酶体膜蛋白LAMP2 反映着溶酶体数量的多少[20]。本研究结果检测到快速复温组较慢速复温组LAMP2 和cathepsin D 表达量均降低,提示快速复温组溶酶体功能异常。这一生物事件的发生与快速复温组神经元的死亡率增加相一致。由于快速和慢速复温组之间的差异仅为复温过程中温度升高速率不同,推测低温治疗后的急剧温度变化可能引起组织代谢和耗氧量增加,氧化应激加重,最终导致溶酶体功能障碍,神经元死亡。但目前复温过程中相关的机制研究较少,确切的分子机制尚不明确。
在自噬过程中,泛素化待降解蛋白质是将其运送至溶酶体前的一个关键环节。泛素蛋白量的变化反映着自噬通量的变化。本研究中慢速复温组使用氯喹抑制溶酶体蛋白水解酶活性,泛素蛋白及P62 进一步增加,提示自噬流通畅。而快速复温组使用氯喹处理后,泛素蛋白及P62 表达水平未进一步增加,反而有下降的趋势,提示自噬流受损。结合本研究中快速复温组神经元损伤与常温组之间差异无统计学意义,推测快速复温过程中自噬流受损,逆转了低温治疗的保护性作用。
低温治疗可降低细胞氧耗,减少氧化应激及炎症因子产生,最终抑制脑缺血再灌注损伤。本研究结果发现低温治疗后的慢速复温对于保持低温治疗的有效性至关重要,而快速复温可逆转低温治疗的效果;本研究还初步探讨了快速复温逆转低温治疗效果的潜在机制,即溶酶体功能障碍,自噬流受损,为临床上改进低温治疗措施、改善患者预后提供了理论基础;但其涉及的其他分子机制还有待进一步研究。
参·考·文·献
[1] Benjamin EJ, Virani SS, Callaway CW, et al. Heart disease and stroke statistics—2018 update: a report from the American Heart Association[J]. Circulation, 2018, 137(12): e67-e492.
[2] Callaway CW, Donnino MW, Fink EL, et al. Part 8: post-cardiac arrest care. 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2015, 132(18 Suppl 2): S465-S482.
[3] Bernard SA, Gray TW, Buist MD, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia[J]. N Engl J Med, 2002, 346(8): 557-563.
[4] Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest[J]. N Engl J Med, 2002, 346(8): 549-556.
[5] Badjatia N. Therapeutic hypothermia protocols[J]. Handb Clin Neurol, 2017, 141: 619-632.
[6] Wang Q, Miao P, Modi HR, et al. Therapeutic hypothermia promotes cerebral blood flow recovery and brain homeostasis after resuscitation from cardiac arrest in a rat model[J]. J Cereb Blood Flow Metab, 2019, 39(10): 1961-1973.
[7] Burggraf M, Lendemans S, Waack I, et al. Slow as compared to rapid rewarming after mild hypothermia improves survival in experimental shock[J]. J Surg Res, 2019, 236: 300-310.
[8] Lu XY, Ma LH, Sun SJ, et al. The effects of the rate of postresuscitation rewarming following hypothermia on outcomes of cardiopulmonary resuscitation in a rat model[J]. Crit Care Med, 2014, 42(2): e106-e113.
[9] Jo YH, Kim K, Lee JH, et al. Rapid rewarming after therapeutic hypothermia worsens outcome in sepsis[J]. Clin Exp Emerg Med, 2014, 1(2): 120-125.
[10] Lu J, Qian HY, Liu LJ, et al. Mild hypothermia alleviates excessive autophagy and mitophagy in a rat model of asphyxial cardiac arrest[J]. Neurol Sci, 2014, 35(11): 1691-1699.
[11] Sun D, Wang W, Wang X, et al. bFGF plays a neuroprotective role by suppressing excessive autophagy and apoptosis after transient global cerebral ischemia in rats[J]. Cell Death Dis, 2018, 9(2): 172.
[12] 汪文英, 崔德荣, 江伟. 低氧引起PC12 细胞保护性自噬的激活[J]. 上海交通大学学报(医学版), 2015, 35(8): 1102-1107.
[13] Xu HX, Ren DJ. Lysosomal physiology[J]. Annu Rev Physiol, 2015, 77: 57-80.
[14] Wang XT, Sun DW, Hu Y, et al. The roles of oxidative stress and Beclin-1 in the autophagosome clearance impairment triggered by cardiac arrest[J]. Free Radic Biol Med, 2019, 136: 87-95.
[15] Leong SH, Chan E, Ho BC, et al. Therapeutic temperature management (TTM): post-resuscitation care for adult cardiac arrest, with recommendations from the National TTM Workgroup[J]. Singapore Med J, 2017, 58(7): 408-410.
[16] Wang B, Armstrong JS, Lee JH, et al. Rewarming from therapeutic hypothermia induces cortical neuron apoptosis in a swine model of neonatal hypoxicischemic encephalopathy[J]. J Cereb Blood Flow Metab, 2015, 35(5): 781-793.
[17] Hurley JH, Young LN. Mechanisms of autophagy initiation[J]. Annu Rev Biochem, 2017, 86: 225-244.
[18] Ryter SW, Bhatia D, Choi ME. Autophagy: a lysosome-dependent process with implications in cellular redox homeostasis and human disease[J]. Antioxid Redox Signal, 2019, 30(1): 138-159.
[19] Mizunoe Y, Kobayashi M, Tagawa R, et al. Association between lysosomal dysfunction and obesity-related pathology: a key knowledge to prevent metabolic syndrome[J]. Int J Mol Sci, 2019, 20(15): 3688.
[20] Eskelinen EL. Roles of LAMP-1 and LAMP-2 in lysosome biogenesis and autophagy[J]. Mol Aspects Med, 2006, 27(5-6): 495-502.
