ALG3 异常的先天性糖基化疾病相关突变蛋白活性的检测
2021-01-14罗冰洁李盛陶高晓冬
罗冰洁,李盛陶,王 宁,高晓冬
江南大学生物工程学院糖化学与生物技术教育部重点实验室, 无锡 214122
先天性糖基化疾病(congenital disorder of glycosylation,CDG)是由糖链合成缺陷引起的先天性新陈代谢紊乱遗传病,可能会导致严重的精神运动迟缓和多器官衰竭[1-2],大多数CDG 由糖基转移酶功能的异常引起。
α-1,3-甘露糖转移酶(α-1,3-mannosyltransferase,ALG3)基因编码的蛋白存在于内质网(endoplasmic reticulum,ER)腔内,具有多个跨膜域,以多萜醇磷酸甘露糖(dolichylphosphomannose,Dol-P-Man) 为 供 体、Dol-PPGlcNAc2-Man5(DP-Gn2-M5)为受体[3],在N-糖链α-1,6 连接的甘露糖上添加α-1,3 连接的甘露糖残基,是蛋白N-糖基化前体多萜醇寡糖(dolichol-linked oligosaccharide,DLO)合成途径中的重要蛋白。人体ALG3 蛋白发生突变会使DLO 合成受阻,积累糖链中间体GlcNAc2-Man5(Gn2-M5)而导致蛋白糖基化异常,引起ALG3-CDG。ALG3-CDG 患者的共同临床特征包括畸形特征(小头畸形、面部畸形等)、精神运动迟缓、癫痫和体质量增加缓慢[4-6]、肌张力异常和舞蹈病等[6-7]。研究[4-5,8-9]发现,不同ALG3-CDG 患者表现出的疾病严重程度,包括患者的寿命等均存在差异,其根本原因是ALG3 蛋白发生突变的位点不同而导致酶活性下降的程度不同。
DLO 合成途径在几乎所有真核生物内质网中具有保守性,因此可以使用酵母作为模板研究人类CDG 相关ALG 突变蛋白的致病性。将酵母ALG 基因突变或敲除后,由于蛋白合成过程异常会导致酵母出现温度敏感的生长缺陷,再将CDG 相关的人ALG 突变体转入生长缺陷的酵母中,根据其能否回补酵母的生长缺陷来确定此突变位点是否具有致病性[10-11]。然而研究者发现,ALG3 基因敲除的酵母菌没有明显生长缺陷,需要同时敲除寡糖基转移酶(oligosaccharyl transferase,OST)的一个亚基,才能使酵母出现一定的温度敏感生长缺陷,再通过回补实验来衡量ALG3 突变蛋白的活性与ALG3-CDG 疾病严重程度的相关性[12-15]。此方法操作复杂且灵敏度低,导致许多ALG3-CDG 相关突变的致病性尚未得到确认[4-5,16],因此开发一种直观、简洁的检测方法具有非常重要的意义和应用 前景。
本实验室前期研究[17]利用大肠埃希菌(Escherichia coli,E. coli)表达了酵母ALG1 蛋白及其突变体,开发了体外ALG1 蛋白活性的液相色谱-质谱联用技术(liquid chromatography tandem mass spectrometry,LC-MS) 定 量检测方法,并利用该方法对ALG1-CDG 患者的疾病严重程度进行了分析。随后为了探究ALG3-CDG 患者ALG3突变蛋白活性与疾病的关系,首先在酿酒酵母来源的ALG3 蛋白N-端引入相对分子质量约13 000 的Mistic 标签,促进其异源表达[18],然后在大肠埃希菌体系中表达了Mistic-ALG3 重组蛋白,并利用LC-MS 的方法测定了该蛋白的活性[19-20]。在此基础上,本研究根据文献[4-5,8-9]报道的ALG3-CDG 患者的蛋白突变情况对酿酒酵母ALG3 中的对应保守性氨基酸进行了定点突变,探究突变蛋白活性与ALG3-CDG 疾病严重程度之间的相关性。
1 材料与方法
1.1 主要试剂及菌株
PrimeSTAR GXL DNA 聚合酶、限制性核酸内切酶、DNA Ligation Kit(Mighty Mix)、2×Taq Master Mix 购于宝日医生物技术(北京)有限公司,PCR 产物纯化试剂盒、DNA 胶回收试剂盒、柱式质粒DNA 小量提取试剂盒、卡那霉素、氯霉素、脱脂奶粉、异丙基-β-D-硫代 半 乳 糖 苷(isopropyl-β-D-thiogalactoside,IPTG) 购于生工生物工程(上海)股份有限公司,SDS-PAGE 凝胶配制试剂盒、BCA 蛋白浓度测定试剂盒(增强型)、Immun-Star ™ HRP 化学发光试剂盒、固相萃取空柱管(6 mL)购于上海碧云天生物技术有限公司,DNA 标志物(1 kb plus DNA ladder)、蛋白标志物(blue plus Ⅱ protein marker)、一抗(anti-His mouse monoclonal antibody)、辣根过氧化物酶偶联的二抗[goat anti-mouse IgG(H+L) HRP conjugate]购于北京全式金生物技术有限公司,固相萃取填料(supelclean ENVI-carb slurry)购于美国Sigma-Aldrich 公司,GDP-甘露糖(GDP-Man)购于青岛糖科学生物技术有限公司,其他常用试剂及培养基购于国药集团化学试剂有限公司。化学合成中使用到的蛋白质均由本实验室前期合成[17,20-21]。
大肠埃希菌生长培养基为LB(Luria-Bertani)培养基和TB(Terrific-Broth)培养基,均由本实验室自行配置。抗性培养基是在上述灭菌培养基冷却至55 ℃以下后,额外添加50 μg/mL 卡那霉素和/或34 μg/mL 氯霉素获得。
本研究所用到的大肠埃希菌XL-10 Gold 和Rosetta(DE3)均为本实验室保藏菌株。质粒pET28a-Mistic-ALG3 由本实验室构建[19]。
1.2 主要仪器
PCR 仪(T100 Thermal Cycler)、SDS-PAGE 凝 胶 电泳仪(Mini-PROTEAN Tetra System)、蛋白转膜仪(Trans-Blot Turbo)均购于美国Bio-Rad 公司,凝胶成像系统(Tanon-5200Multi)购于上海天能科技有限公司,高速冷冻离心机(CT15RE)购于日本HITACHI 公司,超高效液相色谱酰胺柱(UPLC BEH Amide Column)购于美国Waters 公司,超高效液相色谱仪(Dionex Ultimate 3000 UPLC)、三重四级杆液质联用仪(TSQ Quantum Ultra EMR)购于美国Thermo Fisher Scientific 公司。
1.3 实验方法
1.3.1 突变位点的确定 收集文献[4-5,8-9]已报道的ALG3-CDG 患者ALG3 蛋白6 个突变位点(I69T、W71R、G96R、M157K、R171Q 和M209T),用Clustal X 软件对人源ALG3突变蛋白与酿酒酵母ALG3 进行同源比对,发现这6 个突变位点均在酿酒酵母ALG3 中保守,氨基酸序列比对结果见图1。并以此为依据设计了对应的酿酒酵母ALG3 突变体(I70T、Y72R、G98R、L157K、R171Q 和M221T)。

图1 酿酒酵母和人源ALG3 氨基酸序列同源比对Fig 1 Alignment of ALG3 in Saccharomyces cerevisiae (Sc) and Homo sapience (Hs)
1.3.2 融合PCR 构建点突变质粒 本研究所有突变质粒的构建参照文献[22]所述的融合PCR 方法。根据QuikChange Primer Design 网站在线设计突变引物,以质粒pET28a-Mistic-ALG3 为模板进行第1 次PCR。将第1次PCR 产物经纯化后作为引物,进行第2 次PCR。所得PCR 产物按照常规方法进行后续纯化、酶切、连接、转化、挑取单克隆提质粒测序验证。Mistic-ALG3 突变蛋白的引物见表1。

表1 Mistic-ALG3 点突变引物Tab 1 Primers of mutations for Mistic-ALG3
1.3.3 蛋白表达及大肠埃希菌菌膜成分的制备 将pET28a-Mistic-ALG3 质粒及各突变质粒转化到感受态大肠埃希菌Rosetta(DE3)中,37 ℃培养过夜后,挑取单菌落接种至5 mL 抗性LB 培养基中,37 ℃、220 r/min 摇床过夜培养(约12 h)后,按照体积的1%接种于抗性TB 培养基,37 ℃、220 r/min 摇床培养至吸光度[D (600 nm)]为0.6 ~1.0,待培养基温度降至16 ℃后添加终浓度为0.1 mmol/L 的IPTG 诱导培养20 h,收集菌体于离心管中,用适量预冷的缓冲液[25 mmol/L Tris/HCl(pH 8.0)、150 mmol/L NaCl] 吹打混匀菌体;将离心管置于冰水混合物中超声破碎,4 000×g、4 ℃离心15 min 后,取上清液于100 000×g、4 ℃离心,用提膜缓冲液[50 mmol/L 2- (N-吗啉代)乙磺酸(MES,pH 6.5)、30%甘油]重悬沉淀,使之成为均一溶液即得到含Mistic-ALG3 及其突变蛋白的大肠埃希菌菌膜成分[19]。
1.3.4 Western blotting 检测 取合适浓度的蛋白样品与蛋白上样缓冲液混合煮5 min,高速离心5 ~10 min 后取上清液上样于12% SDS-PAGE 凝胶,200 V 恒压电泳1 h。电泳结束后半干法转膜,封闭1 h 后加入一抗(抗His 标签)(1:2 000),室温孵育2 h,TBST 清洗3 次后加入二抗(1:5 000),室温孵育1 h,TBST 清洗3 次,最后用化学发光法显色。
1.3.5 Mistic-ALG3 突变蛋白活性的测定 ①底物受体Phytanyl-PP-GlcNAc2-Man5(PP-Gn2-M5)的制备[21]:以Phytanyl-PP-GlcNAc2(PP-Gn2)为底物受体,GDP-Man为糖基供体,用纯化的Alg1ΔTM、含有TRX-Alg2 的大肠埃希菌菌膜和纯化的Alg11ΔTM 进行催化。反应体系:PP-Gn2(50 μmol/L)、GDP-Man(2 mmol/L)、Alg1ΔTM(80 ng/mL)、含有TRX-Alg2 的大肠埃希菌菌膜(200 μg/mL)、反应缓冲液40 µL,30 ℃静止反应12 h 后,加入纯化的Alg11ΔTM(100 μg/mL),继续在30 ℃静止反应12 h,得到ALG3 的反应底物PP-Gn2-M5。② 糖基供体Phytanyl-Phosphate-Mannose(Phy-P-Man)的制备[19]:以Phytanyl-Phosphate(Phy-P)为底物受体,GDP-Man 为糖基供体,用含有长萜基磷酸-甘露糖转移酶多肽1(dohchylphosphate mannosyltransferase polypepfide 1,DPM1) 的大肠埃希菌菌膜进行催化。反应体系:50 mmol/L Tris/HCl(pH 7.5)、10 mmol/L MgCl2、1% NP-40、20 mmol/L Phy-P、50 mmol/L GDP-Man、含有DPM1 的大肠埃希菌菌膜(100 mg/mL),30 ℃静止反应12 h 后,用薄层色谱(TLC)检测Phy-P 是否完全转化为Phy-P-Man。③Mistic-ALG3 及突变蛋白的酶活测试:以PP-Gn2-M5 为底物受体,Phy-P-Man 为糖基供体,提取含有Mistic-ALG3或突变蛋白的大肠埃希菌菌膜进行催化反应。反应体系:在生成PP-Gn2-M5 的体系中加入2 mmol/L Phy-P-Man、10 mmol/L MnCl2、含Mistic-ALG3 或突变蛋白(20 mg/mL) 的大肠埃希菌菌膜,30 ℃静止反应20 h。
1.3.6 糖链的纯化 参照文献[19,21]的方法,在酶活测试的反应体系中加入40 mmol/L HCl 300 μL,100 ℃ 1 h 终止反应。用1 mL 固相萃取柱纯化糖链,步骤如下:分别用甲醇4 mL、100%乙腈4 mL、50%乙腈4 mL、2%乙腈10 mL 平衡柱子;取2%乙腈0.7 mL 加入到反应体系中震荡混合均匀,高速离心1 min,取上清液上样于固相萃取柱,重复该步骤1 次;之后用2%乙腈15 mL 分3 次洗脱杂质;最后用1.4 mL 30%乙腈洗脱得到目的糖链,收集到的溶液经真空冷冻干燥后,加入40 μL 去离子水溶解。
1.3.7 LC-MS 检测条件 采用LC-MS 的方法检测产物糖链[20],其中流动相A 为乙腈、B 为超纯水,使用超高效液相色谱酰胺柱分离,柱温40 ℃。液相条件为:0 ~2 min,20% B;2 ~15 min,20%~50% B;15 ~18 min,50% B。 流速为0.2 mL/min。质谱条件为阳离子模式,质荷比(m/z) 检测范围为400 ~2 000。
1.4 统计学方法
采用GraphPad Prism 7 软件进行统计分析。定量资料用±s 表示,将7 位患者按照存活时间分为小于1 年组和大于1 年组,比较2 组突变蛋白酶活性,组间比较采用t 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 大肠埃希菌表达的酿酒酵母来源重组Mistic-ALG3 的活性定量检测
首先用化学-酶法合成DP-Gn2-M5 类似物PP-Gn2-M5和Dol-P-Man 类似物Phy-P-Man,再在大肠埃希菌表达酿酒酵母Mistic-ALG3,利用其在体外催化反应生成Phytanyl-PP-GlcNAc2-Man6(PP-Gn2-M6);同时以仅转化了空质粒pET28a 的菌株(空载质粒)作为对照。反应结束后,采用LC-MS 的方法检测产物,定量分析酶活性。由图2 可知,加入表达Mistic-ALG3 的大肠埃希菌菌膜的样品出峰时间为15.2 min 和15.3 min,对应的质荷比为1 419.57,指示反应生成的产物为Gn2-M6;而加入空载质粒的样品出峰时间为14.5 min 和14.6 min,对应的质荷比为1 257.48,指示仍为反应底物Gn2-M5。

图2 酿酒酵母重组Mistic-ALG3 的活性分析Fig 2 Activity analysis of recombinant yeast Mistic-ALG3
2.2 ALG3-CDG 患者对应重组酿酒酵母ALG3 突变蛋白的原核表达
构建的6 个ALG3 突变的大肠埃希菌表达载体,经过测序验证后,分别转化到Rosetta(DE3)菌株诱导表达,超声破碎后提取大肠埃希菌菌膜成分,通过Western blotting 确认蛋白的表达。结果(图3)显示,上述6 个突变蛋白在大肠埃希菌体系中的表达量与野生型(wild type,WT)ALG3 蛋白基本一致。
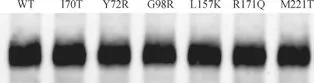
图3 酵母Mistic-ALG3 突变蛋白的原核表达Fig 3 Prokaryotic expression of yeast Mistic-ALG3 mutants
2.3 定量分析6 个突变蛋白的相对活性
通过LC-MS 对6 个突变体的活性进行测定,并与野生型ALG3 比较,计算突变蛋白的相对活性。结果(图4) 显示,I70T 突变蛋白相对活性为2.8%,Y72R 突变蛋白相对活性为4.9%,G98R 突变蛋白相对活性为4.5%,L157K突变蛋白相对活性为17.2%,R171Q 突变蛋白相对活性为4.8%,M221T 突变蛋白相对活性为22.3%。

图4 酵母Mistic-ALG3 突变蛋白的活性分析Fig 4 Activity analysis of yeast Mistic-ALG3 mutants
2.4 突变蛋白活性与患者临床特征分析
将突变蛋白的相对活性与ALG3-CDG 患者的临床特征汇总后,结果见表2。生存时间较长的患者均为杂合突变,且至少有1 个突变蛋白保留了一定的酶活性。将7 位患者按照存活时间分为小于1 年和大于1 年2 组,杂合突变患者以较高的酶活性为准,比较发现生存期大于1 年患者对应的突变蛋白活性显著高于小于1 年的患者(图5,P=0.002)。

表2 ALG3-CDG 患者突变位点与酵母对应Mistic-ALG3 突变蛋白的活性Tab 2 Mutation sites of ALG3-CDG patients and relative activity of conserved yeast Mistic-ALG3 mutants

Continued Tab
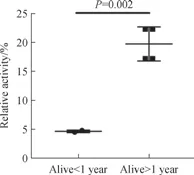
图5 不同生存期患者对应突变蛋白活性的比较Fig 5 Comparison of activities of corresponding mutations between the patients with different survival periods
3 讨论
真核生物ALG3 的天然底物中含有多萜醇(dolichol)结构,但多萜醇水溶性差且不易大量制备[23],因此本实验室前期研究中以化学-酶法制备了ALG3 底物类似物PPGn2-M5 和糖基供体类似物Phy-P-Man,并在大肠埃希菌体系表达了酿酒酵母重组Mistic-ALG3 蛋白,利用含有该蛋白的大肠埃希菌菌膜成分催化生成PP-Gn2-M6[19-21]。Mistic-ALG3 属于多次跨膜蛋白,纯化极其困难;而大肠埃希菌没有DLO 合成途径,也没有与ALG3 功能相似的同源蛋白,因此直接利用含有Mistic-ALG3 重组蛋白的大肠埃希菌膜成分催化反应是可行的[20]。在本研究中,参照上述反应体系,定量检测酿酒酵母重组Mistic-ALG3 的活性,结果确认了大肠埃希菌表达体系得到的酿酒酵母重组Mistic-ALG3 具备较高的反应活性。
本研究进而对ALG3-CDG 相关的酵母保守性Mistic-ALG3 突变蛋白的活性进行了研究。首先确认了6 个ALG3-CDG 相关酵母重组ALG3 突变蛋白在大肠埃希菌体系中蛋白表达量与野生型基本一致,因此在测量它们的活性时,反应中加入相同的总蛋白量即可对突变体和野生型蛋白进行相对活性的比较。
将本研究LC-MS 定量检测的突变蛋白相对活性与文献报道的ALG3-CDG 患者临床特征汇总后发现:患者1[4]、 患者6 和患者7[9]为纯合子突变,即患者ALG3 基因所在的2 条染色体有相同的突变位点。患者1 的突变为R171Q,测得其对应的酿酒酵母突变蛋白R171Q 的相对活性仅为4.8%;患者6 和7 的突变为G96R,测得其对应的酿酒酵母突变蛋白G98R 的相对活性仅为4.5%,均与3位患者较短的生存期相吻合[9]。
患者2、患者3[5]、患者4 和患者5[8]为复合杂合子突变,即患者ALG3 基因所在的2 条染色体上具有不同突变,疾病严重程度往往受活性高的突变体影响较大。患者2 和患者3 的突变位点相同,为W71R 和M157K,测得其对应的酿酒酵母突变蛋白Y72R 的相对活性为4.9%,而L157K 的相对活性为17.2%;同样地,患者4 和患者5 的突变位点相同,为I69T 和M209T,测得其对应的酿酒酵母突变蛋白I70T 的相对活性为2.8%,而M221T 的相对活性为22.3%。因4 位患者均有一条染色体上的突变位点对应的ALG3 蛋白保留了一定的活性,在报道[5,8]时均依然存活,为7 ~21 岁[8]。
综上所述,本研究为后续ALG3-CDG 诊断方法及疾病严重程度的预测提供了理论依据。
参·考·文·献
[1] Ferens-Sieczkowska M. Congenital disorders of glycosylation[J]. Postepy Hig Med Dosw, 2003, 57(4): 425-444.
[2] Wolfe LA, Krasnewich D. Congenital disorders of glycosylation and intellectual disability[J]. Dev Disabil Res Rev, 2013, 17(3): 211-225.
[3] Aebi M. ALG mannosyltransferases, ER lumen=alpha linkage (ALG3, 9, 12)[M]//Taniguchi N, Honke K, Fukuda M, et al. Handbook of glycosyltransferases and related genes. Tokyo: Springer, 2014: 1249-1254.
[4] Sun LW, Eklund EA, Chung WK, et al. Congenital disorder of glycosylation id presenting with hyperinsulinemic hypoglycemia and islet cell hyperplasia[J]. J Clin Endocrinol Metab, 2005, 90(7): 4371-4375.
[5] Kranz C, Sun LW, Eklund EA, et al. CDG-Id in two siblings with partially different phenotypes[J]. Am J Med Genet, 2007, 143A(13): 1414-1420.
[6] Rimella-Le-huu A, Henry H, Kern I, et al. Congenital disorder of glycosylation type Ⅰ d (CDG Ⅰ d): phenotypic, biochemical and molecular characterization of a new patient[J]. J Inherit Metab Dis, 2008, 31(Suppl 2): S381-S386.
[7] Stibler H, Stephani U, Kutsch U. Carbohydrate-deficient glycoprotein syndrome: a fourth subtype[J]. Neuropediatrics, 1995, 26(5): 235-237.
[8] Riess S, Reddihough DS, Howell KB, et al. ALG3-CDG (CDG-Ⅰ d): clinical, biochemical and molecular findings in two siblings[J]. Mol Genet Metab, 2013, 110(1/2): 170-175.
[9] Lepais L, Cheillan D, Frachon SC, et al. ALG3-CDG: Report of two siblings with antenatal features carrying homozygous p.Gly96Arg mutation[J]. Am J Med Genet A, 2015, 167(11): 2748-2754.
[10] Haeuptle MA, Hennet T. Congenital disorders of glycosylation: an update on defects affecting the biosynthesis of dolichol-linked oligosaccharides[J]. Hum Mutat, 2009, 30(12): 1628-1641.
[11] Ng BG, Shiryaev SA, Rymen D, et al. ALG1-CDG: clinical and molecular characterization of 39 unreported patients[J]. Hum Mutat, 2016, 37(7): 653-660.
[12] Frank CG, Eyaid W, Berger EG, et al. Identification and functional analysis of a defect in the human ALG9 gene: definition of congenital disorder of glycosylation type IL[J]. Am J Hum Genet, 2004, 75(1): 146-150.
[13] Zufferey R, Knauer R, Burda P, et al. STT3, a highly conserved protein required for yeast oligosaccharyl transferase activity in vivo[J]. EMBO J, 1995, 14(20): 4949-4960.
[14] Aebi M, Gassenhuber J, Domdey H, et al. Cloning and characterization of the ALG3 gene of Saccharomyces cerevisiae[J]. Glycobiology, 1996, 6(4): 439-444.
[15] Korner C. Carbohydrate deficient glycoprotein syndrome type Ⅳ : deficiency of dolichyl-P-Man: Man5GlcNAc2-PP-dolichyl mannosyltransferase[J]. EMBO J, 1999, 18(23): 6816-6822.
[16] Kranz C, Basinger AA, Güçsavaş-Çalıkoğlu M, et al. Expanding spectrum of congenital disorder of glycosylation Ⅰ g (CDG- Ⅰ g): sibs with a unique skeletal dysplasia, hypogammaglobulinemia, cardiomyopathy, genital malformations, and early lethality[J]. Am J Med Genet A, 2007, 143(12): 1371-1378.
[17] Li ST, Wang N, Xu S, et al. Quantitative study of yeast Alg1 β-1,4 mannosyltransferase activity, a key enzyme involved in protein N-glycosylation[J]. Biochim Biophys Acta Gen Subj, 2017, 1861(1): 2934-2941.
[18] Kefala G, Kwiatkowski W, Esquivies L, et al. Application of Mistic to improving the expression and membrane integration of histidine kinase receptors from Escherichia coli[J]. J Struct Funct Genomics, 2007, 8(4): 167-172.
[19] 李盛陶. 体外重构N-糖基化途径中多萜醇寡糖前体的合成[D]. 无锡: 江南大学, 2018.
[20] Li ST, Lu TT, Xu XX, et al. Reconstitution of the lipid-linked oligosaccharide pathway for assembly of high-mannose N-glycans[J]. Nat Commun, 2019, 10: 1813.
[21] 李庆猛, 李盛陶, 王宁, 等. 酵母来源α-1,2甘露糖转移酶Alg11的异源表达、纯化和活性分析[J]. 中国生物工程杂志, 2018, 38(6): 26-33.
[22] Ho SN, Hunt HD, Horton RM, et al. Site-directed mutagenesis by overlap extension using the polymerase chain reaction[J]. Gene, 1989, 77(1): 51-59.
[23] Burgos J, Hemming FW, Pennock JF, et al. Dolichol: a naturally-occurring c100 isoprenoid alcohol[J]. Biochem J, 1963, 88(3): 470-482.
