上海市普陀区脑卒中后血管性痴呆危险因素的配对病例对照研究
2021-01-13陈晨叶健施佳丽
陈晨 叶健 施佳丽
摘 要 目的:探讨脑卒中后血管性痴呆(VaD)的危险因素,为预防脑卒中后VaD的发生提供科学依据。方法:本研究为病例对照研究,选取2011年1月至2019年1月收治的142例脑卒中后VaD患者,并按性别、年龄为匹配条件,选取142例脑卒中后未出现VaD的患者进行1∶1配对。142对病例中,男性68对,女性74对,平均年龄(82.99±8.71)岁,其中<80岁41对,≥80岁101对。采用多因素条件logistic回归分析包括合并疾病、生化指标、吸烟史、教育水平等因素与VaD的关系。结果:VaD的发病与下列4种因素关系密切:冠心病(OR=2.370,95%CI:1.114~5.042);糖尿病(OR=2.841,95%CI:1.292~6.247);高尿酸血症(OR=2.447,95%CI:1.025~5.840),贫血(OR=2.190,95%CI:1.277~3.757)。结论:脑卒中后应积极防治冠心病,控制血糖,防止血尿酸过高或过低,纠正贫血以降低脑卒中后VaD的发病率。
关键词 血管性痴呆;危险因素;配对病例对照研究
中图分类号:R743.3 文献标志码:A 文章编号:1006-1533(2021)24-0016-04
Matched case-control study of risk factors of vascular dementia after stroke in Putuo District of Shanghai
CHEN Chen1, YE Jian1, SHI Jiali2
(1.Department of Cardiology of Putuo Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200062, China; 2. General Practice Department of Xinjiangwancheng Community Health Service Center, Yangpu District, Shanghai 200438, China)
ABSTRACT Objective: To explore the risk factors of vascular dementia(VD) after stroke, so as to provide scientific basis for the prevention of VD after stroke. Methods: This study was a case-control study, and 142 post-stroke VD patients who were admitted from January 2011 to January 2019 were selected, and according to gender and age as matching conditions, 142 patients who did not develop VD after stroke were selected for 1:1 matching. Among 142 cases, there were 68 males and 74 females, with an average age of (82.99±8.71) years, among them, 41 pairs were < 80 years old and 101 pairs were ≥ 80 years old. Multivariate conditional logistic regression analysis was used to analyze the relationship between VD and combined diseases, biochemical indexes, smoking history, education level and other factors. Results: The incidence of VD is closely related to the following four factors: coronary heart disease(OR=2.370, 95%CI: 1.114~5.042); diabetes(OR=2.841, 95%CI: 1.292~6.247); hyperuricemia(OR=2.447), 95%CI: 1.025~5.840), anemia (OR=2.190, 95%CI: 1.277~3.757). Conclusion: After stroke, it is necessary to actively prevent and treat coronary heart disease, control blood sugar, prevent excessive or low blood uric acid, and correct anemia to reduce the incidence of VD after stroke.
KEY WORDS vascular dementia; risk factor;matched case-control study
血管性癡呆(vascular dementia,VaD)是仅次于阿尔兹海默病的常见痴呆类型,在65岁以上老年人群中VaD的患病率为1.5%,并呈上升趋势[1]。目前,尚无针对VaD病理的药物应用于临床,因此重视VaD的早期预防具有重要的临床意义。VaD的发生与脑血管病变有关,既往研究认为高龄、低教育水平、高血压、糖尿病、房颤、高脂血症、吸烟、高同型半胱氨酸、胰岛素抵抗等是影响VaD的重要危险因素[2]。目前,对部分危险因素已达成共识,但也有部分影响因素(如高尿酸血症)的研究出现了截然相反的研究结果。为进一步探讨本地区脑卒中后VaD发生的危险因素,加强VaD的预防,本文对142例脑卒中后未出现VaD的患者和142例脑卒中后VaD患者进行了研究,现报道如下。
1.1 一般资料
选取2011年1月至2019年1月上海中医药大学附属普陀医院脑卒中后诊断为VaD的病例142例,均符合《2019年中国血管性认知障碍诊治指南》[3]标准,存在认知损害、脑卒中病史,明确脑卒中在认知损害中占主导地位。排除:(1)阿尔兹海默病、帕金森病、原发性神经系统疾病(如多发性硬化、脑炎等);(2)神经影像学检查中缺乏血管性损伤病变;(3)其他可解释认知损害的疾病如脑肿瘤、抑郁症、中毒,以及明显影响认知功能的系统性疾病及代谢异常等。并根据性别和年龄按1∶1配对选取上海中医药大学附属普陀医院142例脑梗死后无VaD的病例。本研究中男性68对(47.89%),女性74对(52.11%),年龄48~100岁,平均年龄(82.99±8.71)岁,其中<80岁41对,≥80岁101对。
1.2 方法
检索医院电子病例系统,对符合条件的患者进行临床资料采集。纳入的危险因素包括:是否合并冠心病、糖尿病、高血压、房颤、贫血、心功能不全(NYHA分级II级及以上)、肾功能不全(血肌酐升高)、肝功能受损(丙氨酸转氨酶或天冬氨酸转氨酶升高)、空腹血糖升高、糖化血红蛋白升高、总胆固醇升高、三酰甘油升高、低密度脂蛋白升高、高密度脂蛋白降低、血清脂蛋白α升高、高尿酸血症、高同型半胱氨酸血症、C反应蛋白(CRP)升高、B型利钠肽(BNP)升高、射血分数EF降低(<50%)、吸烟和低教育水平(小学及初中教育)等。
1.3 统计分析
收集的临床数据经2名不同的医师单独录入后审核并校正。变量赋值见表1。用SPSS 24.0进行单因素和多因素的条件Logistic回归分析。对单因素条件Logistic回归分析有统计学意义(α≤0.15)的可能危险因素,采用逐步向前法,按α=0.10剔除变量水准,进行多因素条件Logistic回归分析,得出与脑卒中后VaD相关的独立危险因素。

2.1 单因素条件Logistic回归分析
对是否合并冠心病、糖尿病、高血壓和房颤等22个变量进行单因素条件Logistic回归分析(α=0.15),显示合并冠心病、糖尿病、贫血、高尿酸血症、肾功能不全、CRP升高、高密度脂蛋白降低可以增加脑卒中后VaD的发病风险(表2)。
2.2 多因素条件Logistic回归分析
对上述有意义的单因素进行多因素条件Logistic回归分析(保留变量水平0.05,剔除变量水平0.10),显示合并冠心病、糖尿病、贫血、高尿酸血症为脑卒中后VaD发病的有意义的危险因素,其OR值分别为2.370、2.841、2.190、2.447,其95%CI分别为(1.114,5.042)、(1.292,6.247)、(1.277,3.757)、(1.025,5.840),见表3。
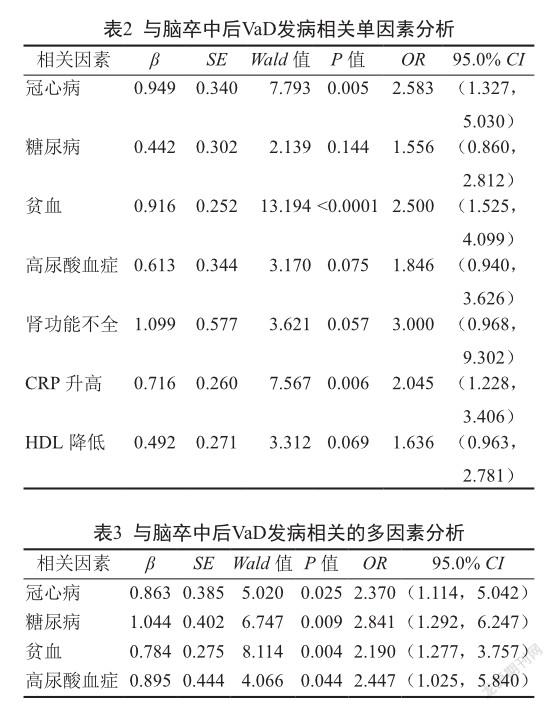
有关脑卒中后VaD危险因素的配对病例对照研究并不多,本研究中脑卒中后VaD患者<80岁41例,≥80岁101例,在一定程度上反映了随着年龄增大,VaD发生的风险增加。142对病例中,男性68对,女性74对,可见性别对VaD的影响并不大。本研究显示,排除年龄和性别的不可控危险因素的干扰之后,合并冠心病、糖尿病、高尿酸血症和贫血是脑卒中后VaD发生的危险因素。
3.1 冠心病和VaD的关系
在本研究142对配对病例中,脑卒中后未出现VaD的患者中合并冠心病的17例,脑卒中后VaD的患者中合并冠心病的36例。研究结果提示合并冠心病的脑卒中患者发生VaD的风险增加(OR=2.37,95%CI:1.114~5.042)。冠心病的诊断可通过典型的临床症状、心电图心肌缺血改变、平板运动试验、核素心肌显像、冠状动脉(冠脉)CTA及造影等手段明确。不能排除两组患者中均有冠心病未诊断的情况,结果可能产生偏倚。新近一项荟萃分析显示冠心病是VaD的危险因素(RR=1.34,95%CI:1.28~1.39)[4]。有研究表明,对于 80岁以上的老年患者,低的冠脉钙化评分与减少的痴呆风险相关[5]。有研究者对所有诊断为痴呆或认知障碍的住院患者进行系统的心脑血管检查,发现即使既往没有被诊断为脑血管病和(或)冠心病,实际上常合并严重但无明显症状的心脑血管疾病如冠心病,或者严重的脑大血管疾病[6]。因此,临床要重视痴呆患者冠心病和脑卒中的筛查。冠心病的发生代表了更严重的动脉粥样硬化,同样会影响到脑血管。冠心病导致的相对下降的心输出量和更严重的脑动脉粥样硬化可能导致脑灌注下降。此外,微栓塞和炎症因子的释放可能也起到了一定的作用[7]。
3.2 糖尿病和VaD的关系
在本研究142对配对病例中,脑卒中后未出现VaD的患者中合并糖尿病的33例,脑卒中后VaD的患者中合并糖尿病的43例。研究结果提示合并糖尿病的脑卒中患者发生VaD的风险增加(OR=2.84,95%CI:1.292~6.247)。值得注意的是,在本研究中空腹血糖升高和糖化血红蛋白升高并非脑卒中后VaD发生的危险因素。可能的解释是,单次空腹血糖的影响因素较多,无法代表患者真实的血糖水平,近期血糖控制尚可的糖尿病患者可能有既往糖尿病高血糖的损害,血糖存在波动。样本量太小可能也对结果产生了影响。糖尿病与脑卒中风险增加有关,此外,糖尿病患者合并低血糖的发生增加了痴呆的风险。诸多研究显示,糖尿病与VaD密切相关[8-10],患有糖尿病相关并发症的患者,尤其是脑卒中和神经病变、快速进展的血管疾病患者,痴呆的风险增高[11]。糖尿病患者的MRI检查发现皮质和皮质下轻微的脑萎缩,平均总脑容量减少0.5%~2.0%;皮质下小血管梗死,大脑微出血。糖尿病引起的小血管病变可能导致神经元缺血、脑白质紊乱、或协助潜在的神经毒性介质从血浆渗漏到血管周围组织[12]。血管内皮功能失调、炎症和血脑屏障损伤、血管源性的脑白质病、脱髓鞘和轴突丢失、过氧化膜损伤、线粒体功能障碍和神经退行性变等机制可能参与了糖尿病患者的痴呆进展[13]。糖尿病指南也推荐对于大于65岁的糖尿病患者常规进行痴呆筛查。
3.3 貧血和VaD的关系
在本研究142对配对病例中,脑卒中后未出现VaD的患者中合并贫血的51例,脑卒中后VaD的患者中合并贫血的82例。研究结果提示合并贫血的脑卒中患者发生VaD的风险增加(OR=2.19,95%CI:1.277~3.757)。有研究对1 227例老年人随访4.4年后发现,低血红蛋白患者的认知障碍风险增加37%(95% CI:1.08~1.75,P= 0.01),低血红蛋白浓度可预测老年人认知障碍的发生[14]。德国一项研究表明,与非贫血患者相比,贫血患者在语言记忆和执行功能方面表现较差,贫血与轻度认知功能障碍有关(OR=1.92,95%CI:1.09~3.39),独立于传统的心血管危险因素[15]。一项队列研究显示,低血红蛋白水平与急性缺血性脑卒中后认知功能损害独立相关(OR=3.637,95%CI:1.216~10.881),更高的血红蛋白水平与更好的认知水平相关[16]。通过对比头颅MRI显像,有研究发现过低或过高的血红蛋白水平与痴呆的风险增加有关(U型曲线),这可能与白质完整性和脑灌注的差异有关[17]。由于血液携氧能力下降,贫血可能导致慢性脑缺氧。严重的贫血甚至可能导致缺血性脑卒中。脑卒中后的贫血可能会加重缺血半暗带的损伤。贫血可能代表了缺血状态或者低促红细胞生成素状态,增加了神经退化、铁调节异常的风险,增加了大脑的氧化应激,加速了大脑的衰老[18]。贫血引起的疲劳减少了身体活动,减少了大脑来源的营养因子,减少了副交感神经相关的前额叶神经功能效率,从而引发痴呆。
3.4 高尿酸血症和VaD的关系
氧化应激参与了VaD的进展,被认为是VaD的危险因素[19]。而尿酸是嘌呤代谢的终末氧化产物,承担了血浆中60%的抗氧化能力,被认为具有神经保护作用。另一方面,尿酸增高与心脑血管事件风险增加有关,可能增加痴呆风险。尿酸可能通过激活内皮细胞,增加血小板粘附加重动脉粥样硬化。高尿酸可能导致机体炎症反应,增加对脑血管的损伤。之前的研究发现尿酸与脑白质高信号和脑白质萎缩有关[20]。临床研究也出现了不一致的结论。有研究对比了我国127例VaD患者和81例非痴呆患者的血清尿酸水平,VaD组的尿酸水平低于非痴呆组,且认知水平简易智力状态检查量表(MMSE)得分与尿酸水平呈正相关。该研究认为,较低的血清尿酸水平与认知功能障碍有关,可作为VaD的潜在预测指标[21]。有研究随访了瑞典1 462名38~60岁女性,发现高尿酸者有更低的VaD风险(HR=0.66,CI:0.47~0.94)[22]。另一项研究显示,在墨西哥老年人群中更高的尿酸水平与较低的认知能力下降风险有关[23]。然而,关于尿酸水平和痴呆关系的研究结果并不一致。一项意大利研究表明,尿酸水平在VaD患者中高于非痴呆者[24]。一项横断面研究显示,社区老年痴呆患者尿酸水平高于非痴呆者,独立于其他混杂因素,尿酸水平处于最高三分位数的老年人患痴呆的概率高出三倍(OR=3.32,95%CI:1.06~10.42),而尿酸水平处于中间三分位数的老年人患痴呆的概率高于处于最低三分位数的老年人[25]。法国一项1 598人的队列研究表明老年人患痴呆症的风险,尤其是VaD或混合性痴呆,可能随着血清尿酸水平的升高而增加(HR=3.66,95%CI:1.29~10.41)[26]。人群的选择(性别、年龄、种族等的差异)、随访时间的长短、样本量的差异可能解释了出现不同结果的原因。本研究中,脑卒中组的尿酸水平为300(242.5,361)μmol/L,痴呆组的尿酸水平为298(243,379)μmol/L,组间差异无统计学意义,但是伴高尿酸血症的VaD组(34例)明显多于脑卒中组(21例)。尿酸水平和痴呆风险可能呈现一个U型曲线,过高的尿酸水平可能掩盖其带来的获益。将尿酸控制在靠近正常上限值可能是合理的。
综上所述,本研究是根据患者的性别和年龄进行匹配的配对病例对照研究,一方面排除了性别和年龄对结果产生的影响,提高了组间的可比性,但也因此删去了部分脑卒中后无VaD(对照组)的患者,可能无法完全代表这部分患者的临床特征。研究的样本量也偏小,可能对结果产生影响。笔者认为,对于高龄患者脑卒中事件发生后,积极筛查和防治冠心病和糖尿病,避免低血糖事件的发生,纠正贫血,将尿酸控制在正常上限值附近可能有助于预防VaD的发生。
参考文献
[1] Jia J, Wang F, Wei C, et al. The prevalence of dementia in urban and rural areas of China[J]. Alzheimers Dement, 2014, 10(1): 1-9.
[2] Iadecola C. The pathobiology of vascular dementia[J]. Neuron, 2013, 80(4): 844-866.
[3] 中国医师协会神经内科分会认知障碍专业委员会, 《中国血管性认知障碍诊治指南》编写组. 2019年中国血管性认知障碍诊治指南[J]. 中华医学杂志, 2019, 99(35): 2737-2744.
[4] Liang X, Huang Y, Han X. Associations between coronary heart disease and risk of cognitive impairment: A metaanalysis[J]. Brain Behav, 2021, 11(5): e02108.
[5] Kuller LH, Lopez OL, Mackey RH, et al. Subclinical Cardiovascular Disease and Death, Dementia, and Coronary Heart Disease in Patients 80+ Years[J]. J Am Coll Cardiol, 2016, 67(9): 1013-1022.
[6] Bajenaru O, Antochi F, Tiu C. Particular aspects in patients with coronary heart disease and vascular cognitive impairment[J]. J Neurol Sci, 2010, 299(1-2): 49-50.
[7] Abete P, Della-Morte D, Gargiulo G, et al. Cognitive impairment and cardiovascular diseases in the elderly. A heart-brain continuum hypothesis[J]. Ageing Res Rev, 2014, 18: 41-52.
[8] Doney ASF, Bonney W, Jefferson E, et al. Investigating the relationship between type 2 diabetes and dementia using electronic medical records in the GoDARTS bioresource[J]. Diabetes Care, 2019, 42(10): 1973-1980.
[9] Secnik J, Cermakova P, Fereshtehnejad SM, et al. Diabetes in a large dementia cohort: clinical characteristics and Treatment from the swedish dementia registry[J]. Diabetes Care, 2017, 40(9): 1159-1166.
[10] Chatterjee S, Peters SA, Woodward M, et al. Type 2 Diabetes as a risk factor for dementia in women compared with men: a pooled analysis of 2.3 million people comprising more than 100,000 cases of dementia[J]. Diabetes Care, 2016, 39(2): 300-307.
[11] Chang PY, Wang II, Chiang CE, et al. Vascular complications of diabetes: natural history and corresponding risks of dementia in a national cohort of adults with diabetes[J]. Acta Diabetol, 2021, 58(7): 859-867.
[12] Biessels GJ, Strachan MW, Visseren FL, et al. Dementia and cognitive decline in type 2 diabetes and prediabetic stages: towards targeted interventions[J]. Lancet Diabetes Endocrinol, 2014, 2(3): 246-255.
[13] Biessels GJ, Despa F. Cognitive decline and dementia in diabetes mellitus: mechanisms and clinical implications[J]. Nat Rev Endocrinol, 2018, 14(10): 591-604.
[14] Trevisan C, Veronese N, Bolzetta F, et al. Low hemoglobin levels and the onset of cognitive impairment in older people: the PRO.V.A. study[J]. Rejuvenation Res, 2016, 19(6): 447-455.
[15] Dlugaj M, Winkler A, Weimar C, et al. Anemia and mild cognitive impairment in the german general population[J]. J Alzheimers Dis, 2016, 49(4): 1031-1042.
[16] He W, Ruan Y, Yuan C, et al. Hemoglobin, anemia, and poststroke cognitive impairment: A cohort study[J]. Int J Geriatr Psychiatry, 2020, 35(5): 564-571.
[17] Wolters FJ, Zonneveld HI, Licher S, et al. Hemoglobin and anemia in relation to dementia risk and accompanying changes on brain MRI[J]. Neurology, 2019, 93(9): e917-e926.
[18] Dr?ge W, Schipper HM. Oxidative stress and aberrant signaling in aging and cognitive decline[J]. Aging Cell, 2007, 6(3): 361-370.
[19] Luca M, Luca A, Calandra C. The Role of oxidativedamage in the pathogenesis and progression of alzheimer’s disease and vascular dementia[J]. Oxid Med Cell Longev, 2015, 2015: 504678.
[20] Shih CY, Chen CY, Wen CJ, et al. Relationship between serum uric acid and cerebral white matter lesions in the elderly[J]. Nutr Metab Cardiovasc Dis, 2012, 22(2): 154-159.
[21] Xu Y, Wang Q, Cui R, et al. Uric acid is associated with vascular dementia in Chinese population[J]. Brain Behav, 2017, 7(2): e00617.
[22] Scheepers L, Jacobsson LTH, Kern S, et al. Urate and risk of Alzheimer’s disease and vascular dementia: A populationbased study[J]. Alzheimers Dement, 2019, 15(6): 754-763.
[23] Méndez-Hernández E, Salas-Pacheco J, Ruano-Calderón L, et al. Lower uric Acid linked with cognitive dysfunction in the elderly[J]. CNS Neurol Disord Drug Targets, 2015, 14(5): 564-566.
[24] Cervellati C, Romani A, Seripa D, et al. Oxidative balance, homocysteine, and uric acid levels in older patients with Late Onset Alzheimer’s Disease or Vascular Dementia[J]. J Neurol Sci, 2014, 337(1-2): 156-161.
[25] Ruggiero C, Cherubini A, Lauretani F, et al. Uric acid and dementia in community-dwelling older persons[J]. Dement Geriatr Cogn Disord, 2009, 27(4): 382-389.
[26] Latourte A, Soumaré A, Bardin T, et al. Uric acid and incident dementia over 12 years of follow-up: a population-based cohort study[J]. Ann Rheum Dis, 2018, 77(3): 328-335.
