雪胆素甲对胃癌细胞SGC-7901增殖和侵袭能力的影响
2021-01-13曹淑君初向华李宗莉张翠萍孙向红
曹淑君 初向华 李宗莉 张翠萍 孙向红
(青岛大学附属医院,山东 青岛 266003 1 药剂科; 2 消化内科)
雪胆素甲(CuⅡa)是雪胆属植物的主要活性成分,近年来研究显示,CuⅡa通过诱导细胞凋亡、抗血管生成及氧化应激等途径发挥抗肿瘤作用,可作为新型的潜在抗癌药物[1-3]。如CuⅡa通过不可逆的促进肌动蛋白的聚集及抑制凋亡抑制基因survivin的表达,从而抑制癌细胞的增殖[1]。CuⅡa 能明显抑制人肺癌细胞系NCI-H460和A549增殖并诱导其凋亡,其机制可能与抑制AuroraA、STAT3及Cofilin等多种信号通路有关[4]。然而,Wnt/β-catenin信号的调节与肿瘤细胞代谢高度相关,其激活可导致多种肿瘤细胞的化疗抗性[5-6]。因此,靶向Wnt/β-catenin信号通路的治疗能有效抑制肿瘤生长[7]。研究显示,在Wnt/β-catenin信号通路中,糖原合成酶激酶3β(GSK-3β)的激活可导致β-连环蛋白(β-catenin)降解障碍,β-catenin进入细胞核内,与核内转录因子TCF/LEF形成复合体,进一步使得细胞周期素D1(CyclinD1)、C-myc等靶基因激活,导致细胞周期的调控异常,从而引起肿瘤的发生发展[8-9]。CuⅡa对胃癌Wnt/β-catenin信号通路的调节作用尚少见报道,本研究旨在探讨CuⅡa对胃癌SGC-7901细胞增殖和迁移能力的影响及其分子作用机制,以期为胃癌的临床治疗开辟新的途径。现将结果报告如下。
1 材料与方法
1.1 材料来源
人胃癌SGC-7901细胞购自中国科学院上海细胞所。CuⅡa购自中国药品生物制品检定所;胎牛血清(FBS)、RIP细胞裂解液、PVDF膜和ECL化学发光试剂购自Millipore公司(美国);RPMI1640培养基及双抗(青霉素和硫酸链霉素)购自Hyclone(美国);CCK-8 试剂盒、凋亡检测试剂盒购自DoJindo公司(日本);β-catenin、CyclinD1、GSK-3β和辣根过氧化物酶标记的羊抗兔二抗购自Cell Signaling公司(美国);兔抗人C-myc购买自Abcam 公司(英国);兔抗人GAPDH购买自伊莱瑞特生物科技股份有限公司;CuⅡa以DMSO溶解成浓度为20 mmol/L,冻存于-20 ℃,使用时以无血清的RPMI1640培养基将CuⅡa稀释成0.01、0.1、1、10、100 μmol/L的浓度。
1.2 细胞培养
将人胃癌SGC-7901细胞置于含体积分数为0.10胎牛血清的RPMI1640培养基,于37 ℃、含体积分数为0.05 CO2的细胞培养箱中进行无菌培养,每2~3 d传代1次,细胞达到对数生长期后用于后续实验。
1.3 以CCK-8法检测细胞增殖抑制率
取对数生长期的SGC-7901细胞,以5×103/孔的密度接种于96孔板中,细胞贴壁后,分别加入0、0.01、0.1、1、10、100 μmol/L的CuⅡa溶液(A、B、C、D、E、F组)孵育48 h后,每孔加入10 μL CCK-8于37 ℃孵育4 h,用酶标仪测定450 nm波长处的吸光度值,每个样本设置4个复孔。试验重复3次,取均值。
1.4 以Transwell小室检测细胞迁移能力
以0、0.01、0.1、1、10、100 μmol/L的CuⅡa溶液(A、B、C、D、E、F组)作用SGC-7901细胞48 h后,上室加入含有20×105个SGC-7901细胞的悬浮液,下室加入600 μL的无血清培养基作用24 h,移去下室培养基,以甲醇固定15 min后,加入含体积分数为0.001结晶紫溶液染色10 min。以PBS清洗后用棉签擦去上室上面的细胞,风干后在显微镜下取3个视野,照相,计算穿膜细胞数。
1.5 以流式细胞仪检测细胞凋亡能力
以0、0.01、0.1、1、10、100 μmol/L的CuⅡa 溶液(A、B、C、D、E、F组)作用SGC-7901细胞48 h以后,用预冷的PBS洗涤2次,加入5 μL AnnexinV-FITC 和5 μL PI solution,轻轻混匀,室温下避光孵育15 min后,加入1×Annexin V Binding Solution 400 μL,采用流式细胞仪检测细胞凋亡率。
1.6 以蛋白免疫印迹法(Western blot方法)检测β-catenin、GSK-3β、C-myc和CyclinD1蛋白表达
以0、0.01、0.1、1、10、100 μmol/L的CuⅡa溶液(A、B、C、D、E、F组)处理SGC-7901细胞48 h后,用RIPA裂解液裂解细胞后离心,取上清液,用BCA试剂盒测定蛋白浓度。在SDS-PAGE凝胶中,每个泳道加入30 μg的蛋白样品,80 V 30 min及110 V 1 h电泳分离蛋白,电转至PVDF膜上,以50 g/L脱脂奶粉室温封闭1 h,然后将条带分别加入β-catenin、GSK-3β、C-myc和CyclinD1一抗液中,4 ℃孵育过夜,TBST洗膜3次,每次15 min,二抗37 ℃下孵育1 h,TBST洗膜3次,每次15 min,ECL显影。以Image J软件分析目的蛋白条带与GAPDH灰度比值,计算相对表达量。
1.7 统计学分析
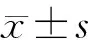
2 结 果
2.1 CuⅡa对胃癌细胞增殖的影响
CuⅡa作用SGC-7901细胞48 h后,A、B、C、D、E及F组细胞增殖抑制率分别为0、5.54±0.59、12.37±2.20、21.73±2.07、35.60±1.41、48.13±5.49,组间比较差异具有显著意义(F=98.346,P<0.05);B、C、D、E、F组细胞增殖抑制率与A组比较,差异有显著性(P<0.05)。
2.2 CuⅡa对SGC-7901细胞迁移的影响
CuⅡa作用SGC-7901细胞48 h后,A、B、C、D、E、F组迁移细胞数分别为168.16±13.06、144.26±8.19、125.36±10.09、103.63±7.18、79.09±4.24、46.15±11.06、48.13±5.49,组间比较差异有显著意义(F=44.662,P<0.05);C、D、E、F组迁移细胞数与A组比较,差异有显著意义(t=3.652~10.243,P<0.05);B组迁移细胞数与A组比较,差异无显著意义(P>0.05)。见图1。

A、B、C、D、E、F分别为A、B、C、D、E、F组
2.3 各组细胞凋亡水平比较
CuⅡa作用SGC-7901细胞48 h后,A、B、C、D、E及F组细胞的凋亡率分别为(10.18±0.98)%、(12.59±0.95)%、(16.34±0.74)%、(18.32±1.24)%、(32.49±0.74)%、(57.68±1.42)%,组间比较差异有显著统计学意义(F=15.812,P<0.05);C、D、E、F组细胞的凋亡率与A组比较,差异具有显著统计学意义(t=7.078~38.926,P<0.05);B组细胞凋亡率与A组比较,差异无显著的统计学意义(P>0.05)。见图2。
2.4 CuⅡa对于SGC-7901细胞β-catenin、C-myc、CyclinD1和GSK-3β蛋白表达的影响
CuⅡa作用SGC-7901细胞48 h后,在A、B、C、D、E、F组中β-catenin、C-myc、CyclinD1和GSK-3β蛋白表达量比较差异均具有显著性(F=8.494~21.763,P<0.05);C、D、E、F组β-catenin、C-myc、CyclinD1和GSK-3β的蛋白表达量与A组比较,差异均有显著性(t=2.889~7.868,P<0.05);而B组β-catenin、C-myc、CyclinD1和GSK-3β蛋白表达量相与A组比较,差异无显著意义(P>0.05)。见图3、表1。
3 讨 论
胃癌是世界上最常见的恶性肿瘤之一,肿瘤细胞的侵袭和转移是导致复发的主要原因[10]。特别是在中国,胃癌高居恶性肿瘤发病率的第二位,死亡率高达36%[11]。胃癌患者的临床治疗包括手术及化疗和放疗等辅助治疗[12]。但总体治疗效果有限,因此胃癌的治疗仍面临重大的挑战[13-14]。
研究显示,中药对肿瘤有一定的抑制作用,具有副作用小、价格便宜等优点,易于被患者接受[15-16]。在医疗实践中,中医药被广泛应用于各种疾病的治疗中[17-19]。CuⅡa是中药雪胆的主要成分,毒性低,具有抗炎、抗肿瘤等作用[20-21]。研究发现CuⅡa可抑制肺腺癌细胞的黏附和迁移,从而促进肿瘤细胞凋亡[4]。本研究通过观察CuⅡa处理后胃癌细胞SGC-7901增殖、凋亡、侵袭和迁移情况的变化,探讨CuⅡa是否具有抗胃癌的作用。结果显示,CuⅡa处理后的C、D和E组细胞活力和迁移穿膜细胞数量均低于A组,但细胞总凋亡率均高于A组,提示CuⅡa具有抑制胃癌细胞SGC-7901增殖、侵袭和迁移并促进其凋亡的作用。

A、B、C、D、E、F分别为A、B、C、D、E、F组

A、B、C、D、E、F分别为A、B、C、D、E、F组

表1 CuⅡa对SGC-7901细胞Wnt/β-catenin信号通路蛋白表达的影响
Wnt/β-catenin是一个经典的信号通路,对人类肿瘤的发生、发展和预后有重要意义[22-23]。研究发现β-catenin有多种功能,可通过Wnt/β-catenin途径发挥重要的作用,也是整条通路的关键枢纽分子[24-25]。当Wnt/β-catenin在肿瘤细胞中处于激活状态时,Wnt配体与细胞膜上的卷曲蛋白(Frizzled)相关蛋白结合以后,在低密度脂蛋白受体相关蛋白(LRP)作用下,激活细胞内的蓬乱蛋白(Dvl)使GSK-3β发生磷酸化并抑制其活性,导致β-catenin与Ecadherin、APC、Axin、GSK-3β等复合物解离,进而使得β-catenin去磷酸化,并转移到细胞核与TCF/LEF形成复合物,诱导其下游靶基因C-myc、CyclinD1激活,通过调控细胞分化和生长来调控细胞周期[26-27]。反之,当Wnt受体没有与Wnt配体结合时,细胞内β-catenin降解复合物形成,促进了β-catenin的降解,抑制了Wnt信号的转导[6,28]。因此,β-catenin目前已经成为治疗肿瘤重要靶点之一,因此抑制该通路的活化为肿瘤的治疗提供了新的可行性。
为进一步探讨CuⅡa对Wnt/β-catenin信号转导作用,本研究检测了β-catenin、C-myc、CyclinD1以及GSK-3β蛋白的表达情况。Western blot检测结果显示,CuⅡa作用SGC-7901细胞48 h后,细胞中β-catenin、C-myc和CyclinD1蛋白水平均显著下调,GSK-3β蛋白的表达显著上调。但B组细胞β-catenin、GSK-3β、C-myc和CyclinD1蛋白表达与A组比较无明显的统计学差异,这可能与剂量不够,达不到抑制蛋白表达的作用有关。本研究结果表明,在Wnt/β-catenin信号通路中,CuⅡa可能是通过激活GSK-3β的表达导致β-catenin复合物无法形成而抑制β-catenin蛋白,进而抑制C-myc和CyclinD1的蛋白表达,从而抑制胃癌细胞增殖和迁移。
综上所述,CuⅡa抑制胃癌发生的机制可能与抑制Wnt/β-catenin通路激活有关,进而抑制胃癌细胞的增殖及其迁移能力。因此,CuⅡa可能是胃癌治疗的潜在抗癌药物,其抑制Wnt/β-catenin信号通路和随后下调Wnt靶基因的表达可能是抑制胃癌发生的分子机制。其抗肿瘤效应机制为该重要天然产物后续研究提供了理论依据。
