基于全外显子测序技术分析胰腺导管癌体细胞突变与患者临床特征的关系
2021-01-13宋瑶琳纪彬彬刘相兰杨平王博梁乐彬王爱兰杨家亮田埂邢晓明
宋瑶琳 纪彬彬 刘相兰 杨平 王博 梁乐彬 王爱兰 杨家亮 田埂 邢晓明
(1 青岛大学附属医院病理科,山东 青岛 266021; 2 元码基因科技(北京)股份有限公司; 3 烟台毓璜顶医院病理科)
胰腺癌是高度致死性的恶性肿瘤之一,死亡率居全球第四。大多数胰腺癌患者确诊时已无法通过手术切除病灶,治疗的中位生存期仅6~9个月,5年生存率低于5%,而行手术治疗后患者的生存率也不足25%。因此,胰腺癌的诊疗是目前面临的主要挑战之一[1-2]。尽管全球范围内已针对胰腺癌进行了数十年的基础和临床转化研究,但仅有极少数新疗法进入了临床批准阶段[3]。胰腺癌患者的不良预后主要归因于胰腺癌细胞的快速转移,因此了解胰腺癌细胞转移的遗传分子机制,对于进行有效的靶向治疗至关重要。
近年来,下一代测序技术在胰腺癌发生发展分子机制的研究中广泛应用[4],在揭示胰腺癌的遗传基础、基因突变和发现新的驱动基因方面发挥了重要作用。识别胰腺癌体细胞突变和临床特征之间的相关性,发现新的肿瘤基因组生物标记物,有利于对患者进行更加精准治疗[5-6]。本研究应用胰腺导管癌(PDAC)患者的肿瘤组织进行外显子组测序,并应用COSMIC数据库验证体细胞单核苷酸多态性(SNP)位点,评估依靠单样本测序数据识别致癌体细胞突变的可行性;同时,分析鉴定致癌体细胞突变与患者临床病理特征之间的相关性。
1 材料与方法
1.1 样本收集与外显子组测序
收集2009—2011年在青岛大学附属医院行手术切除的PDAC患者的肿瘤组织样本40例,患者术前均未接受过放疗以及化疗治疗。该研究获得青岛大学附属医院伦理委员会的批准(审批号QDFY WZLL 26052),并严格按照《人类和动物权利声明》以及《赫尔辛基宣言》执行。 40例患者当中男22例,女18例;年龄43~80岁,其中43~60岁者18例,61~80岁者22例;发病部位于胰体/胰尾者20例,胰头者20例;临床分期Ⅰ期者7例,Ⅱ期者18例,Ⅲ期者5例,Ⅳ期者10例;肿瘤组织高分化者2例,中分化者15例,低分化者23例。根据不同临床特征将样本分为不同的亚组:按照肿瘤分期分为Ⅰ/Ⅱ期组和Ⅲ/Ⅳ期组2个亚组;高分化组仅有2例,无统计意义,因此本研究按照肿瘤组织分化程度分为中、低分化组2个亚组。
取PDAC患者的肿瘤组织样本甲醛固定并石蜡包埋,通过QIAamp DNA试剂盒(Qiagen公司,美国)提取基因组DNA并进行片段化处理后,构建DNA测序文库,并与安捷伦人类全外显子靶向富集V1(Agilent Technologies,美国)杂交,得到捕获产物,纯化后用以扩增形成全外显子组。再通过Qubit 2.0 Fluorometer(Thermo Fisher Scientific,美国)和Agilent Bioanalyzer 2100(Agilent Technologies,美国)对全外显子组进行质检,质检合格后于Illumina NovaSeq(Illumina,美国)测序仪上进行150个碱基末端配对测序,测序深度为77~251X,平均深度为153X,获得样本中的外显子组结果。
1.2 致癌体细胞突变分析
1.2.1致癌体细胞突变筛选 将Illumina测序碱基质量值转换为Sanger标准测序碱基质量值,默认算法为Burrows-Wheeler Aligner(BWA)算法(版本0.7.0),将测序结果与人类参考基因组(Hg19)进行比对,并过滤掉比对到基因组多处的序列。然后,应用基因组分析工具包(GATK)和Maftools R包对过滤后的数据进行分析。为提高致癌体细胞突变检测结果的可信度,首先通过COSMIC数据库(突变均来自于体细胞)过滤并下载VCF文件,过滤条件如下:将注释为COSMIC癌症体细胞突变目录数据库包含的常见SNP或非编码基因变异过滤掉;然后再通过隐马尔可夫模型的功能分析工具进一步过滤掉FATHMM数据库中没有标注为致病性的突变;最后过滤掉突变比率低于5%或唯一比对但序列数量小于10的变异。最终剩余的数据用于致癌体细胞突变分析。
1.2.2TCGA突变数据比较 在TCGA数据库中下载PDAC临床测序数据及对应的临床资料,并应用MuTect2软件生成突变注释格式(MAF)文件。MAF文件中的致癌体细胞突变过滤标准如下:测序深度≥10,突变比率≥5%,突变类型设定为错义突变、同义突变,SIFT选择有害,生物类型选择蛋白编码,ExAC_AF<1%,FILTER选择PASS;临床资料的过滤标准设置为:肿瘤病理类型为PDAC,肿瘤发病部位包括胰头、胰体或胰尾。
1.3 PDAC肿瘤组织样本基因突变的通路分析及基因突变互斥性与共现性分析
按照协同和互斥的表现形式,将突变模式分为共现性和互斥性。使用MAFtools函数somatic Interactions对选中的基因突变两两之间进行Fisher检验,分析基因突变的共现性。在进行互斥性分析时,同时对基因两两之间进行分析,按照有无突变构建2×2的列联表,并采用CoMEt(Combinations of Mutually Exclusive Alterations)确定肿瘤中相互排斥变化组合的统计方法,CoMEt包括针对互斥性的精确统计测试,以及对多组互斥和特定于子类型的变更进行同时分析的技术,通过CoMEt检验法计算显著性,可以寻找包含>2基因的互斥基因集。
1.4 PDAC肿瘤组织的基因突变与临床病理特征关系分析
使用KEGG数据库分析PDAC肿瘤组织样本基因突变的数量和百分比,通过费舍尔提取测试方法分析临床特征各亚组与基因突变之间的关系。
1.5 统计分析
采用Python软件完成统计与分析,通过χ2检验分析临床特征各亚组与基因突变之间的关系,以P<0.05为差异有统计学意义。
2 结 果
2.1 PDAC肿瘤组织样本的全外显子组测序结果
40例PDAC肿瘤组织样本共发现1 446处致癌体细胞突变位点,涉及759个基因,每例样本包含25~82处致癌体细胞突变位点。PDAC肿瘤组织样本的检测平均覆盖率为99.2%,PDAC肿瘤组织样本产生的高质量碱基长度平均为15.8×109bp,可与人类参考基因组序列唯一比对的碱基序列占比为84.3%。
2.2 PDAC肿瘤组织样本中致癌体细胞突变类型分析和突变谱鉴定
对PDAC肿瘤组织样本中致癌体细胞的突变类型进行统计,样本体细胞突变类型中构成比占前3位的分别为C>A突变、C>T突变、T>A突变,分别占48%、45%、6%,每例样本中均包含有上述3种类型基因突变,其中碱基颠换(Tv)的构成比为 56.8%,碱基转换(Ti)的构成比为 43.2%。
在发现的致癌体细胞突变中,每个PDAC肿瘤组织样本平均有38个错义突变,2个同义突变(图1A);在1 446处致癌体细胞突变中对突变的体细胞进行分析,排名前10位的突变基因名称及其百分比如图1B所示。本研究对PDAC的肿瘤分期的每个样本的平均突变数量进行分析,其中PDAC临床分期为Ⅰ期的突变数量为42个,Ⅱ期为40个,Ⅲ期为37个,Ⅳ期为42个,致癌体细胞突变的数量在肿瘤的不同分期中无显著差异(图1C)。TCGA数据库中PDAC致癌体细胞突变的平均数量为45个,本研究中的PDAC样本测序数据集中在40个左右的范围,总体和TCGA数据库中PDAC测序数据相符,突变数量与TCGA数据库相比,分布更为集中(图1D)。
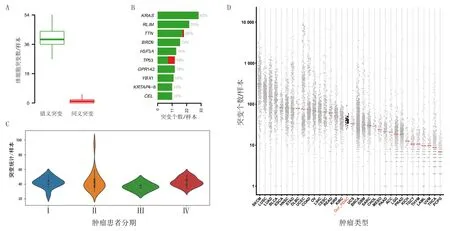
A:错义突变和同义突变数量的箱线图;B:突变百分比前10位基因的名称及其百分比;C:不同肿瘤分期的体细胞突变情况比较;D:TCGA数据库中不同类型肿瘤的致癌体细胞突变数量分布图,其中灰色点表示突变数量的范围,红色线表示突变数量的平均数
2.3 PDAC肿瘤组织样本中突变基因的相关信号通路分析及基因突变互斥性、共现性分析
本研究针对单个PDAC肿瘤组织样本突变精准研究结果如图2A所示,其中每列代表一个样本,绿色和红色标记相应的突变位点和突变总数量,单个样本包含的突变数量为40个左右,其中1个样本突变数量为82个,同一样本中同时含有KRAS与TTN基因双突变的数量最多,KRAS与RLIM基因双突变的频率排名第二,而在不含有KRAS基因突变的样本中,高双突变样本多包含RLIM基因突变,同时本样本中同义突变集中于TP53和TTN基因。对PDAC肿瘤组织样本中突变基因的相关信号通路进行分析,显示涉及到的信号通路共10个,分别为7tm_1、 FN3、 Cadherin、 WD40、LIC、COG1100、PDZ_signaling、 COG5048、 PTZ00018、 DUF3512通路,其中7tm_1、 FN3及Cadherin通路是突变位点富集较多的通路(图2B)。
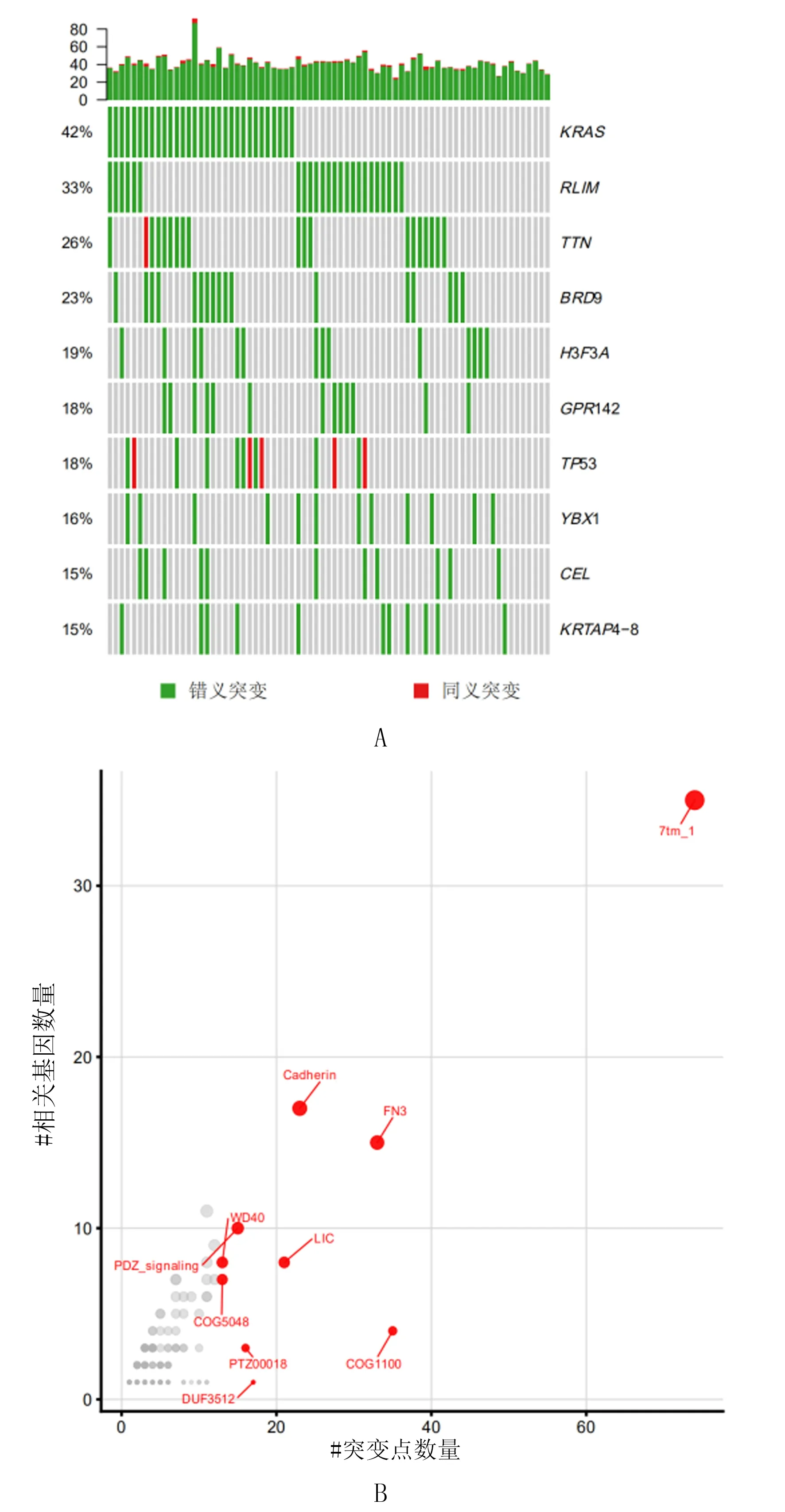
A:单个PDAC肿瘤组织样本中体细胞突变百分比排名前10位的基因突变分析;B:信号通路分析中相关基因的突变情况,红色的圆点为生物学信号通路,对应X轴为该信号通路中出现的基因突变数量,对应的Y轴以及圆点的大小为与该信号通路有关的基因数量,圆点越靠右上方表示基因突变位点的数量和基因数量越多
本研究结果显示,在PDAC中不同基因之间存在着基因互斥性和共现性的现象,如BMS1基因可以与OR4K5、COL6A3、BPGRIP1L、CEP170B、MAP1B、CDC27基因发生共突变,CDC27基因可以与OR4K5、COL6A3、BPGRIP1L、CEP170B以及MAP1B基因发生共突变;MAP1B基因可与OR4K5、COL6A3、BPGRIP1L、CEP170B基因发生共突变(图3A)。相反的,某些基因突变间存在互斥性的现象,如RLIM基因与OR4K5、COL6A3、CEP170B以及BDR9存在突变互斥。由于基因KRAS和RLIM突变研究的结果较多,本研究主要对TTN基因突变位点以及氨基酸方面的改变进行研究,TTN基因突变位点共有10处,其中在3例样本当中发现了6处突变位点,均为C>T点的突变(c.53359C>T、c.53734C>T、c.53935C>T、c.72850C>T、c.75631C>T、c.80554C>T),在氨基酸层面上均为精氨酸到半胱氨酸(R>C)的改变(p.R17787C、p.R17912C、p.R17979C、p.R24284C、p.R25211C、p.R26852C),进一步结合患者的临床特征,显示这3例样本均来自于低分化组亚组。TTN基因的全部突变点如图3B所示,突变热点聚集在lg_Semaphorin_C、lg_Titin_like结构域,而且仅发现1个同义突变,其余均为错义突变。
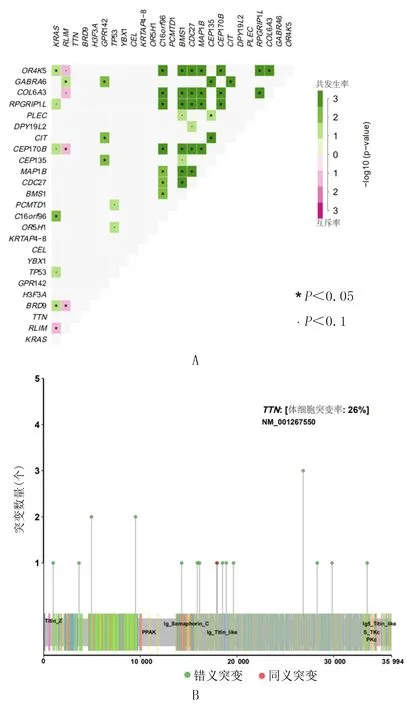
A:基因共突变和互斥突变的分布图;B:TTN基因上的突变位点,Y轴表示每个位点的突变频次
2.4 PDAC肿瘤组织样本中基因突变与患者临床特征的关系
本研究结果显示,不同肿瘤分化程度的患者ASTN1基因突变情况比较差异有显著意义(χ2=6.855,P<0.05);不同肿瘤分期患者TTN基因突变情况比较差异有显著性(χ2=5.183,P<0.05)。见表1。
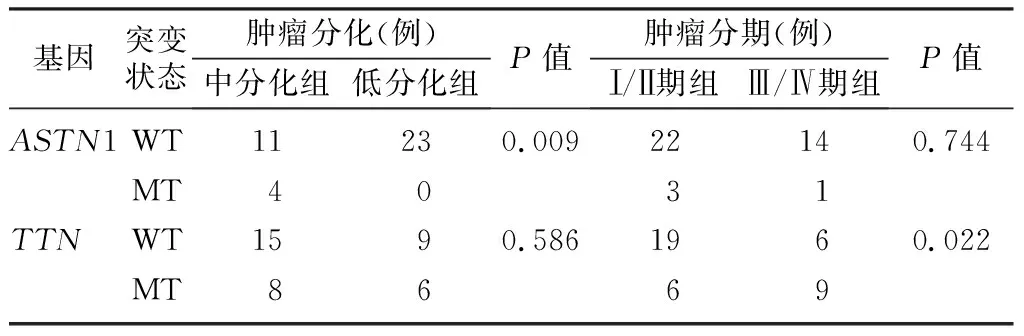
表1 PDAC肿瘤组织样本中ASTN1、TTN基因突变与患者临床特征的关系
3 讨 论
目前,胰腺肿瘤性病变中体细胞突变与患者临床特征间关系的研究已有报道,但该研究仅局限于50个胰腺癌相关的基因[7]。以往研究结果显示,胰腺癌组织中存在多种致癌体细胞的突变,这些突变会影响关键致癌驱动基因以及肿瘤抑制基因,包括KRAS、TP53、CDKN2A以及SMAD4基因等,而目前尚不清楚哪些突变是导致肿瘤细胞转移的突变[8-9]。因此,利用全外显子测序结果分析胰腺癌体细胞突变和临床特征之间的关系是必要的,从而前瞻性地指导患者的治疗[10]。
通常,病理医生判断肿瘤患者的某一突变为体系突变还是胚系突变时,需要同一患者来源的肿瘤与非肿瘤组织的NGS测序数据。在多种肿瘤的体细胞突变研究中多使用配对组织分析方法,其中TCGA为常见的泛肿瘤数据库,包含了多种类型的肿瘤与瘤旁样本的测序数据[11]。然而,在临床及实验室实践中有时难以获取配对的瘤旁样本,特别是在回顾性研究中,通常会缺乏与石蜡包埋的肿瘤样本配对的非肿瘤样本,因此仅应用肿瘤样本分析体细胞突变的研究目前比较多[12-17]。
本研究采用的是全外显子测序的方法,通过与COSMIC数据库中的SNP进行比对用以鉴别入组的PDAC样本中致癌体细胞的突变情况,结果在40例PDAC肿瘤组织样本的759个基因中,总共检测出1 446个致癌体细胞突变位点,每例样本中发现有25~82个致癌体细胞突变位点,与之前所发表的PDAC肿瘤组织中平均有48个致癌体细胞突变位点的结论相符合[18]。众所周知,KRAS基因的致癌突变是PDAC发展的主要驱动因素,本研究结果也表明KRAS基因体细胞突变发生频率最高。这些结果与以往的研究报道一致,验证了本研究方法对肿瘤样本分析的有效性[19-20]。
本研究结果显示,PDAC肿瘤组织中的RLIM、TTN和BRD9基因突变发生的百分比仅次于KRAS基因,表明这些基因在PDAC的发生发展中起着重要作用[21]。RLIM/RNF12基因编码一种含RING域的E3泛素连接酶,通过负调控c-Myc转录活性来抑制细胞增殖,并通过消除MDM2介导的P53降解和泛素化来稳定TP53蛋白[22]。此外,RLIM蛋白已被证实在乳腺癌发生过程中调节雌激素依赖性转录和雌激素受体的生物活性,也有研究表明RLIM可通过诱导P15和P21蛋白而抑制肝细胞癌变[23]。这些研究成果为RLIM基因在癌症生物学中的关键作用提供了更多证据,但目前针对RLIM基因与PDAC的报道较少。编码titin蛋白的TTN基因在脊椎动物横纹肌正常生理功能中具有重要作用,而在原发性胰腺癌和PDAC中TTN基因均有频繁突变[24-25]。IZUMI等[15]对一组纤维肌病患者进行了连锁分析以及外显子组测序,发现c.90263G>T(NM_001256850)为一新的TTN基因突变。MIHAILOV等[16]分析了3例腹股沟疝患者的家族成员的全外显子测序结果,发现了一个新的TTN基因c.88880A>C杂合错义突变。这些都表明,TTN基因在多种疾病的发生发展过程中均发挥重要作用。同时,在胰腺神经内分泌肿瘤组织中BRD9基因突变检出百分比较高,该基因编码含溴结构域蛋白9的表达,是SWI/SNF染色质重塑复合体的一个组成蛋白[26]。本研究通过对PDAC肿瘤组织相关信号通路基因的突变分析,发现3个与PDAC相关的重要信号通路。此外,本研究分析了基因突变的互斥性和共现性,确定基因之间潜在的相互作用,可以更好地指导临床靶向、化疗和免疫治疗等。
肿瘤组织中已存在的某个驱动基因突变会影响其他驱动基因的突变,这种现象被称为驱动基因的互斥性。与互斥模式相反,驱动基因间也会存在协同模式,两个协同的驱动突变往往同时发生,共同促进肿瘤的发展,这种现象被称为共突变。在进行突变分析时确定肿瘤组织中基因突变潜在的相互作用,可以更好地了解肿瘤发生发展的机制,从而更好地指导临床用药。本研究结果表明,PDAC肿瘤组织样本中BMS1、CDC27、MAP1B基因共突变的可能性较高,即如果样本中BMS1基因发生突变,则CDC27和MAP1B基因也极可能发生突变。相反的,某些基因突变间存在互斥,例如RLIM基因与OR4K5、COL6A3、CEP170B、BDR9存在突变互斥,即在一个样本中如果发生RLIM基因突变,则OR4K5、COL6A3、CEP170B、BDR9基因几乎不会发生突变。
本研究结果亦显示,在PDAC患者Ⅲ/Ⅳ期组中TTN基因突变显著富集,提示TTN与高分期PDAC密切相关[27-28]。但是,TTN基因突变与肿瘤的分化程度之间没有关系,提示晚期富集突变不是由肿瘤分化程度所引起。遗憾的是,TCGA数据库中与本研究中Ⅲ/Ⅳ期患者对应的样本的数量太少,无法验证富集程度,因此本研究没有进行进一步的分析。本研究结果同时显示,ASTN1基因突变与肿瘤的分化程度有关,而与肿瘤分期无关。同时,KRAS、TP53、SMAD4及CDKN2A基因突变与所分析的临床特征没有明显的关系,与先前研究报道结果一致[29-30]。
本研究仍存在一些局限性。首先,本研究使用的应用COSMIC数据库中的变异SNP拟合方法鉴定肿瘤组织中致癌体细胞突变,虽可以有效识别体细胞突变,但缺少匹配的非肿瘤样本,致使通过全基因组关联分析鉴定PDAC体细胞突变缺乏全面性;其次收集的肿瘤样本量较少。综上所述,本研究揭示了PDAC中体细胞突变与患者临床特征之间的关系,发现了胰腺癌组织中KRAS、RLIM、TNN等基因突变频率高,进而发现了与高频突变基因相关的信号通路FN3。另外,本研究表明BMS1、CDC27、MAP1B基因共突变概率较高,而RLIM基因与OR4K5、COL6A3、CEP170B、BDR9基因存在突变互斥现象。最后本研究还阐明了TTN和ASTN1基因突变与肿瘤分化程度以及肿瘤分期的关系,为PDAC患者的精准治疗提供了一定的理论参考依据。
